医薬品情報
| 総称名 | コンサータ |
|---|---|
| 一般名 | メチルフェニデート塩酸塩 |
| 欧文一般名 | Methylphenidate Hydrochloride |
| 製剤名 | メチルフェニデート塩酸塩徐放錠 |
| 薬効分類名 | 中枢神経刺激剤 |
| 薬効分類番号 | 1179 |
| ATCコード | N06BA04 |
| KEGG DRUG |
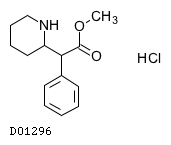
D01296
メチルフェニデート塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年6月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| コンサータ錠18mg | Concerta Tablets | ヤンセンファーマ | 1179009G1022 | 235.8円/錠 | 劇薬, 向精神薬(第一種), 処方箋医薬品※ |
| コンサータ錠27mg | Concerta Tablets | ヤンセンファーマ | 1179009G2029 | 261.9円/錠 | 劇薬, 向精神薬(第一種), 処方箋医薬品※ |
| コンサータ錠36mg | Concerta Tablets | ヤンセンファーマ | 1179009G3025 | 280.5円/錠 | 劇薬, 向精神薬(第一種), 処方箋医薬品※ |
1. 警告
1.1 本剤の投与は、注意欠陥/多動性障害(AD/HD)の診断、治療に精通し、かつ薬物依存を含む本剤のリスク等について十分に管理できる、管理システムに登録された医師のいる医療機関及び薬剤師のいる薬局において、登録患者に対してのみ行うこと。また、それら薬局においては、調剤前に当該医師・医療機関・患者が管理システムに登録されていることを確認した上で調剤を行うこと。
1.2 本剤の投与にあたっては、患者(小児の場合には患者又は代諾者)に対して、本剤の有効性、安全性、及び目的以外への使用や他人への譲渡をしないことを文書によって説明し、文書で同意を取得すること。
2. 禁忌
次の患者には投与しないこと
2.1 過度の不安、緊張、興奮性のある患者[中枢神経刺激作用により症状を悪化させることがある。]
2.2 閉塞隅角緑内障の患者[眼圧を上昇させるおそれがある。]
2.3 甲状腺機能亢進のある患者[循環器系に影響を及ぼすことがある。]
2.4 不整頻拍、狭心症のある患者[症状を悪化させるおそれがある。]
2.5 本剤の成分に対し過敏症の既往歴のある患者
2.6 運動性チックのある患者、Tourette症候群又はその既往歴・家族歴のある患者[症状を悪化又は誘発させることがある。]
2.7 重症うつ病の患者[抑うつ症状が悪化するおそれがある。]
2.8 褐色細胞腫又はパラガングリオーマのある患者[血圧を上昇させるおそれがある。]
2.9 モノアミンオキシダーゼ(MAO)阻害剤を投与中又は投与中止後14日以内の患者[10.1参照]
4. 効能または効果
注意欠陥/多動性障害(AD/HD)
5. 効能または効果に関連する注意
5.2 AD/HDの診断は、米国精神医学会の精神疾患の診断・統計マニュアル(DSM注))等の標準的で確立した診断基準に基づき慎重に実施し、基準を満たす場合にのみ投与すること。
注)Diagnostic and Statistical Manual of Mental Disorders
6. 用法及び用量
<18歳未満の患者>
通常、18歳未満の患者にはメチルフェニデート塩酸塩として18mgを初回用量、18〜45mgを維持用量として、1日1回朝経口投与する。増量が必要な場合は、1週間以上の間隔をあけて1日用量として9mg又は18mgの増量を行う。なお、症状により適宜増減する。ただし、1日用量は54mgを超えないこと。
<18歳以上の患者>
通常、18歳以上の患者にはメチルフェニデート塩酸塩として18mgを初回用量として、1日1回朝経口投与する。増量が必要な場合は、1週間以上の間隔をあけて1日用量として9mg又は18mgの増量を行う。なお、症状により適宜増減する。ただし、1日用量は72mgを超えないこと。
7. 用法及び用量に関連する注意
7.1 本剤は中枢神経刺激作用を有し、その作用は服用後12時間持続するため、就寝時間等を考慮し、午後の服用は避けること。
7.2 初回用量
本剤投与前に他のメチルフェニデート塩酸塩製剤を服用している場合には、その用法及び用量を考慮し、本剤の初回用量を18歳未満の患者では18〜45mg、18歳以上の患者では18〜72mgの範囲で決定する。ただし、本剤若しくは他のメチルフェニデート塩酸塩製剤の服用を1ヵ月以上休薬した後に本剤を服用する場合は、18mgを初回用量とすること。
7.3 本剤は徐放性製剤であるため分割して投与することは適切でなく、本剤は18mg錠、27mg錠及び36mg錠の3種類のみで18mgが最小単位であるため、9mg単位の増減量が必要な場合には錠剤の種類を変更して投与すること。
8. 重要な基本的注意
8.1 本剤を投与する医師又は医療従事者は、投与前に患者(小児の場合には患者及び保護者又はそれに代わる適切な者)に対して、本剤の治療上の位置づけ、依存性等を含む本剤のリスクについて、十分な情報を提供するとともに、適切な使用法について指導すること。
8.2 小児に本剤を長期投与した場合に体重増加の抑制、成長遅延が報告されている。本剤の投与が長期にわたる場合には患児の成長に注意し、身長や体重の増加が思わしくない時は投与を中断すること。また、成人においても体重減少が報告されているので、観察を十分に行い、体重減少が著しい場合には投与を中断するなど、適切な処置を行うこと。
8.3 本剤を長期間投与する場合には、個々の患者に対して定期的に休薬期間を設定して有用性の再評価を実施すること。また、定期的に血液学的検査を行うことが望ましい。
8.4 心血管系に対する影響を観察するため、本剤の投与期間中は、定期的に心拍数(脈拍数)及び血圧を測定すること。[9.1.2参照]
8.5 まれに視覚障害の症状(調節障害、霧視)が報告されている。視覚障害が認められた場合には、眼の検査を実施し、必要に応じて投与を中断又は中止すること。
8.6 めまい、眠気、視覚障害等が発現するおそれがあるので、本剤投与中の患者には、自動車の運転等危険を伴う機械の操作には従事させないよう注意すること。
8.7 攻撃性はAD/HDにおいてしばしば観察されるが、本剤の投与中にも攻撃性の発現や悪化が報告されている。投与中は、攻撃的行動の発現又は悪化について観察すること。
8.8 通常量の本剤を服用していた精神病性障害や躁病の既往がない患者において、幻覚等の精神病性又は躁病の症状が報告されている。このような症状の発現を認めたら、本剤との関連の可能性を考慮すること。投与中止が適切な場合もある。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 てんかん又はその既往歴のある患者
痙攣閾値を低下させ、発作を誘発させるおそれがある。
9.1.2 高血圧、心不全、心筋梗塞を起こしたことのある患者
血圧又は心拍数を上昇させるおそれがある。[8.4参照]
9.1.3 患者の心疾患に関する病歴、突然死や重篤な心疾患に関する家族歴等から、心臓に重篤ではないが異常が認められる、若しくはその可能性が示唆される患者
本剤の投与を検討する場合には、投与開始前に心電図検査等により心血管系の状態を評価すること。
9.1.4 脳血管障害(脳動脈瘤、血管炎、脳卒中等)のある患者又はその既往歴のある患者
これらの症状を悪化又は再発させることがある。
9.1.5 精神系疾患(統合失調症、精神病性障害、双極性障害)のある患者
行動障害、思考障害又は躁病エピソードの症状が悪化するおそれがある。
9.1.6 薬物依存又はアルコール中毒等の既往歴のある患者
慢性的乱用により過度の耐性及び様々な程度の異常行動を伴う精神的依存を生じる可能性がある。
9.1.7 心臓に構造的異常又は他の重篤な問題のある患者
因果関係は確立していないが、本剤の投与による突然死の報告がある。
9.1.8 高度な消化管狭窄のある患者
本剤は消化管内でほとんど変形しない錠剤であり、本剤の服用により、まれに閉塞症状が報告されている。[14.3参照]
9.1.9 開放隅角緑内障の患者
眼圧を上昇させるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。動物実験(ウサギ)において、最大推奨用量の約100倍に相当する200mg/kg/日の投与により催奇形性が報告されている。
9.6 授乳婦
9.7 小児等
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
10.1 併用禁忌
| MAO阻害剤 セレギリン (エフピー) ラサギリン (アジレクト) サフィナミド (エクフィナ) [2.9参照] | 高血圧クリーゼ等の重篤な副作用発現のおそれがある。MAO阻害剤を投与中又は投与中止後14日以内の患者には本剤を投与しないこと。 | 脳内モノアミン総量が増加するおそれがある。 |
10.2 併用注意
| 昇圧剤 | 昇圧作用を増強することがある。 | 本剤は交感神経刺激作用を有するため。 |
| クマリン系抗凝血剤 ワルファリン | クマリン系抗凝血剤の作用を増強することがある。 | クマリン系抗凝血剤の半減期を延長させる。 |
| 抗痙攣剤 フェノバルビタール フェニトイン プリミドン | 抗痙攣剤の作用を増強することがある。 | 本剤はこれらの薬剤の代謝を阻害すると考えられる。 |
| 三環系抗うつ剤 イミプラミン等 選択的セロトニン再取り込み阻害剤 フルボキサミン パロキセチン セルトラリン エスシタロプラム | 三環系抗うつ剤、選択的セロトニン再取り込み阻害剤の作用を増強することがある。 | 本剤はこれらの薬剤の代謝を阻害すると考えられる。 |
| 選択的ノルアドレナリン再取り込み阻害剤 アトモキセチン | 本剤の作用が増強するおそれがあるため、注意して投与すること。 | ノルアドレナリンへの作用を相加的又は相乗的に増強する可能性がある。 |
| クロニジン [15.1参照] | メチルフェニデート塩酸塩製剤との併用により、突然死の報告がある3)。 | 機序不明 |
| アルコール | 精神神経系の副作用を増強することがある。 | アルコールは本剤の精神神経系の作用を増強させる。 |
| リスデキサンフェタミン | 本剤投与中の患者には投与を避けることが望ましい。リスデキサンフェタミンの作用が増強するおそれがある。 | 相加作用のおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 剥脱性皮膚炎(頻度不明)
広範囲の皮膚の潮紅、浸潤、強いそう痒等の症状があらわれることがある。
11.1.2 狭心症(頻度不明)
11.1.3 悪性症候群(頻度不明)
発熱、高度の筋硬直、CK上昇等があらわれることがあるので、このような場合には体冷却、水分補給等の適切な処置を行うこと。
11.1.4 脳血管障害(血管炎、脳梗塞、脳出血、脳卒中)(頻度不明)
11.1.5 肝不全、肝機能障害(頻度不明)
肝不全(急性肝不全等)、肝機能障害があらわれることがある。
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 感染症 | 鼻咽頭炎 | 胃腸炎、鼻炎、ヘルペスウイルス感染、インフルエンザ、麦粒腫、中耳炎、咽頭炎 | 上気道感染、副鼻腔炎 |
| 血液障害 | 血小板減少症 | 白血球減少症、汎血球減少症、血小板減少性紫斑病 | |
| 免疫系障害 | 季節性アレルギー | アナフィラキシー反応、過敏症反応、耳介腫脹、水疱形成、表皮剥脱 | |
| 代謝障害 | 食欲減退(40.8%) | 体重増加不良、食欲亢進 | |
| 精神障害 | 不眠症(18.2%)、チック、不安、睡眠障害 | 抑うつ気分、過覚醒、気分変動、精神病性障害、激越、妄想、幻聴、緊張、神経過敏、うつ病、抜毛、怒り、無感情、歯ぎしり、リビドー減退 | 攻撃性、感情不安定、落ち着きのなさ、幻視、多弁、気分動揺、涙ぐむ、錯乱状態、失見当識、幻覚、躁病、パニック発作、リビドー亢進、自殺念慮又は企図、吃音 |
| 神経系障害 | 頭痛、浮動性めまい、振戦 | 傾眠、体位性めまい、鎮静、ジスキネジー、自律神経失調、錯感覚、緊張性頭痛 | 痙攣、精神運動亢進、大発作痙攣、嗜眠 |
| 眼障害 | ドライアイ、アレルギー性結膜炎、結膜充血、近視、眼そう痒症 | 霧視、複視、散瞳、視覚障害 | |
| 耳障害 | 難聴、耳痛、回転性めまい | ||
| 心臓障害 | 動悸(12.1%)、頻脈 | 徐脈、上室性期外収縮 | 期外収縮、上室性頻脈、心室性期外収縮 |
| 血管障害 | ほてり | 高血圧、血圧変動 | レイノー現象 |
| 呼吸器障害 | 呼吸困難 | 咳嗽、アレルギー性鼻炎、上気道の炎症、喘息、鼻漏、咽頭紅斑 | 咽喉頭疼痛、鼻出血 |
| 胃腸障害 | 悪心(11.7%)、口渇、下痢、腹痛、嘔吐、腹部不快感、口内乾燥、口内炎、便秘、上腹部痛 | 消化不良、腹部膨満、異常便、歯肉腫脹 | |
| 皮膚障害 | 発疹 | 蕁麻疹、湿疹、脱毛症、ざ瘡、アトピー性皮膚炎、多汗症、そう痒症、接触性皮膚炎 | 斑状皮疹、紅斑 |
| 筋骨格系障害 | 筋緊張 | 関節痛、筋痙縮、筋痛、四肢痛 | 筋攣縮 |
| 泌尿器系障害 | 頻尿 | ||
| 生殖系及び乳房障害 | 精巣上体炎、陰茎癒着、勃起不全 | 持続勃起症、女性化乳房 | |
| 全身障害 | 発熱、倦怠感、易刺激性、胸部不快感 | 疲労、無力症、悪寒、胸痛 | 異常高熱 |
| 臨床検査 | 体重減少(16.4%)、蛋白尿、CK増加、尿中ケトン体陽性、QT延長 | 血圧上昇、拡張期血圧上昇、脈拍異常、異常Q波、白血球数減少、好中球数減少、好酸球数増加、血中アミラーゼ増加、ALT増加、AST増加、肝機能異常、血中ビリルビン増加、トリグリセリド増加、血糖増加、血中尿素増加、血中尿酸増加、尿潜血 | 心雑音、ALP増加、肝酵素上昇、血小板数減少、白血球数異常 |
| 傷害、中毒 | 足骨折、手骨折 |
13. 過量投与
13.1 症状
主として中枢神経系の過刺激及び過度の交感神経作用に起因する以下の徴候及び症状があらわれることがある。
嘔吐、激越、振戦、反射亢進、筋攣縮、痙攣(昏睡を続発することがある)、多幸感、錯乱、幻覚、せん妄、発汗、潮紅、頭痛、高熱、頻脈、動悸、不整脈、高血圧、散瞳、粘膜乾燥
13.2 処置
自傷行為及び過刺激症状を悪化させる外部刺激を排除するように留意すること。胃洗浄を行う場合、激越や発作があれば、処置の前にコントロールを行い、気道を確保すること。高熱に対しては物理的な解熱処置をとること。過量投与患者の治療に際しては、メチルフェニデートが長時間かけて放出されることを考慮すべきである。
14. 適用上の注意
14.1 薬剤調製時の注意
本剤は浸透圧による薬物放出制御システムを利用した製剤であり、吸湿により薬物放出挙動が影響を受ける可能性があるため、本剤をPTPシートから取り出し一包化調剤することは避けること。
14.2 薬剤交付時の注意
14.2.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.2.2 服用直前までPTPシートから取り出さないよう指導すること。
14.2.3 本剤は徐放性製剤であるため、噛んだり、割ったり、砕いたり、溶解したりせず、必ず飲み物と一緒にそのまま服用するよう指導すること。
14.2.4 本剤の外皮は内部の不溶性の成分と一緒に糞便中に排泄されるが、正常なことであり心配する必要はないことを説明すること。
14.3 薬剤服用時の注意
本剤が消化管内に滞留した可能性がある場合には、腹部デジタルX線において可視化できるので、必要に応じて滞留の有無を確認すること。[9.1.8参照]
15. その他の注意
15.1 臨床使用に基づく情報
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性に本剤18、36及び54mg(18mg錠×1、2及び3錠)を単回経口投与したときの血漿中メチルフェニデート濃度は、投与後まず薬物コーティング部分の溶解による速やかな上昇を示した後、内部充填された薬物が浸透圧変化で徐々に放出されることにより緩やかな上昇を示した。血漿中メチルフェニデートのほとんどはd-異性体であり、l-異性体はほとんどが定量下限未満であった。d-異性体は投与5〜8時間後にCmaxを示し、約4時間のt1/2で消失し、本剤18〜54mg/日の用量範囲内で用量比例性を示した。5)
健康成人男性に本剤18、36及び54mgを単回経口投与したときのメチルフェニデートの血漿中濃度推移
[平均値+S.D.、(n=6)]
また、健康成人男性(n=7)に本剤36、54及び72mg(36mg錠×1錠、18mg錠×3錠及び36mg錠×2錠)を単回経口投与したときの血漿中メチルフェニデート濃度も同様の推移を示し、投与剤型による大きな差異はなく、本剤36〜72mg/日の用量範囲内で用量比例性を示した6)。
16.1.2 反復投与
健康成人男性に本剤18mg/日を1日1回、4日間反復経口投与したときの血漿中メチルフェニデート濃度は1日目と4日目で類似しており、本剤の反復投与による蓄積性は認められなかった。また、メチルフェニデートから主代謝物α-フェニル-2-ピペリジン酢酸(PPA)への代謝において反復投与による影響は認められなかった。5)
| 対象 | 試験日 | Cmax(ng/mL) | tmax(hr) | AUC(ng・hr/mL) | t1/2(hr) | AUC比 | 蓄積率 |
| メチルフェニデート | 1日目 | 3.12±0.58 | 8.7±2.1 | 42.6±7.0 | 4.3±0.2 | − | − |
| 4日目 | 3.97±1.21 | 8.0±2.5 | 46.5±9.6注) | 4.1±0.4 | − | 1.09±0.09 | |
| PPA | 1日目 | 92.9±9.81 | 9.0±1.7 | 1797.1±354.2 | 8.8±1.5 | 0.025±0.007 | − |
| 4日目 | 106.1±16.5 | 9.0±2.8 | 1772.3±319.4注) | 9.0±0.7 | 0.027±0.009 | 0.99±0.07 |
AD/HD患児を対象に本剤18、27、36、45又は54mg/日を反復経口投与したときのメチルフェニデート及びPPAの各血漿中濃度は健康成人よりも高値を示すが、用量に比例した増加を示した7)。
16.2 吸収
16.2.1 食事による影響
16.3 分布
ヒト血漿蛋白結合率
メチルフェニデート約15〜16%(in vitro、平衡透析法)10)
16.4 代謝
16.5 排泄
健康成人男性に本剤を単回(18、36及び54mg/日)及び反復(18mg/日、4日間)経口投与したときのメチルフェニデート及びPPAの累積尿中排泄率(単回:投与後48時間、反復:初回投与後120時間)はそれぞれ投与量の約1%及び約73〜78%であり、増量や反復経口投与による影響は認められなかった5)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相臨床試験(小児)
国内でDSM-IV診断基準に基づき、AD/HDと診断された6〜12歳の患児を対象に、第III相プラセボ対照ランダム化治療中止試験を実施した。FAS 89例において、主要評価項目であるWash-in期と二重盲検期のADHD Rating Scale-IV日本語版(ADHD RS-IV-J)のトータルスコアの変化量(平均値±S.D.)は、親評価では本剤投与群−15.6±10.8、プラセボ投与群−8.0±9.7、教師評価では本剤投与群−12.6±10.5、プラセボ投与群−3.6±9.3と、いずれの評価も本剤投与群でプラセボ投与群に比し、有意な低下が認められた(p=0.0008、p<0.0001;t検定)。11)
ADHD RS-IV-Jのトータルスコアの変化量(第III相プラセボ対照ランダム化治療中止試験での二重盲検期とベ−スラインにおけるスコアの差を表示;平均値−S.D.)
親評価(家庭版)
教師評価(学校版)
17.1.2 国内長期投与試験(小児)
国内で実施した長期投与試験99例において、ADHD RS-IV-Jのトータルスコアの変化量(平均値±S.D.)は、親評価では投与6ヵ月後−17.7±11.3、12ヵ月後−17.9±12.5、18ヵ月後−19.8±12.6、教師評価では投与6ヵ月後−15.3±12.7、12ヵ月後−13.0±14.5(18ヵ月後は実施せず)と、いずれの評価もベースラインに比し、有意な低下が認められた(いずれもp<0.0001;対応のあるt検定)12)。
| 評価 | 評価時期 | 例数 | 平均値±S.D.[95%信頼区間] |
| 親評価 | 投与6ヵ月後 | 88 | −17.7±11.3[−20.1,−15.3] |
| 投与12ヵ月後 | 80 | −17.9±12.5[−20.7,−15.1] | |
| 投与18ヵ月後 | 49 | −19.8±12.6[−23.4,−16.2] | |
| 教師評価 | 投与6ヵ月後 | 50 | −15.3±12.7[−18.9,−11.7] |
| 投与12ヵ月後 | 58 | −13.0±14.5[−16.8,−9.2] |
17.1.3 国内第III相臨床試験(成人)
国内でDSM-IV-TR診断基準に基づき、AD/HDと診断された18〜64歳の患者を対象に、第III相プラセボ対照ランダム化二重盲検試験を実施した。FAS 283例において、主要評価項目である最終評価時のCAARS-O:SV(日本語版)のDSM-IV Total ADHD Symptomsスコアのベースラインからの変化量(平均値±S.D.)は、本剤投与群−12.5±9.3、プラセボ投与群−7.9±9.6と、本剤投与群でプラセボ投与群に比し、有意な低下が認められた(p<0.0001;共分散分析)。13)
CAARS-O:SV(日本語版)のDSM-IV Total ADHD Symptomsスコアの変化量(第III相プラセボ対照ランダム化二重盲検試験での最終評価時とベースラインにおけるスコアの差を表示;平均値−S.D.)
本剤投与群における安全性評価対象例143例中、副作用は94例(65.7%)に認められた。その主なものは、食欲減退53例(37.1%)、動悸26例(18.2%)、悪心21例(14.7%)、口渇19例(13.3%)、不眠症13例(9.1%)、頭痛10例(7.0%)、体重減少10例(7.0%)であった。
17.1.4 国内長期投与試験(成人)
国内で実施した長期投与試験253例において、CAARS-O:SV(日本語版)のDSM-IV Total ADHD Symptomsスコアのベースラインからの変化量(平均値±S.D.)は、投与4週後−14.7±8.8、12週後−15.8±9.4、24週後−16.7±9.8、36週後−17.5±9.8、48週後−18.3±9.9と、いずれの評価時もベースラインに比し、スコアの低下が認められた14)。
| 評価時期 | 例数 | 平均値±S.D.[95%信頼区間] |
| 投与4週後 | 248 | −14.7±8.8[−15.8,−13.6] |
| 投与12週後 | 240 | −15.8±9.4[−17.0,−14.6] |
| 投与24週後 | 218 | −16.7±9.8[−18.0,−15.4] |
| 投与36週後 | 211 | −17.5±9.8[−18.9,−16.2] |
| 投与48週後 | 205 | −18.3±9.9[−19.6,−16.9] |
安全性評価対象例253例中、副作用は180例(71.1%)に認められた。その主なものは、食欲減退76例(30.0%)、体重減少49例(19.4%)、動悸40例(15.8%)、悪心35例(13.8%)、不眠症33例(13.0%)、口渇26例(10.3%)であった。
18. 薬効薬理
18.1 作用機序
メチルフェニデートは、ドパミン及びノルアドレナリントランスポーターに結合し再取り込みを抑制することにより、シナプス間隙に存在するドパミン及びノルアドレナリンを増加させて神経系の機能を亢進するものと考えられているが、AD/HDの治療効果における詳細な作用機序は十分に解明されていない15)。
18.2 AD/HDモデルに対する作用(ラット)
AD/HDのモデル動物である幼若期の脳卒中易発症性自然発症高血圧ラットにメチルフェニデート塩酸塩0.01〜0.1mg/kgを単回腹腔内投与したところ、多動性の指標となる新奇環境における自発運動量の減少が認められた。また、注意力(集中力)の指標としての短期記憶をY字迷路を用いた自発的交替行動法により評価したところ、0.01〜1mg/kgにおいて用量依存的に自発的交替行動率の増加が認められ短期記憶の改善が認められた。16)
18.3 光学異性体の薬理活性
メチルフェニデートは、d-体とl-体からなるラセミ混合物であり、ドパミントランスポーターに対しd-体はl-体よりも約12倍強い結合能を示した17)。
19. 有効成分に関する理化学的知見
19.1. メチルフェニデート塩酸塩
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 本剤が、注意欠陥/多動性障害(AD/HD)の診断、治療に精通した医師によって適切な患者に対してのみ処方されるとともに、薬物依存を含む本剤のリスク等について十分に管理できる医療機関及び薬局においてのみ取り扱われるよう、製造販売にあたって必要な措置を講じること。これらの措置は令和元年12月1日までに実施すること。なお、同年12月1日前に本剤を処方していた医師については令和2年9月30日まで、また、令和元年12月1日前に本剤を服用していた患者については令和2年12月31日までは変更前の承認条件の下で取り扱うことができる。
22. 包装
<コンサータ錠18mg>
100錠[10錠(PTP)×10]
<コンサータ錠27mg>
100錠[10錠(PTP)×10]
<コンサータ錠36mg>
100錠[10錠(PTP)×10]
23. 主要文献
- Hackett LP,et al., Ann Pharmacother., 40, 1890-1891, (2006) »PubMed
- Spigset O,et al., Am J Psychiatry., 164, 348, (2007) »PubMed
- Popper CW., J Child Adolesc Psychopharmacol., 5, 157-166, (1995)
- National Toxicology Program.;TR No.439, (1995)
- 社内資料:安藤隆康:健康成人におけるコンサータ錠の薬物動態の検討(JNS001-JPN-01)(2013年12月20日承認、CTD 2.7.6.8)
- 社内資料:健康成人におけるコンサータ錠の薬物動態の検討(CONCERTA NAP1003)(2013年12月20日承認、CTD 2.7.6.3)
- 社内資料:安藤隆康:AD/HD患児におけるコンサータ錠の薬物動態の検討(JNS001-JPN-03-1)(2007年10月26日承認、CTD 2.7.6.12)
- 社内資料:コンサータ錠の薬物動態に及ぼす食事の影響(2007年10月26日承認、CTD 2.7.6.13)
- 社内資料:コンサータ錠の薬物動態に及ぼす食事の影響(C-A-002)(2013年12月20日承認、CTD 2.7.6.1)
- Hungund BL,et al., Br J Clin Pharmacol., 8, 571-576, (1979) »PubMed
- 社内資料:安藤隆康:コンサータ錠の第III相試験成績(JNS001-JPN-03-2)(2007年10月26日承認、CTD 2.7.6.12)
- 社内資料:安藤隆康:コンサータ錠の長期投与試験成績(JNS001-JPN-04)(2007年10月26日承認、CTD 2.7.6.17)
- 社内資料:高橋長秀:コンサータ錠の第III相試験成績(JNS001-JPN-A01)(2013年12月20日承認、CTD 2.7.6.8)
- 社内資料:高橋長秀:コンサータ錠の長期投与試験成績(JNS001-JPN-A02)(2013年12月20日承認、CTD 2.7.6.12)
- 社内資料:塩酸メチルフェニデートの作用機序
- Ueno KI,et al., Behav Pharmacol., 13, 1-13, (2002) »PubMed
- Kula NS,et al., Eur J Pharmacol., 385, 291-294, (1999) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
ヤンセンファーマ株式会社
メディカルインフォメーションセンター
〒101-0065
東京都千代田区西神田3-5-2
電話:フリーダイヤル 0120-183-275
製品情報問い合わせ先
ヤンセンファーマ株式会社
メディカルインフォメーションセンター
〒101-0065
東京都千代田区西神田3-5-2
電話:フリーダイヤル 0120-183-275
25. 保険給付上の注意
本剤は厚生労働省告示第75号(平成24年3月5日付)に基づき、投薬期間は1回30日間分を限度とされています。
26. 製造販売業者等
26.1 製造販売元
ヤンセンファーマ株式会社
〒101-0065
東京都千代田区西神田3-5-2