医薬品情報
| 総称名 | サラゾスルファピリジン |
|---|---|
| 一般名 | サラゾスルファピリジン |
| 欧文一般名 | Salazosulfapyridine |
| 製剤名 | サラゾスルファピリジン腸溶錠 |
| 薬効分類名 | 抗リウマチ剤 |
| 薬効分類番号 | 6219 |
| ATCコード | A07EC01 |
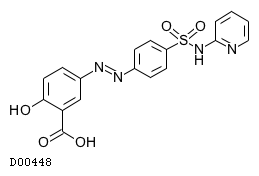
| KEGG DRUG |
D00448
サラゾスルファピリジン
|
| KEGG DGROUP |
DG01504
非ステロイド性抗炎症薬 (NSAID)
DG01985
疾患修飾性抗リウマチ薬 (DMARD)
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年9月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| サラゾスルファピリジン腸溶錠250mg「SN」 (後発品) | Salazosulfapyridine Enteric coated Tablets"SN" | シオノケミカル | 6219001H2087 | 12.6円/錠 | 処方箋医薬品注) |
| サラゾスルファピリジン腸溶錠500mg「SN」 (後発品) | Salazosulfapyridine Enteric coated Tablets"SN" | シオノケミカル | 6219001H1099 | 14円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 サルファ剤又はサリチル酸製剤に対し過敏症の既往歴のある患者
2.2 低出生体重児又は新生児[9.7.1参照]
4. 効能または効果
6. 用法及び用量
本剤は、消炎鎮痛剤などで十分な効果が得られない場合に使用すること。通常、サラゾスルファピリジンとして成人1日投与量1gを朝食及び夕食後の2回に分割経口投与する。
7. 用法及び用量に関連する注意
7.1 本剤は、通常1〜2ヵ月後に効果が得られるので、臨床効果が発現するまでは、従来より投与している消炎鎮痛剤は継続して併用することが望ましい。
7.2 高齢者では、少量(0.5g、1日1回、夕食後)から投与を開始するなど患者の状態を観察しながら、慎重に投与すること。
7.3 250mg錠と500mg錠の生物学的同等性が示されていないため、互換使用を行わないこと。
8. 重要な基本的注意
8.1 本剤は、関節リウマチの治療に十分な経験を持つ医師のもとで使用すること。
8.2 臨床試験において、1日投与量2gでは1gに比し副作用発現率が有意に高かったことから、本剤の投与に際しては用法・用量を厳守すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 血液障害のある患者[8.3参照]
9.1.2 気管支喘息のある患者
急性発作が起こるおそれがある。
9.1.3 急性間歇性ポルフィリン症の患者
急性発作が起こるおそれがある。
9.1.4 グルコース-6-リン酸脱水素酵素(G-6-PD)欠乏患者
溶血が起こるおそれがある。
9.1.5 他の薬剤に対し過敏症の既往歴のある患者
9.2 腎機能障害患者
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。
本剤の動物実験では催奇形作用は認められていないが、他のサルファ剤(スルファメトピラジン等)では催奇形作用が認められている。また本剤の代謝物の胎盤通過により、新生児に高ビリルビン血症を起こすことがある。
本剤の動物実験では催奇形作用は認められていないが、他のサルファ剤(スルファメトピラジン等)では催奇形作用が認められている。また本剤の代謝物の胎盤通過により、新生児に高ビリルビン血症を起こすことがある。
9.6 授乳婦
授乳を避けさせること。
母乳中に移行し、乳児に血便又は血性下痢があらわれたとの報告がある。
母乳中に移行し、乳児に血便又は血性下痢があらわれたとの報告がある。
9.7 小児等
9.8 高齢者
臨床試験において高齢者に消化器系、肝臓系及び腎臓系の副作用の発現率が高い傾向が認められる。
10. 相互作用
10.2 併用注意
| スルホニルアミド系経口糖尿病用剤 スルホニルウレア系経口糖尿病用剤 グリベンクラミド グリクラジド グリメピリド等 | 低血糖を発症するおそれがあるので、これらの薬剤の用量を調節するなど注意すること。 | 代謝抑制又は蛋白結合の置換により、作用が増強される。 |
| クマリン系抗凝血剤 ワルファリンカリウム | 併用薬の血中濃度が上昇し、プロトロンビン時間が延長するおそれがあるので、これらの薬剤の用量を調節するなど注意すること。 | 併用薬の代謝が抑制される。 |
| 葉酸 | 葉酸の吸収が低下し、大赤血球症、汎血球減少を来す葉酸欠乏症を起こすおそれがあるので、葉酸欠乏症が疑われる場合は、葉酸を補給すること。 | 機序不明 |
| ジゴキシン | ジゴキシンの吸収が低下するおそれがある。 | 機序不明 |
| アザチオプリン メルカプトプリン | 白血球減少等の骨髄抑制があらわれるおそれがある。 | 本剤はこれらの薬剤の代謝酵素であるチオプリンメチルトランスフェラーゼを阻害するとの報告がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 再生不良性貧血(0.03%)、汎血球減少症(0.06%)、無顆粒球症(頻度不明)、血小板減少(0.3%)、貧血(溶血性貧血、巨赤芽球性貧血(葉酸欠乏)等)(頻度不明)、播種性血管内凝固症候群(DIC)(0.03%)
11.1.2 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(0.03%)、紅皮症型薬疹(0.08%)
11.1.3 過敏症症候群、伝染性単核球症様症状(いずれも頻度不明)
初期症状として発疹、発熱、感冒様症状がみられ、さらにリンパ節腫脹、肝機能障害、肝腫、白血球増加、好酸球増多、異型リンパ球出現等を伴う重篤な過敏症状が遅発性にあらわれた場合には、投与を中止し、適切な処置を行うこと。なお、これらの症状は、薬剤を中止しても再燃あるいは遷延化することがあるので注意すること。
11.1.4 間質性肺炎(0.03%)、薬剤性肺炎(0.06%)、PIE症候群(頻度不明)、線維性肺胞炎(頻度不明)
発熱、咳嗽、喀痰、呼吸困難等の呼吸器症状があらわれた場合には投与を中止し、速やかに胸部X線検査、血液検査等を実施し、適切な処置を行うこと。
11.1.6 消化性潰瘍(出血、穿孔を伴うことがある)、S状結腸穿孔(いずれも頻度不明)
11.1.7 脳症(頻度不明)
意識障害、痙攣等があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.8 無菌性髄膜(脳)炎(頻度不明)
頸部(項部)硬直、発熱、頭痛、悪心、嘔吐あるいは意識混濁等があらわれることがあるので、観察を十分に行い、このような症状があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.9 心膜炎、胸膜炎(いずれも頻度不明)
呼吸困難、胸部痛、胸水等があらわれた場合には投与を中止し、速やかに心電図検査、胸部X線検査等を実施し、適切な処置を行うこと。
11.1.10 SLE様症状(頻度不明)
11.1.11 劇症肝炎(頻度不明)、肝炎(0.03%)、肝機能障害(2.0%)、黄疸(頻度不明)
11.1.12 ショック、アナフィラキシー(いずれも頻度不明)
発疹、血圧低下、呼吸困難等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.13 抗好中球細胞質抗体(ANCA)関連血管炎(頻度不明)
発熱、倦怠感、関節痛、筋痛等の全身症状や、皮膚(紅斑、紫斑)、肺(血痰)、腎臓(血尿、蛋白尿)等の臓器症状があらわれることがある。
11.2 その他の副作用
| 頻度不明 | 1〜10%未満 | 1%未満 | |
| 血液 | − | − | 白血球減少、免疫グロブリン減少、顆粒球減少、異型リンパ球出現、好酸球増多 |
| 肝臓 | − | − | AST、ALTの上昇 |
| 腎臓 | 尿路結石 | 浮腫 | 蛋白尿、BUN上昇、血尿、腫脹、糖尿 |
| 皮膚 | − | − | 脱毛 |
| 消化器 | 膵炎、口腔咽頭痛 | 悪心・嘔吐、腹痛、口内炎、胃不快感、食欲不振 | 便秘、腹部膨満感、下痢、口唇炎、胸やけ、舌炎、口渇 |
| 過敏症 | 光線過敏症、血清病 | 発疹、そう痒感 | 顔面潮紅、紅斑、蕁麻疹 |
| 精神神経系 | 抑うつ | − | 頭痛、末梢神経炎、めまい、うとうと状態、耳鳴 |
| その他 | 精子数及び精子運動性の可逆的な減少注1) | 発熱 | 倦怠、味覚異常、心悸亢進、筋肉痛、胸痛、関節痛、嗅覚異常 |
12. 臨床検査結果に及ぼす影響
本剤投与中の患者において、ALT、AST、CK-MB、GLDH、血中アンモニア、血中チロキシン及び血中グルコース等の測定値がみかけ上増加又は減少することがあるため、これらの検査結果の解釈は慎重に行うこと。サラゾスルファピリジン並びに代謝物5-アミノサリチル酸及びスルファピリジンは、NAD(H)又はNADP(H)を使用した340nm付近の紫外線吸光度測定に干渉する可能性があり、検査方法により検査結果に及ぼす影響が異なることが報告されている。
13. 過量投与
13.1 症状
悪心・嘔吐、胃腸障害、腹痛、精神神経系症状(傾眠、痙攣等)
13.2 処置
症状に応じて、催吐、胃洗浄、寫下、尿のアルカリ化、強制利尿(腎機能が正常な場合)、血液透析等を行う。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 本剤は腸溶性製剤であり、かんだり、砕いたりせずに服用するように指導すること。
14.1.2 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本剤の成分により皮膚、爪及び尿・汗等の体液が黄色〜黄赤色に着色することがある。また、ソフトコンタクトレンズが着色することがある。
15.2 非臨床試験に基づく情報
15.2.1 動物実験(ラット)で甲状腺腫及び甲状腺機能異常を起こすことが報告されている。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与試験
健康成人男性にサラゾスルファピリジン腸溶錠500mg1錠、2錠または4錠(サラゾスルファピリジンとして0.5、1または2g)をそれぞれ空腹時に単回経口投与した場合※1、小腸から吸収され、血清中濃度は投与約6時間後に最高値(約9〜17μg/mL)に達し、半減期は約4時間であった1)。
16.1.2 反復投与試験
健康成人男性にサラゾスルファピリジン腸溶錠500mg2錠(サラゾスルファピリジンとして1日1g)を8日間連続経口投与した場合※2、サラゾスルファピリジンの血清中濃度は4日目から定常状態に入り、最終投与72時間後には血清中からほぼ消失した1)。
16.1.3 生物学的同等性試験
<サラゾスルファピリジン腸溶錠250mg「SN」>
サラゾスルファピリジン腸溶錠250mg「SN」(2錠)とアザルフィジンEN錠500mg(1錠)を(それぞれサラゾスルファピリジンとして500mg)、クロスオーバー法により健康成人男子に絶食単回経口投与して血清中サラゾスルファピリジン濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された2)。
| n | 判定パラメータ | 参考パラメータ | |||
| AUC0-24(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | ||
| サラゾスルファピリジン腸溶錠250mg「SN」(2錠) | 30 | 51.6±38.0 | 6.2±4.2 | 7.0±1.5 | 6.2±3.2 |
| アザルフィジンEN錠500mg(1錠) | 30 | 55.4±41.4 | 6.7±4.8 | 6.5±1.1 | 5.8±1.8 |
血清中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
<サラゾスルファピリジン腸溶錠500mg「SN」>
サラゾスルファピリジン腸溶錠500mg「SN」とアザルフィジンEN錠500mgを、クロスオーバー法によりそれぞれ1錠(サラゾスルファピリジンとして500mg)健康成人男子に絶食単回経口投与して血漿中サラゾスルファピリジン濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された2)。
| n | 判定パラメータ | 参考パラメータ | |||
| AUC0-24(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | ||
| サラゾスルファピリジン腸溶錠500mg「SN」 | 18 | 64.5±50.4 | 8.3±6.1 | 6.1±1.3 | 6.2±2.1 |
| アザルフィジンEN錠500mg | 18 | 61.0±49.0 | 7.8±5.6 | 5.5±1.2 | 6.1±2.3 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 食事の影響
健康成人男性にサラゾスルファピリジン腸溶錠500mg1錠(サラゾスルファピリジンとして0.5g)を食後投与した場合、空腹時と比較して、血清中濃度時間曲線下面積(AUC0→∞)に有意差はなく、サラゾスルファピリジンの吸収量には食事による影響は認められなかった1)。
16.3 分布
ヒト血漿蛋白に対する結合率(in vitro)は、99%以上であった3)。
16.4 代謝
サラゾスルファピリジンは、経口投与において一部が未変化体として小腸で吸収され、大部分は大腸においてスルファピリジンと5-アミノサリチル酸に分解されると推定される4)。
16.5 排泄
健康成人男性にサラゾスルファピリジン腸溶錠500mg1錠、2錠または4錠(サラゾスルファピリジンとして0.5g、1gまたは2g)をそれぞれ空腹時単回経口投与した場合※1、投与72時間後までの尿中累積排泄率は約3〜8%であった1)。
※1 本剤の承認された用法及び用量はサラゾスルファピリジンとして成人1日投与量1gを朝食及び夕食後の2回に分割経口投与である。
※2 反復投与試験は8日間として第1、8日に早朝空腹時1,000mg単回経口投与、第2〜7日は500mg1日2回(8時、20時)経口投与したものである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相臨床試験(二重盲検比較試験)
プラセボを対照とした多施設二重盲検比較試験が関節リウマチ患者199例(プラセボ群:100例、1g群:99例)で実施され、その治療成績は次のとおりである。
| 著明改善 | 改善 | やや改善 | 不変 | やや悪化 | 悪化 | 著明悪化 | 合計 | 改善率(%) | 検定注) | |
| プラセボ | 9 | 7 | 14 | 31 | 8 | 1 | 1 | 71 | 22.5 | P<0.001 |
| サラゾスルファピリジン腸溶錠500mg(1g群) | 15 | 20 | 16 | 12 | 3 | 0 | 0 | 66 | 53.0 |
1g群での副作用は、96例中21例(21.9%)に30件発現した。主な副作用は、胃部痛・上腹部痛・胃痛7件、胃部不快感・胃重感5件、発疹・皮疹・薬疹4件等であった5)。
17.1.2 国内第II相臨床試験(長期投与試験)
関節リウマチ患者116例を対象とし、サラゾスルファピリジン腸溶錠500mg1日2錠(サラゾスルファピリジンとして1g)を用いた長期投与試験において、総投与症例116例中94例(81.0%)が24週以上投与可能であり、80例(69.0%)が52週間の投与を完了し、優れた忍容性が認められた。ランスバリーの活動性指数は投与4週後より投与開始前に比し有意な改善を示し、52週後においても効果の持続が認められた。
副作用は、112例中34例(30.4%)に55件発現した。主な副作用は、発疹・皮疹・薬疹14件、そう痒感・かゆみ4件、むかつき3件、食欲不振3件、腫脹・腫れ・むくみ3件等であった6)。
副作用は、112例中34例(30.4%)に55件発現した。主な副作用は、発疹・皮疹・薬疹14件、そう痒感・かゆみ4件、むかつき3件、食欲不振3件、腫脹・腫れ・むくみ3件等であった6)。
18. 薬効薬理
18.1 作用機序
T細胞、マクロファージに作用し、それらの細胞からのサイトカイン(IL-1、2及び6)産生を抑制し、関節リウマチ患者の異常な抗体産生を抑制する。さらに、滑膜細胞の活性化や炎症性細胞の浸潤等を抑制し、かつ多形核白血球の活性酸素産生も抑制する。これらの一連の作用により、関節リウマチ患者の関節における炎症全般を抑制し、抗リウマチ作用を示すものと考えられる。
18.2 抗リウマチ作用
アジュバント関節炎(ラット)に対しては予防効果を、異種II型コラーゲン誘発関節炎に対しては予防(マウス)及び治療効果(ラット)を、ヒトの関節リウマチにより近い臨床病像がみられる同種II型コラーゲン誘発関節炎(ラット)に対しては予防効果を示した7)。また、自然発症自己免疫疾患モデルであるMRL/1マウスにおいて、滑膜細胞重層化、滑膜下軟部組織浮腫、フィブリン析出及び炎症性細胞の浸潤等の関節病変の進行を抑制した8)。さらに、組織障害に関与する多形核白血球の活性酸素産生を抑制した9)(in vitro)。一方、実験的急性(ラット)、亜急性炎症モデル(ラット)に影響せず、鎮痛作用(マウス)もみられなかった10)11)。
18.3 免疫系に対する作用
19. 有効成分に関する理化学的知見
19.1. サラゾスルファピリジン
22. 包装
<サラゾスルファピリジン腸溶錠250mg「SN」>
100錠[10錠(PTP)×10]
<サラゾスルファピリジン腸溶錠500mg「SN」(輸入品)>
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
23. 主要文献
- 内田英二 他, 臨床薬理, 21 (2), 377-389, (1990) »DOI
- シオノケミカル株式会社:生物学的同等性に関する資料(社内資料)
- Sjoquist.B.et al., 薬物動態, 6 (3), 439-456, (1991) »DOI
- Schroder.H.et al., Clin Pharmacol Ther., 13 (4), 539-551, (1972)
- 西岡久寿樹 他, リウマチ, 31 (3), 327-345, (1991) »PubMed
- 御巫清允 他, 基礎と臨床, 25 (6), 1749-1765, (1991)
- 山崎寿子 他, 応用薬理, 41 (6), 563-574, (1991)
- Abe.C.et al., Int J Immunotherapy., 7 (1), 9-14, (1991)
- Carlin.G.et al., Pharmacol & Toxicol., 65, 121-127, (1989)
- Bjork.J.et al., 基礎と臨床, 25 (7), 2263-2270, (1991)
- 金戸洋 他, 応用薬理, 36 (4), 329-339, (1988)
- Fujiwara.M.et al., Immunopharmacol., 19, 15-21, (1990)
- Fujiwara.M.et al., Japan J Pharmacol., 54, 121-131, (1990) »DOI
24. 文献請求先及び問い合わせ先
文献請求先
シオノケミカル株式会社
学術情報本部
〒104-0028
東京都中央区八重洲2丁目10番10号
電話:03-5202-0213
FAX:03-5202-0230
製品情報問い合わせ先
シオノケミカル株式会社
学術情報本部
〒104-0028
東京都中央区八重洲2丁目10番10号
電話:03-5202-0213
FAX:03-5202-0230
26. 製造販売業者等
26.1 製造販売元(輸入)
シオノケミカル株式会社
東京都中央区八重洲2丁目10番10号