医薬品情報
| 総称名 | ロキサチジン酢酸エステル塩酸塩 |
|---|---|
| 一般名 | ロキサチジン酢酸エステル塩酸塩 |
| 欧文一般名 | Roxatidine Acetate Hydrochloride |
| 薬効分類名 | H2受容体拮抗剤 |
| 薬効分類番号 | 2325 |
| ATCコード | A02BA06 |
| KEGG DRUG |
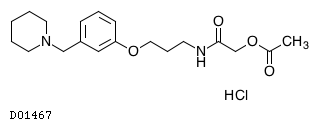
D01467
ロキサチジン酢酸エステル塩酸塩
|
| KEGG DGROUP |
DG01481
ヒスタミンH2受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年2月 改訂(第1版)

|
4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ロキサチジン酢酸エステル塩酸塩徐放カプセル37.5mg「サワイ」 (後発品) | ROXATIDINE ACETATE HYDROCHLORIDE Sustained-release Capsules[SAWAI] | 沢井製薬 | 2325004M2075 | 10.4円/カプセル | |
| ロキサチジン酢酸エステル塩酸塩徐放カプセル75mg「サワイ」 (後発品) | ROXATIDINE ACETATE HYDROCHLORIDE Sustained-release Capsules[SAWAI] | 沢井製薬 | 2325004M1095 | 20.6円/カプセル |
4. 効能または効果
6. 用法及び用量
<胃潰瘍、十二指腸潰瘍、吻合部潰瘍、逆流性食道炎>
通常、成人にはロキサチジン酢酸エステル塩酸塩として1回75mgを1日2回(朝食後、就寝前又は夕食後)経口投与する。また、1回150mgを1日1回(就寝前)経口投与することもできる。
通常、小児にはロキサチジン酢酸エステル塩酸塩として、体重30kg未満では1回37.5mgを、体重30kg以上では1回75mgを1日2回(朝食後、就寝前又は夕食後)経口投与する。
なお、年齢、症状により適宜増減する。
<Zollinger-Ellison症候群>
通常、成人にはロキサチジン酢酸エステル塩酸塩として1回75mgを1日2回(朝食後、就寝前又は夕食後)経口投与する。
通常、小児にはロキサチジン酢酸エステル塩酸塩として、体重30kg未満では1回37.5mgを、体重30kg以上では1回75mgを1日2回(朝食後、就寝前又は夕食後)経口投与する。
なお、年齢、症状により適宜増減する。
<麻酔前投薬>
通常、成人にはロキサチジン酢酸エステル塩酸塩として1回75mgを手術前日就寝前及び手術当日麻酔導入2時間前の2回経口投与する。また、1回150mgを手術前日就寝前に1回経口投与することもできる。
通常、小児にはロキサチジン酢酸エステル塩酸塩として、体重30kg未満では1回37.5mgを、体重30kg以上では1回75mgを手術前日就寝前及び手術当日麻酔導入2時間前の2回経口投与する。
<下記疾患の胃粘膜病変(びらん、出血、発赤、浮腫)の改善
急性胃炎、慢性胃炎の急性増悪期>
急性胃炎、慢性胃炎の急性増悪期>
通常、成人にはロキサチジン酢酸エステル塩酸塩として1回75mgを1日1回(就寝前又は夕食後)経口投与する。
通常、小児にはロキサチジン酢酸エステル塩酸塩として、体重30kg未満では1回37.5mgを、体重30kg以上では1回75mgを1日1回(就寝前又は夕食後)経口投与する。
なお、年齢、症状により適宜増減する。
8. 重要な基本的注意
肝機能、腎機能、血液像等に注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 薬物過敏症の既往歴のある患者
9.2 腎機能障害患者
9.3 肝機能障害患者
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行が認められている。[16.3.3参照]
9.7 小児等
9.8 高齢者
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(0.1%未満)、アナフィラキシー(頻度不明)
ショック(初期症状:不快感、顔面蒼白、血圧低下等)があらわれた場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.2 再生不良性貧血、汎血球減少、無顆粒球症、血小板減少(いずれも0.1%未満)
再生不良性貧血、汎血球減少、無顆粒球症、血小板減少(初期症状:全身倦怠、脱力、皮下・粘膜下出血、発熱等)があらわれることがあるので、定期的に血液検査を実施し、異常が認められた場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.3 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも0.1%未満)
11.1.4 肝機能障害、黄疸(いずれも0.1%未満)
AST、ALT、γ-GTP上昇等の肝機能障害、黄疸があらわれることがある。
11.1.5 横紋筋融解症(0.1%未満)
CK、LDH等の筋逸脱酵素の急激な上昇、ミオグロビン尿、筋肉痛等の異常が認められた場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.6 房室ブロック等の心ブロック(頻度不明)
注)発現頻度は使用成績調査を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹、そう痒感等 | ||
| 血液 | 好酸球数増多 | 白血球数減少 | 貧血 |
| 消化器 | 便秘等 | 下痢、悪心、腹部膨満感、口渇等 | |
| 肝臓 | AST、ALTの上昇等 | ALP、LDHの上昇等 | 肝機能異常 |
| 精神神経系 | 可逆性の錯乱状態、幻覚、しびれ、眠気、不眠、めまい、頭痛等 | 痙攣 | |
| その他 | 女性型乳房、乳汁分泌、倦怠感、血圧上昇、BUN上昇 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
本剤の投与が胃癌による症状を隠蔽することがあるので、悪性でないことを確認のうえ投与すること。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人に37.5mg、75mg又は150mgを単回経口投与した結果、最大血漿中濃度到達時間及び血漿中半減期等の薬物動態パラメータは以下のとおりであった4)。
また、健康成人に50mgを1日2回56日間連続経口投与した時の血漿中薬物動態の解析結果から蓄積性は認められなかった5)。
また、健康成人に50mgを1日2回56日間連続経口投与した時の血漿中薬物動態の解析結果から蓄積性は認められなかった5)。
| 投与量 | AUC(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) |
| 37.5mg | 1353.15±249.41 | 157.5±20.2 | 2.38±0.69 | 5.57±0.28 |
| 75mg | 2424.47±396.78 | 329.0±53.8 | 2.88±0.35 | 5.03±0.64 |
| 150mg | 5275.24±695.70 | 628.5±66.7 | 2.13±0.35 | 5.01±0.43 |
16.1.2 生物学的同等性試験
<ロキサチジン酢酸エステル塩酸塩徐放カプセル37.5mg「サワイ」>
ロキサチジン酢酸エステル塩酸塩徐放カプセル37.5mg「サワイ」とアルタットカプセル37.5mgを健康成人男子にそれぞれ1カプセル(ロキサチジン酢酸エステル塩酸塩として37.5mg)空腹時及び食後単回経口投与(クロスオーバー法)し、血漿中脱アセチル体濃度(シュウ酸塩として)を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された6)。
| Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | AUC0-36hr(ng・hr/mL) | ||
| 空腹時 | ロキサチジン酢酸エステル塩酸塩徐放カプセル37.5mg「サワイ」 | 179±35 | 2.6±0.5 | 6.8±1.6 | 1,534±273 |
| アルタットカプセル37.5mg | 193±80 | 2.4±0.5 | 6.2±1.5 | 1,687±593 | |
| 食後 | ロキサチジン酢酸エステル塩酸塩徐放カプセル37.5mg「サワイ」 | 161±24 | 3.6±0.5 | 6.7±1.6 | 1,301±162 |
| アルタットカプセル37.5mg | 175±27 | 3.8±0.4 | 5.6±1.3 | 1,407±187 |
空腹時経口投与後の血中濃度曲線
食後経口投与後の血中濃度曲線
<ロキサチジン酢酸エステル塩酸塩徐放カプセル75mg「サワイ」>
ロキサチジン酢酸エステル塩酸塩徐放カプセル75mg「サワイ」とアルタットカプセル75mgを健康成人男子にそれぞれ1カプセル(ロキサチジン酢酸エステル塩酸塩として75mg)空腹時及び食後単回経口投与(クロスオーバー法)し、血漿中脱アセチル体濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された7)。
| Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | AUC0-24hr(ng・hr/mL) | ||
| 空腹時 | ロキサチジン酢酸エステル塩酸塩徐放カプセル75mg「サワイ」 | 253±45 | 3.1±0.6 | 6.6±1.0 | 2,210±467 |
| アルタットカプセル75mg | 274±61 | 3.1±0.6 | 6.4±0.8 | 2,350±525 | |
| 食後 | ロキサチジン酢酸エステル塩酸塩徐放カプセル75mg「サワイ」 | 258±56 | 6.0±1.9 | 5.6±0.7 | 2,264±372 |
| アルタットカプセル75mg | 270±46 | 5.3±1.5 | 4.9±0.8 | 2,305±371 |
空腹時経口投与後の血中濃度曲線
食後経口投与後の血中濃度曲線
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
16.3.1 蛋白結合率
16.3.2 胎児への移行
帝王切開患者に75mgを手術前2回経口投与した結果、臍帯血漿中濃度は母体静脈血漿中濃度の約60%であり、羊水への移行量は投与量の0.3%以下であった10)。
16.3.3 乳汁への移行
16.4 代謝
健康成人に75mgを経口投与した結果、尿中代謝物は主に脱アセチル体であり、ついで多かったのはカルボン酸誘導体であった12)。
16.5 排泄
健康成人に75mgを経口投与した結果、24時間以内に投与量の約70%が尿中に排泄され、そのうち約80%が脱アセチル体であった12)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能障害患者に75mgを経口投与すると、表1に示すとおり健康成人と比較して吸収過程に変化はみられなかったが、最大血漿中濃度に到達した後の血漿からの消失は腎機能の低下とともに遅延した9)。したがって腎機能障害患者に本剤を投与する場合には、投与量、投与間隔の適切な調節が必要である。[9.2、9.8参照]
| クレアチニンクリアランス(mL/min) | T1/2(hr) | AUC(ng・hr/mL) |
| Ccr≧90 | 3.94±0.34 | 2362±160 |
| 90>Ccr≧60 | 5.68±0.51 | 4101±618 |
| 60>Ccr≧30 | 7.70±0.49 | 4981±477 |
| 30>Ccr | 12.13±1.13 | 12993±1245 |
16.6.2 小児
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相臨床試験
<胃潰瘍(8週時)>
| \ | 内視鏡判定による治癒率 | 自他覚症状改善率 (改善以上) | 全般改善度 (改善以上) | |
| 1回75mg 1日2回投与15)16)17)18)19)20)21)22)23)24)25)26)27)28)29)30) | 一般臨床試験 | 81.6%(249/305) | 96.1%(293/305) | 94.7%(303/320) |
| 二重盲検比較試験を含む臨床試験 | − | − | 94.7%(699/738) | |
| 二重盲検比較試験により、本剤の有用性が認められた。 | ||||
| 1回150mg 1日1回投与27)28)31)32) | 一般臨床試験 | 79.2%(57/72) | 97.2%(69/71) | 97.5%(77/79) |
| 二重盲検比較試験を含む臨床試験 | − | − | 94.3%(183/194) | |
| 二重盲検比較試験により、1回75mg1日2回投与法との間に有意差は認められなかった。 | ||||
<十二指腸潰瘍(6週時)>
| \ | 内視鏡判定による治癒率 | 自他覚症状改善率 (改善以上) | 全般改善度 (改善以上) | |
| 1回75mg 1日2回投与15)16)17)18)19)20)21)22)23)24)25)26)27)33)34)35) | 一般臨床試験 | 87.6%(169/193) | 99.0%(194/196) | 99.0%(203/205) |
| 二重盲検比較試験を含む臨床試験 | − | − | 96.6%(588/609) | |
| 二重盲検比較試験により、本剤の有用性が認められた。 | ||||
| 1回150mg 1日1回投与27)31)32)33) | 一般臨床試験 | 95.7%(22/23) | 96.3%(26/27) | 96.3%(26/27) |
| 二重盲検比較試験を含む臨床試験 | − | − | 90.8%(129/142) | |
| 二重盲検比較試験により、1回75mg1日2回投与法との間に有意差は認められなかった。 | ||||
<吻合部潰瘍(8週時)>
<Zollinger-Ellison症候群>
本症候群(1例)に対して潰瘍の瘢痕化、自覚症状の改善が認められた。副作用は認められなかった37)。
<逆流性食道炎(8週時)>
<麻酔前投薬>
<急性胃炎、慢性胃炎の急性増悪期の胃粘膜病変(びらん、出血、発赤、浮腫)の改善>
<胃潰瘍、十二指腸潰瘍、逆流性食道炎(小児)>
18. 薬効薬理
18.1 作用機序
胃粘膜壁細胞のヒスタミンH2受容体を選択的に遮断することにより胃酸分泌抑制作用を示す51)。
18.2 胃酸分泌抑制作用
18.2.1 基礎分泌
消化性潰瘍患者に25mg、50mg及び80mgを経口投与した結果、酸分泌量は投与150〜180分後においてそれぞれ80.7%、94.8%及び97.9%抑制された52)。
18.2.2 ベタゾール、ペンタガストリン及びインスリン刺激分泌
18.2.3 食事刺激分泌
健康成人男性に75mgを経口投与した結果、食事刺激後2時間の総酸分泌量は78.2%抑制された55)。
18.2.4 夜間分泌
消化性潰瘍患者及び健康成人に75mgを経口投与した結果、夜間7時間の総酸分泌量は95.5%抑制された56)。
18.2.5 胃内pH
18.3 ペプシン分泌抑制作用
18.4 胃粘液増加作用
胃切除術を施行予定の患者に、手術の1週間前から1回75mgを1日2回経口投与した結果、胃体部、幽門部の表層粘液ゲル層の厚さが増加する傾向が認められた59)。
18.5 血清ガストリンに及ぼす影響
消化性潰瘍患者に1日150mgを8週間経口投与した結果、血清ガストリン値は投与前後において有意な変動は認められなかった15)。
18.6 血清プロラクチン等に及ぼす影響
消化性潰瘍患者に1日150mgを6〜8週間経口投与した結果、血清プロラクチン、LH、FSH、テストステロン、エストラジオール、DHEA-S及びコルチゾール値は投与前後において有意な変動は認められなかった60)。
18.7 胃粘液生合成・分泌増加作用
18.8 胃粘膜ヘキソサミン量に対する作用
ラットに300mg/kgを経口投与した結果、胃粘膜ヘキソサミン量には影響がみられなかったが、アスピリン経口投与及び水浸拘束ストレス負荷によるヘキソサミン量の減少はそれぞれ32及び90mg/kg経口投与により有意に抑制された63)。
18.9 胃粘膜電位差に対する作用
ラットに25mg/kgを静脈内投与した結果、基礎状態の胃粘膜電位差には影響がみられなかったが、アスピリン胃内注入による胃粘膜電位差の低下は有意に抑制された63)。
18.10 胃粘膜血液量及び粘膜内ヘモグロビン酸素飽和度に対する作用
ラットに10mg/kgを静脈内投与した結果、基礎状態の粘膜血液量及び粘膜内ヘモグロビン酸素飽和度には影響がみられなかったが、脱血ショックによるこれら指標の低下は有意に抑制された64)。
18.11 胃粘膜プロスタグランジン産生能に対する作用
ラットに200mg/kgを経口投与した結果、胃粘膜のプロスタグランジンE2及びプロスタグランジンI2の産生能を低下させなかった65)。
18.12 胃粘膜障害抑制作用
ラットに30mg/kgを腹腔内投与した結果、無水エタノール、0.6N塩酸及び0.2N水酸化ナトリウム投与による胃粘膜障害の発生を有意に抑制した66)。
18.13 実験的急性胃出血に対する作用
ラットの実験的急性胃出血に対し、用量依存的に胃出血量を抑制した67)。
19. 有効成分に関する理化学的知見
19.1. ロキサチジン酢酸エステル塩酸塩
22. 包装
<ロキサチジン酢酸エステル塩酸塩徐放カプセル37.5mg「サワイ」>
PTP
100カプセル(10Cap×10)
<ロキサチジン酢酸エステル塩酸塩徐放カプセル75mg「サワイ」>
PTP
100カプセル(10Cap×10)
23. 主要文献
- 臼井哲夫他, 薬理と治療, 13 (3), 1325-1340, (1985)
- 福島健他, 薬理と治療, 13 (3), 1341-1351, (1985)
- 臼井哲夫他, 薬理と治療, 13 (3), 1353-1365, (1985)
- 薬物動態試験、成人単回投与(アルタットカプセル:2011年1月21日承認、申請資料概要2.7.6.2)
- 長谷川吉康他, 薬理と治療, 13 (1), 85-97, (1985)
- 社内資料:生物学的同等性試験(カプセル37.5mg)
- 社内資料:生物学的同等性試験(カプセル75mg)
- 圷玲子他, 薬理と治療, 13 (3), 1435-1443, (1985)
- 高畠利一他, 薬理と治療, 13 (6), 3377-3388, (1985)
- 河西稔他, 麻酔, 35 (1), 130-138, (1986) »PubMed
- 岩村敏他, 応用薬理, 30 (2), 299-320, (1985)
- 本間誠次郎他, 応用薬理, 30 (3), 555-563, (1985)
- 薬物動態試験、小児単回投与[1](アルタットカプセル:2011年1月21日承認、申請資料概要2.7.6.3)
- 薬物動態試験、小児単回投与[2](アルタットカプセル:2011年1月21日承認、申請資料概要2.7.3.4)
- 浅香正博他, 診療と新薬, 22 (5), 1145-1154, (1985)
- 三好秋馬他, 診療と新薬, 22 (3), 501-515, (1985)
- 水島和雄他, 医学と薬学, 13 (3), 597-605, (1985)
- 佐藤正伸他, 新薬と臨牀, 34 (5), 787-796, (1985)
- 土屋雅春他, 新薬と臨牀, 34 (7), 1227-1238, (1985)
- 川村忠夫他, 基礎と臨牀, 19 (5), 2685-2692, (1985)
- 水落勝明他, 臨牀と研究, 62 (9), 3037-3046, (1985)
- 福田能啓他, 医学と薬学, 13 (5), 1187-1196, (1985)
- 竹本忠良他, 臨床成人病, 15 (11), 1739-1745, (1985)
- 中澤慶彦他, 医学と薬学, 13 (5), 1201-1208, (1985)
- 三澤正他, 医学と薬学, 14 (4), 1117-1122, (1985)
- 松本興三他, 新薬と臨牀, 34 (5), 821-828, (1985)
- 三好秋馬他, 医学と薬学, 19 (2), 357-370, (1988)
- 三好秋馬他, 診療と新薬, 25 (3), 397-415, (1988)
- 三好秋馬他, 診療と新薬, 22 (5), 1069-1089, (1985)
- 三好秋馬他, 診療と新薬, 22 (12), 2897-2918, (1985)
- 小山茂樹他, 診療と新薬, 25 (3), 521-531, (1988)
- 浅香正博他, 診療と新薬, 25 (5), 893-902, (1988)
- 三好秋馬他, 診療と新薬, 25 (3), 417-435, (1988)
- 三好秋馬他, 診療と新薬, 22 (5), 1091-1110, (1985)
- 三好秋馬他, 診療と新薬, 22 (12), 2919-2939, (1985)
- 福富久之他, 診療と新薬, 22 (7), 1664-1672, (1985)
- 関根昌子他, 診療と新薬, 22 (6), 1492-1498, (1985)
- 森治樹他, 診療と新薬, 22 (7), 1673-1681, (1985)
- 関口利和他, 新薬と臨牀, 34 (7), 1253-1258, (1985)
- 岸清一郎他, 医学と薬学, 14 (1), 113-119, (1985)
- 関口利和他, 臨床医薬, 4 (3), 461-476, (1988)
- 岸清一郎他, 診療と新薬, 24 (12), 2465-2475, (1987)
- 横井雅一他, 診療と新薬, 22 (6), 1574-1580, (1985)
- 田中博文他, 麻酔, 34 (12), 1673-1680, (1985) »PubMed
- 山田達也他, 診療と新薬, 24 (10), 2023-2030, (1987)
- 白濱龍興他, 新薬と臨牀, 39 (8), 1575-1583, (1990)
- 小山茂樹他, 診療と新薬, 27 (12), 2363-2370, (1990)
- 浅香正博他, 診療と新薬, 27 (7), 1213-1224, (1990)
- 三好秋馬他, 臨床医薬, 7 (2), 413-436, (1991)
- 一般臨床試験、小児(アルタットカプセル:2011年1月21日承認、申請資料概要2.7.6.5)
- 第十八改正日本薬局方解説書, C-6291-6295, (2021), (廣川書店)
- 三好秋馬他, 薬理と治療, 13 (3), 1445-1453, (1985)
- 三好秋馬他, 薬理と治療, 13 (3), 1455-1469, (1985)
- 三好秋馬他, 薬理と治療, 13 (3), 1471-1483, (1985)
- 佐藤裕一他, 臨牀と研究, 62 (9), 2967-2972, (1985)
- 三好秋馬他, 薬理と治療, 13 (3), 1485-1494, (1985)
- 佐伯進他, 臨牀と研究, 62 (8), 2643-2648, (1985)
- 薬力学試験、小児単回投与(アルタットカプセル:2011年1月21日承認、申請資料概要2.7.6.4)
- 斉藤拓康他, Ulcer Res., 27 (2), 132-134, (2000)
- 三澤正他, 医学と薬学, 13 (5), 1175-1181, (1985)
- Ichikawa, T. et al., Br. J. Pharmacol., 122 (6), 1230-1236, (1997) »PubMed
- 高橋伸行他, 薬理と治療, 26 (10), 1701-1704, (1998)
- 白土賢治他, 薬理と治療, 13 (3), 1413-1420, (1985)
- 川野淳他, 薬理と治療, 13 (3), 1429-1433, (1985)
- Mikami, T., 薬理と治療, 16 (9), 3743-3748, (1988)
- Shiratsuchi, K. et al., Arch. int. Pharmacodyn. Ther., 294, 295-304, (1988) »PubMed
- 布施宏昭他, 薬理と治療, 18 (8), 2965-2972, (1990)
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30