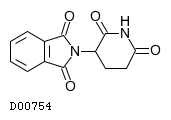
医薬品情報
| 総称名 | サレド |
|---|---|
| 一般名 | サリドマイド |
| 欧文一般名 | Thalidomide |
| 製剤名 | サリドマイドカプセル |
| 薬効分類名 | 多発性骨髄腫治療剤 らい性結節性紅斑治療剤 クロウ・深瀬(POEMS)症候群治療剤 |
| 薬効分類番号 | 1290 4291 6239 |
| ATCコード | L04AX02 |
| KEGG DRUG |
D00754
サリドマイド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年5月 改訂(第5版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| サレドカプセル25 | THALED CAPSULES | 藤本製薬 | 4291019M3026 | 4845.7円/カプセル | 毒薬, 処方箋医薬品注) |
| サレドカプセル50 | THALED CAPSULES | 藤本製薬 | 4291019M2020 | 5775.3円/カプセル | 毒薬, 処方箋医薬品注) |
| サレドカプセル100 | THALED CAPSULES | 藤本製薬 | 4291019M1023 | 6883.3円/カプセル | 毒薬, 処方箋医薬品注) |
1. 警告
<効能共通>
1.1 本剤はヒトにおいて催奇形性(サリドマイド胎芽病:無肢症、海豹肢症、奇肢症等の四肢奇形、心臓疾患、消化器系の閉塞等の内臓障害等)が確認されており、妊娠期間中の投与は重篤な胎児奇形又は流産・死産を起こす可能性があるため、妊婦又は妊娠している可能性のある女性には決して投与しないこと。[2.1、9.5参照]
1.2 本剤の胎児への曝露を避けるため、本剤の使用については、安全管理手順1)が定められているので、関係企業、医師、薬剤師等の医療関係者、患者やその家族等の全ての関係者が本手順を遵守すること。[2.2、9.5参照]
1.3 妊娠する可能性のある女性には、投与開始前に妊娠検査を行い、陰性であることを確認したうえで投与を開始すること。また、投与開始予定4週間前から投与終了4週間後まで、性交渉を行う場合はパートナーと共に極めて有効な避妊法の実施を徹底(男性は必ずコンドームを着用)させ、避妊を遵守していることを十分に確認するとともに定期的に妊娠検査を行うこと。本剤の投与期間中に妊娠が疑われる場合には、直ちに投与を中止し、医師等に連絡するよう患者を指導すること。[9.4.1、9.5参照]
1.4 本剤は精液中へ移行することから、男性には、投与開始から投与終了4週間後まで、性交渉を行う場合は極めて有効な避妊法の実施を徹底(男性は必ずコンドームを着用)させ、避妊を遵守していることを十分に確認すること。また、この期間中は妊婦との性交渉を行わせないこと。[9.4.2、16.3参照]
1.5 本剤の投与は、緊急時に十分対応できる医療施設において、十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される患者のみに行うこと。また、治療開始に先立ち、患者又はその家族等に有効性及び危険性(胎児への曝露の危険性を含む)を十分に説明し、文書で同意を得てから投与を開始すること。
<らい性結節性紅斑>
1.7 ハンセン病の診断及び治療に関する十分な知識を有する医師のもとで、本剤を使用すること。
<クロウ・深瀬(POEMS)症候群>
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
<再発又は難治性の多発性骨髄腫>
5.1 少なくとも1つの標準的な治療が無効又は治療後に再発した患者を対象とし、本剤以外の治療の実施についても慎重に検討した上で、本剤の投与を開始すること。
<らい性結節性紅斑>
5.2 非ステロイド系消炎鎮痛薬等が十分奏効するような軽症のらい性結節性紅斑に対しては、本剤の使用の前に他剤の使用を考慮すること。
5.3 皮膚症状以外のらい性結節性紅斑の症状に対するサリドマイドの有効性については明確なエビデンスが得られていない。
5.4 本剤はらい菌に対する抗菌薬ではないため、らい菌感染に対する治療には適切な抗菌薬を使用すること。
<クロウ・深瀬(POEMS)症候群>
6. 用法及び用量
<再発又は難治性の多発性骨髄腫>
通常、成人にはサリドマイドとして1日1回100mgを就寝前に経口投与する。なお、患者の状態により適宜増減するが、1日400mgを超えないこと。
<らい性結節性紅斑>
通常、本剤を1日1回就寝前に経口投与する。用量は、成人にはサリドマイドとして50〜100mgより投与を開始し、症状が緩和するまで必要に応じて漸増する。ただし、1日400mgを超えないこと。症状の改善に伴い漸減し、より低い維持用量で症状をコントロールする。
<クロウ・深瀬(POEMS)症候群>
通常、成人にはサリドマイドとして1回100mgを隔日投与から開始し、1週間以上の間隔をあけて1日1回200mgまで漸増する。なお、いずれも就寝前に経口投与することとし、患者の状態により適宜増減するが、1日300mgを超えないこと。
7. 用法及び用量に関連する注意
<再発又は難治性の多発性骨髄腫>
7.1 本剤の投与は1日1回100mgより開始し、効果不十分な場合には4週間間隔で100mgずつ漸増すること。
7.2 本剤の用量を調整する場合には、治療抵抗性多発性骨髄腫患者を対象とした国内臨床試験で使用された下記の減量・休薬、中止基準を考慮すること。
| 投与量 | 休薬・減量 | 中止 |
| 100mg | 休薬:Grade2の非血液毒性又はGrade3の血液毒性が認められた場合 | 深部静脈血栓症、Grade4の血液毒性又はGrade3以上の非血液毒性 |
| 200mg以上 | 減量:Grade2の非血液毒性又はGrade3の血液毒性が認められた場合、100mg減量する。減量後1週間で症状の回復又は軽快がみられない場合、さらに100mg減量する。 |
<クロウ・深瀬(POEMS)症候群>
8. 重要な基本的注意
<効能共通>
8.1 本剤の安全管理を確実に実施するため、1回の最大処方量は12週間分を超えないものとすること。
8.2 本剤の抗血管新生作用が創傷の治癒を阻害する可能性があることから、外科手術等を実施した場合、適切な期間本剤の投与を中止すること。
8.3 傾眠、眠気、めまい、徐脈、起立性低血圧、失神、意識消失が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないように注意すること。
8.4 骨髄機能抑制があらわれることがあるため、定期的に検査を行うなど観察を十分に行うこと。[11.1.5参照]
8.5 甲状腺機能低下症があらわれることがあるため、定期的に検査を行うなど観察を十分に行うこと。[11.1.15参照]
8.6 間質性肺炎があらわれることがあるため、咳嗽、呼吸困難、発熱等の臨床症状を十分に観察すること。[11.1.7参照]
8.7 腫瘍崩壊症候群があらわれることがあるため、血清中電解質濃度及び腎機能検査を行うなど、患者の状態を十分に観察すること。[11.1.16参照]
<らい性結節性紅斑>
8.8 国内のガイドライン2)を参照の上治療を行うこと。
<クロウ・深瀬(POEMS)症候群>
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
<効能共通>
9.1.1 深部静脈血栓症のリスクを有する患者
9.1.2 HIVに感染している患者
本剤によりHIVウイルスが増加することがある。
<クロウ・深瀬(POEMS)症候群>
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性には、少なくとも投与開始予定の4週間前、2週間前及び初回投与前(投与開始3日前から投与開始直前まで)に妊娠検査を実施し、検査結果が陰性であることを確認後に投与を開始すること。また、妊娠していないことを定期的に確認するために、間隔が4週間を超えないよう妊娠検査を実施すること。さらに、投与開始予定4週間前から投与終了4週間後まで、性交渉を行う場合はパートナーと共に極めて有効な避妊法の実施を徹底(男性は必ずコンドームを着用)させ、避妊を遵守していることを十分に確認するとともに定期的に妊娠検査を行うこと。本剤の投与期間中に妊娠が疑われる場合には、直ちに投与を中止し、医師等に連絡するよう患者を指導すること。[1.3、9.5参照]
9.4.2 男性には、投与開始から投与終了4週間後まで、性交渉を行う場合は極めて有効な避妊法の実施を徹底(男性は必ずコンドームを着用)させ、避妊を遵守していることを十分に確認すること。また、この期間中は妊婦との性交渉を行わせないこと。ヒト精液中への移行が報告されている3)。[1.4、16.3参照]
9.4.3 本剤投与開始から投与終了4週間後までは、精子・精液の提供をさせないこと。[16.3参照]
9.5 妊婦
9.6 授乳婦
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら投与すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| 中枢神経抑制剤 バルビツール酸誘導体 バルビツール酸塩等 フェノチアジン系薬剤 クロルプロマジン等 モルヒネ誘導体 ベンゾジアゼピン系薬剤 ジアゼパム等 抗不安剤 催眠剤 アルコール 抗うつ薬 交感神経遮断薬 レセルピン等 ヒスタミンH1受容体遮断薬 バクロフェン | 他の薬物の鎮静作用を増強する。 | 相互に作用を増強するおそれがある。 |
| ザルシタビン ビンクリスチン硫酸塩 ジダノシン | 末梢神経障害のリスクを高める危険性がある。 | 相互に作用を増強するおそれがある。 |
| ドキソルビシン塩酸塩 デキサメタゾン 経口避妊薬 | 血栓症と血栓塞栓症のリスクを高める危険性がある。 | 相互に作用を増強するおそれがある。 |
| デキサメタゾン デキサメタゾンリン酸エステルナトリウム | 海外において、中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)が発現したとの報告がある。 | 機序は不明である。 |
| ゾレドロン酸水和物 | 海外において腎機能不全が発現したとの報告がある。 | 相互に作用を増強する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 催奇形性(サリドマイド胎芽病)(頻度不明)
妊婦又は妊娠している可能性のある女性には投与しないこと。[9.5参照]
11.1.3 脳梗塞(頻度不明、頻度不明、8.6%)
11.1.4 末梢神経障害(37.8%、頻度不明、17.1%)
不可逆性の末梢神経障害があらわれることがあるので、手足のしびれ、うずき、痛み、灼熱感等の症状が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.5 骨髄機能抑制(67.6%、頻度不明、17.1%)
好中球減少、白血球減少、赤血球減少(貧血)、血小板減少等があらわれることがある。[8.4参照]
11.1.6 感染症(5.4%、頻度不明、14.3%)
肺炎等の重篤な感染症があらわれることがある。
11.1.7 間質性肺炎(頻度不明、頻度不明、5.7%)
異常が認められた場合には、胸部X線、胸部CT等の検査を実施すること。間質性肺炎が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。[8.6参照]
11.1.8 消化管穿孔(2.7%、頻度不明、頻度不明)、腸閉塞(頻度不明、頻度不明、2.9%)、イレウス(頻度不明、頻度不明、2.9%)
致死的な消化管穿孔があらわれることがある。
11.1.9 虚血性心疾患(2.7%、頻度不明、2.9%)、冠攣縮(頻度不明、頻度不明、2.9%)
11.1.10 皮膚粘膜眼症候群(Stevens-Johnson症候群)、中毒性表皮壊死融解症(TEN)(いずれも頻度不明)
発熱、紅斑、そう痒感、眼充血、口内炎等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.11 嗜眠状態(頻度不明)、傾眠(54.1%、頻度不明、17.1%)、鎮静(頻度不明)
11.1.12 痙攣(頻度不明)
間代性痙攣、緊張性痙攣等の発作があらわれることがある。
11.1.13 起立性低血圧(頻度不明)
めまい等の症状が認められた場合には減量、休薬又は投与を中止するなど適切な処置を行うこと。
11.1.14 不整脈(21.6%、頻度不明、51.4%)、心不全(頻度不明、頻度不明、2.9%)
11.1.15 甲状腺機能低下症(頻度不明)[8.5参照]
11.1.16 腫瘍崩壊症候群(頻度不明)
異常が認められた場合には投与を中止し、適切な処置(生理食塩液、高尿酸血症治療剤等の投与、透析等)を行うとともに、症状が回復するまで患者の状態を十分に観察すること。[8.7参照]
11.1.17 肝機能障害(13.5%、頻度不明、5.7%)
AST、ALT、ビリルビンの上昇等を伴う肝機能障害があらわれることがある。
注)「重大な副作用」の発現頻度が複数ある場合は、<再発又は難治性の多発性骨髄腫>、<らい性結節性紅斑>、<クロウ・深瀬(POEMS)症候群>の順に記載した。
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 皮膚 | 発疹、皮膚そう痒感 | 蕁麻疹、皮膚乾燥、毛細血管拡張症 | 血管浮腫 |
| 筋・骨格 | 関節痛、骨痛、肩痛、頸部痛、背部違和感 | ||
| 精神神経系 | 眠気、しびれ、ふるえ、頭重、頭痛、ふらつき | 不安、不眠、こむら返り、運動障害、嗄声、神経痛、錯乱状態 | |
| 眼 | 眼のかすみ | 結膜出血 | |
| 消化器 | 便秘、口内乾燥、嘔気、腹部膨満感 | 残便感、胃重感、心窩部不快感、胃痛、軟便、下痢、消化不良、胸やけ、歯肉出血、嘔吐、腹痛、食欲不振、痔核 | 胃腸出血 |
| 肝臓 | γ-GTP低下 | 総ビリルビン減少 | |
| 代謝・栄養系 | 総コレステロール上昇、CK低下、ALP上昇、カルシウム低下、ナトリウム低下、カリウム上昇、α1-グロブリン上昇、α2-グロブリン上昇、尿糖陽性 | 総蛋白上昇、総蛋白低下、総コレステロール低下、CK上昇、ALP低下、LDH上昇、LDH低下、HDL-C増加、クロール上昇、クロール低下、カリウム低下、耐糖能異常、アルブミン低下、α2-グロブリン異常、β-グロブリン上昇、高トリグリセリド血症、血中IgG減少 | |
| 循環器 | 四肢冷感、洞性徐脈、不整脈 | 血圧上昇、鼻出血、動悸、心室性期外収縮、静脈瘤 | 血圧低下 |
| 呼吸器 | 咽頭炎、咽頭痛、息苦しさ、気管支炎、咳、鼻汁、喀痰 | ||
| 泌尿器 | 尿蛋白陽性・BUN上昇・クレアチニン上昇等の腎機能障害 | BUN低下、クレアチニン低下 | |
| 血液 | 好中球増多、好酸球増多、好塩基球増多、単球数異常、リンパ球増多、リンパ球減少、ヘモグロビン減少、D-ダイマー上昇、FDP上昇 | 好酸球減少、好塩基球減少、ヘマトクリット減少、MCV上昇、MCHC減少、播種性血管内凝固 | |
| その他 | 味覚異常、疲労、浮腫、CRP上昇 | 体重減少、脱力感、胸痛、発熱、熱感、倦怠感、脱毛、のぼせ、眼瞼腫脹、中耳炎、不規則月経 |
14. 適用上の注意
14.1 薬剤調製時の注意
やむを得ず本剤を脱カプセル調剤する場合には、医療関係者の曝露を防止するために安全キャビネット内で調製を行うこと。
14.2 薬剤交付時の注意
服用時にはカプセルは開けずに服用するよう患者を指導すること。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 未治療の多発性骨髄腫患者を対象とした海外臨床試験において、サリドマイドとメルファラン及びプレドニゾン併用群で対照群(レナリドミド及びデキサメタゾン併用群)と比較して急性骨髄性白血病、骨髄異形成症候群の発現割合が高かったとの報告がある。
15.1.2 クロウ・深瀬(POEMS)症候群患者を対象とした国内臨床試験において、固形がんが発現している。
15.1.3 サリドマイドを使用した患者で、進行性多巣性白質脳症(PML)が発現したとの報告がある31)。
16. 薬物動態
16.1 血中濃度
日本人閉経後健康女性に50mg(n=11)、100mg(n=11)、200mg(n=6)のサリドマイドを1日1回7日間反復経口投与したときの薬物動態パラメータ及び血漿中濃度を表1及び図1に示す5)。
| 用量(mg) | 投与日 | Cmax(μg/mL) | Tmax(h) | AUC0-24(μg・h/mL) | t1/2(h) | 累積係数※※ |
| 50 | 1日目 | 1.07±0.29 | 2.55±1.86 | 8.57±0.80 | 4.82±1.21※ | − |
| 7日目 | 1.13±0.20 | 2.63±1.57 | 8.87±1.03 | 4.48±0.74※ | 1.036±0.085 | |
| 100 | 1日目 | 1.70±0.22 | 2.73±1.62 | 16.36±1.92 | 4.78±0.82 | − |
| 7日目 | 1.71±0.19 | 3.09±1.54 | 16.87±2.02 | 4.99±0.42 | 1.031±0.033 | |
| 200 | 1日目 | 2.31±0.48 | 5.00±1.67 | 30.18±3.35 | 7.43±3.05※ | − |
| 7日目 | 3.00±0.27 | 3.75±1.63 | 33.57±1.97 | 5.57±0.59 | 1.120±0.093 |
図1 日本人閉経後健康女性に本剤を1日1回50mg、100mg、200mgで投与したときの血漿中サリドマイド濃度(平均値±標準偏差)
1日目
7日目
16.2 吸収
16.2.1 食事の影響
日本人閉経後健康女性11例にサリドマイド100mgを空腹時及び高脂肪食摂取後に単回経口投与したとき、Cmax、AUC及びt1/2に食事摂取による影響は認められなかったが、Tmaxは食事摂取により約1時間の有意な延長が認められた6)。
16.3 分布
妊娠マウスに14C-サリドマイドを単回経口投与した場合、放射能濃度は、大部分の臓器において広く分布し、他の臓器に比べ消化管壁・肝臓・腎臓が高く、心筋もわずかに高かった7)8)。妊娠したウサギ9)及びサル10)への経口投与で胎児からサリドマイドが検出された。また、乳汁中(ウサギ)4)及び精液中(外国人データ)3)からサリドマイドが検出されることが報告されている。
(+)-(R)-サリドマイド及び(−)-(S)-サリドマイドのヒト血漿蛋白結合率は、それぞれ55%及び66%であったと報告されている11)(in vitro)。
(+)-(R)-サリドマイド及び(−)-(S)-サリドマイドの血液/血漿中濃度比は、それぞれ0.86及び0.95であり、血球分配比は、それぞれ0.58及び0.87であったと報告されている11)(in vitro)。[1.4、9.4.2、9.4.3、9.6参照]
(+)-(R)-サリドマイド及び(−)-(S)-サリドマイドのヒト血漿蛋白結合率は、それぞれ55%及び66%であったと報告されている11)(in vitro)。
(+)-(R)-サリドマイド及び(−)-(S)-サリドマイドの血液/血漿中濃度比は、それぞれ0.86及び0.95であり、血球分配比は、それぞれ0.58及び0.87であったと報告されている11)(in vitro)。[1.4、9.4.2、9.4.3、9.6参照]
16.4 代謝
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
<再発又は難治性の多発性骨髄腫>
17.1.1 国内第II相試験
治療抵抗性多発性骨髄腫患者に、サリドマイドとして1日100mg〜400mgを16週間単独投与した国内臨床試験では、本剤が投与された37例における軽度寛解以上の有効率は32.4%(12/37)であった。なお、国内臨床試験では、デキサメタゾンを含む他の抗悪性腫瘍剤との併用は行われていない19)。
| 寛解度 | 部分寛解 | 軽度寛解 | 不変 | 悪化 | 判定不能 |
| 例数(%) | 5(13.5%) | 7(18.9%) | 12(32.4%) | 6(16.2%) | 7(18.9%) |
本剤を投与された37例全例において副作用が認められた。主な副作用は、便秘(62.2%)、眠気(54.1%)、口内乾燥(43.2%)等であった。臨床検査値の異常変動は、35例(94.6%)に認められた。
<クロウ・深瀬(POEMS)症候群>
17.1.2 国内第II/III相試験(自己末梢血幹細胞移植非適応患者)
自己末梢血幹細胞移植の適応とならないクロウ・深瀬(POEMS)症候群患者24例に、本剤(隔日100mg〜1日200mg)又はプラセボをデキサメタゾン併用注)下で24週間(6サイクル)投与した二重盲検比較試験期において、本剤群の血清VEGF減少率はプラセボ群と比較して有意に高く、本剤によるデキサメタゾンへの上乗せ効果が認められた。また、徒手筋力試験の合計スコアにおいて本剤群に改善が認められた29)。
| 投与群 | 例数 | ベースラインからの減少率 | 群間差 | |
| 95%信頼区間 | p値 | |||
| 本剤群 | 13 | 0.388±0.135 | 0.409(0.020-0.799) | 0.040 |
| プラセボ群 | 11 | −0.021±0.149 | ||
注)4週間を1サイクルとしてデキサメタゾン(12mg/m2、最大20mg/日)を各サイクルの2〜5日目に経口投与
a)Full analysis set,b)Per protocol set,c)Last observation carried forward
(中止例及び長期試験期への早期移行例の欠測値は、中止時/早期移行時の直前の規定ビジットでの測定値で補完)
また、二重盲検比較試験期から移行した患者23例に本剤(隔日100mg〜1日300mg)を48週間(12サイクル)投与した長期試験期において、血清VEGF減少率(平均値±標準偏差[95%信頼区間](例数))はサイクル1終了時が0.0441±0.27362[−0.08044、0.16866](21例)で、サイクル4終了時は0.0635±0.48305[−0.16934、0.29631](19例)、サイクル8終了時は0.2848±0.36547[0.07375、0.49578](14例)と減少率は上昇した。その後も減少率は維持し、終了時の減少率は0.2782±0.40101[0.04666、0.50974](14例)であり、長期投与による血清VEGF値の改善が確認された29)。
二重盲検比較試験期および長期試験期を通じて本剤を投与された25例中23例(92.0%)において副作用が認められ、主な副作用は便秘(60.0%)、洞性徐脈(44.0%)、末梢性感覚ニューロパチー(20.0%)であった。臨床検査値の異常変動は10例(40.0%)に認められた。洞性徐脈は100mg隔日投与(25例)で5例(20.0%)、100mg連日投与(24例)で2例(8.3%)、200mg連日投与(24例)で4例(16.7%)認められた。また、心停止、心不全が200mg連日投与で各1例(4.2%)、プリンツメタル狭心症(冠攣縮)、洞停止、失神が300mg連日投与(7例)で各1例(14.3%)認められ、これらは全て重篤な事象であった。[5.5、7.4参照]
二重盲検比較試験期および長期試験期を通じて本剤を投与された25例中23例(92.0%)において副作用が認められ、主な副作用は便秘(60.0%)、洞性徐脈(44.0%)、末梢性感覚ニューロパチー(20.0%)であった。臨床検査値の異常変動は10例(40.0%)に認められた。洞性徐脈は100mg隔日投与(25例)で5例(20.0%)、100mg連日投与(24例)で2例(8.3%)、200mg連日投与(24例)で4例(16.7%)認められた。また、心停止、心不全が200mg連日投与で各1例(4.2%)、プリンツメタル狭心症(冠攣縮)、洞停止、失神が300mg連日投与(7例)で各1例(14.3%)認められ、これらは全て重篤な事象であった。[5.5、7.4参照]
17.1.3 国内第II相試験(自己末梢血幹細胞移植適応患者)
クロウ・深瀬(POEMS)症候群患者に、大量化学療法を伴う自己末梢血幹細胞移植療法の前治療として本剤(隔日100mg〜1日300mg)、デキサメタゾン(20mg/日、1-2サイクル:2〜5、16〜19日目、3-6サイクル:2〜5日目)を24週間(6サイクル)投与した国内臨床試験において、本剤が投与された10例における24週後の血清VEGF減少率は0.69±0.33(平均値±標準偏差)、中央値は0.85(範囲:0.0-1.0)であり、血清VEGF値の改善が認められた29)。
本剤を投与された10例中10例(100%)において副作用が認められ、主な副作用は便秘(90.0%)、洞性徐脈(50.0%)であった。臨床検査値の異常変動は2例(20.0%)に認められた。洞性徐脈は100mg隔日投与(10例)で2例(20.0%)、100mg連日投与(10例)で2例(20.0%)、200mg連日投与(9例)で1例(11.1%)認められた29)。[5.5参照]
本剤を投与された10例中10例(100%)において副作用が認められ、主な副作用は便秘(90.0%)、洞性徐脈(50.0%)であった。臨床検査値の異常変動は2例(20.0%)に認められた。洞性徐脈は100mg隔日投与(10例)で2例(20.0%)、100mg連日投与(10例)で2例(20.0%)、200mg連日投与(9例)で1例(11.1%)認められた29)。[5.5参照]
18. 薬効薬理
18.1 作用機序
<再発又は難治性の多発性骨髄腫>
血管新生抑制、サイトカイン産生抑制、細胞接着因子発現抑制、免疫調節、アポトーシス誘導及び細胞増殖抑制作用が報告されているものの、作用機序は十分に解明されていない。
<らい性結節性紅斑>
炎症性サイトカイン産生抑制、接着因子発現抑制、好中球の接着抑制、免疫調節、抗体産生抑制作用が報告されているものの、作用機序は十分に解明されていない。
<クロウ・深瀬(POEMS)症候群>
直接的な抗腫瘍作用やVEGFをはじめとするサイトカイン産生抑制作用が推定されるが、作用機序は十分に解明されていない。
18.2 多発性骨髄腫に関する作用
[18.4参照]
18.2.1 サリドマイドは、ウサギ角膜においてbFGFにより誘導される血管新生を抑制した20)。
18.2.2 サリドマイドは、LPS刺激したヒト単球からのTNF-α産生を抑制し21)、ヒト骨髄腫細胞等の腫瘍細胞とヒト骨髄ストローマ細胞との共培養により亢進するIL-6産生を抑制した22)(in vitro)。
18.2.3 サリドマイドは、多発性骨髄腫患者の末梢血中のナチュラルキラー細胞数を増加させた23)。また、T細胞受容体刺激によるヒトT細胞からのIL-2及びIFN-γ産生を亢進させ、IL-2依存的にT細胞(特に細胞障害性T細胞)の増殖を促進させた24)(in vitro)。
18.2.4 サリドマイドは、ヒト骨髄腫細胞等の腫瘍細胞に対してアポトーシス誘導と細胞増殖抑制を示した25)(in vitro)。
18.3 らい性結節性紅斑に関する作用
18.3.1 サリドマイドは、SAC刺激したヒト末梢血単核細胞からのTNF-α及びIL-12産生を抑制した26)(in vitro)。また、Fc受容体刺激及びTLR2刺激したヒト単球からのIL-1β産生を抑制した27)(in vitro)。
18.3.2 サリドマイドは、IL-1β及びIFN-γ刺激したヒト臍帯静脈内皮細胞からのE-selectinの発現増加及び好中球接着亢進を抑制した27)(in vitro)。
18.3.3 サリドマイドは、T細胞受容体刺激によるヒトT細胞及びCD8陽性細胞からのIL-2産生を亢進した24)(in vitro)。
18.3.4 サリドマイドは、PWM刺激したヒト末梢血単核細胞からのIgM及びIgG産生を抑制した28)(in vitro)。
18.4 クロウ・深瀬(POEMS)症候群に関する作用
[18.2参照]
19. 有効成分に関する理化学的知見
19.1. サリドマイド
20. 取扱い上の注意
20.1 薬剤管理は徹底すること。
20.2 アルミ袋開封後は、直射日光及び高温・高湿を避けて保存すること。
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 本剤の製造販売・管理・使用等にあたっては、「サリドマイド製剤等安全管理手順」を適正に遵守すること。また、本手順の変更については、あらかじめ、厚生労働省の了解を受けなければならないこと。
21.3 本剤の投与が、緊急時に十分対応できる医療施設において、十分な知識・経験を有する医師のもとで、本剤の投与が適切と判断される症例のみを対象に、あらかじめ患者又はその家族に有効性及び危険性が文書をもって説明され、文書による同意を得てから初めて投与されるよう、厳格かつ適正な措置を講じること。
<クロウ・深瀬(POEMS)症候群>
21.4 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤の使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
<サレドカプセル25>
28カプセル[7カプセル(PTP)×4]
<サレドカプセル50>
28カプセル[7カプセル(PTP)×4]
<サレドカプセル100>
28カプセル[7カプセル(PTP)×4]
23. 主要文献
- 藤本製薬株式会社:サリドマイド製剤安全管理手順(TERMS)
- 石井 則久 他, Jpn J Lepr., 80, 275-285, (2011) »DOI
- Teo SK,et al., J Chromatogr B Analyt Technol Biomed Life Sci., 767, 145-151, (2002) »PubMed
- Teo SK,et al., Toxicol Sci., 81, 379-389, (2004) »PubMed
- 社内資料:サレドカプセル50・100の薬物動態試験(反復投与)のまとめ
- 社内資料:サレドカプセル100の薬物動態試験(食事の影響)のまとめ
- Koransky W,et al., Proc Soc Exp Biol Med., 116, 512-516, (1964) »PubMed
- Nicholls PJ., J Pharm Pharmacol., 18, 46-48, (1966) »PubMed
- Fabro S,et al., Biochem J., 104, 565-569, (1967) »PubMed
- Schumacher HJ,et al., J Pharmacol Exp Ther., 173, 265-269, (1970) »PubMed
- Eriksson T,et al., Chirality., 10, 223-228, (1998) »PubMed
- Schumacher H,et al., Br J Pharmacol Chemother., 25, 324-337, (1965) »PubMed
- Lu J,et al., Clin Cancer Res., 9, 1680-1688, (2003) »PubMed
- Eriksson T,et al., J Pharm Pharmacol., 50, 1409-1416, (1998) »PubMed
- Teo SK,et al., J Biochem Mol Toxicol., 14, 140-147, (2000) »PubMed
- Ando Y,et al., Cancer Biol Ther., 1, 669-673, (2002) »PubMed
- Chung F,et al., Clin Cancer Res., 10, 5949-5956, (2004) »PubMed
- Schumacher H,et al., J Pharmacol Exp Ther., 160, 201-211, (1968) »PubMed
- 社内資料:FPF300の多発性骨髄腫に対する臨床試験まとめ
- D'Amato RJ,et al., Proc Natl Acad Sci USA., 91, 4082-4085, (1994) »PubMed
- Sampaio EP,et al., J Exp Med., 173, 699-703, (1991) »PubMed
- Gupta D,et al., Leukemia., 15, 1950-1961, (2001) »PubMed
- Davies FE,et al., Blood., 98, 210-216, (2001) »PubMed
- Haslett PAJ,et al., J Exp Med., 187, 1885-1892, (1998)
- Hideshima T,et al., Blood., 96, 2943-2950, (2000) »PubMed
- Moller DR,et al., J Immunol., 159, 5157-5161, (1997) »PubMed
- Lee DJ,et al., J Infect Dis., 201, 558-569, (2010) »PubMed
- Shannon EJ,et al., Int Immunopharmacol., 10, 487-492, (2010) »PubMed
- 社内資料:FPF300のクロウ・深瀬(POEMS)症候群に対する臨床試験(2021年2月24日承認、CTD2.7.6.1)
- 造血器腫瘍診療ガイドライン:日本血液学会編
- Katsuse K,et al., Clin Neurol Neurosurg., 192, 105709, (2020) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
藤本製薬株式会社
学術部
〒580-8503
大阪府松原市西大塚1丁目3番40号
電話:0120-225-591
FAX:0120-116-026
製品情報問い合わせ先
藤本製薬株式会社
学術部
〒580-8503
大阪府松原市西大塚1丁目3番40号
電話:0120-225-591
FAX:0120-116-026
藤本製薬株式会社
TERMS管理センター
〒580-0004
大阪府松原市西野々2丁目2番10号
電話:0120-001-468
FAX:072-336-5566
TERMSに関するお問い合わせ先
26. 製造販売業者等
26.1 製造販売元
藤本製薬株式会社
〒580-8503
大阪府松原市西大塚1丁目3番40号