医薬品情報
| 総称名 | デルティバ |
|---|---|
| 一般名 | デラマニド |
| 欧文一般名 | Delamanid |
| 製剤名 | デラマニド錠 |
| 薬効分類名 | 結核化学療法剤 |
| 薬効分類番号 | 6222 |
| ATCコード | J04AK06 |
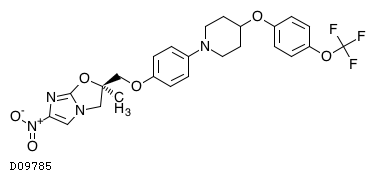
| KEGG DRUG |
D09785
デラマニド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年11月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| デルティバ錠50mg | DELTYBA tablets 50mg | 大塚製薬 | 6222006F1029 | 5999.2円/錠 | 劇薬, 処方箋医薬品注) |
1. 警告
1.1 本剤に対する耐性菌発現を防ぐため、結核症の治療に十分な知識と経験を持つ医師又はその指導のもとで投与し、適正使用に努めること。本剤の投与は、製造販売業者が行うRAP(Responsible Access Program)に登録された医師・薬剤師のいる登録医療機関・薬局において、登録患者に対して行うこと。
1.2 本剤の投与によりQT延長があらわれるおそれがあるので、投与開始前及び投与中は定期的に心電図検査等を行い、リスクとベネフィットを考慮して本剤の投与を慎重に判断すること。
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
6. 用法及び用量
通常、成人にはデラマニドとして1回100mgを1日2回朝、夕に食後経口投与する。
7. 用法及び用量に関連する注意
7.1 本剤の使用にあたっては、耐性菌の発現を防ぐため、原則として他の抗結核薬及び本剤に対する感受性(耐性)を確認し、感受性を有する既存の抗結核薬3剤以上に本剤を上乗せして併用すること。
7.2 臨床試験において継続して6箇月を超える使用経験はないため、本剤を長期に使用する場合は、リスクとベネフィットを考慮して投与の継続を慎重に判断すること。
7.3 空腹時に本剤を投与した場合、食後投与と比較してCmax及びAUCの低下が認められることから、空腹時投与を避けること。[16.2.1参照]
8. 重要な基本的注意
8.2 本剤を含む抗結核薬による治療で、薬剤逆説反応を認めることがある。治療開始後に、既存の結核の悪化又は結核症状の新規発現を認めた場合は、薬剤感受性試験等に基づき投与継続の可否を判断すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 QT延長のある患者(先天性QT延長症候群等)
9.1.2 QT延長を起こしやすい下記の患者
・著明な徐脈のある患者
・電解質異常のある患者(低カリウム血症、低マグネシウム血症、低カルシウム血症)
・心疾患のある患者
9.1.3 低アルブミン血症の患者
9.3 肝機能障害患者
未変化体及び代謝物の血漿中濃度が上昇し、QT延長等の副作用が発現するおそれがある。
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット)で乳汁中への移行が報告されている2)。
9.7 小児等
9.7.1 18歳未満の患者を対象とした臨床試験は実施していない。
9.7.2 外国において、デラマニドを投与した小児等に、幻覚があらわれたとの報告がある。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| QT延長を起こすことが知られている薬剤 キノロン系抗菌薬 モキシフロキサシン塩酸塩、レボフロキサシン水和物 等 クラスIA抗不整脈薬 キニジン硫酸塩水和物、プロカインアミド塩酸塩 等 クラスIII抗不整脈薬 アミオダロン塩酸塩、ソタロール塩酸塩 等 スルピリド、イミプラミン塩酸塩、ピモジド、ハロペリドール、エリスロマイシン、コハク酸ソリフェナシン、ベダキリンフマル酸塩 等 | リスクとベネフィットを考慮して本剤投与の適応を慎重に判断すること。QT延長を起こすおそれがある。 | 併用により相加的なQT延長を起こすおそれがある。 |
| 低カリウム血症を起こすことが知られている薬剤 アミノグリコシド系抗菌薬 エンビオマイシン硫酸塩、カナマイシン硫酸塩 等 利尿剤 フロセミド、トリクロルメチアジド 等 アムホテリシンB 等 | 低カリウム血症を起こすおそれがある。 | 本剤及びこれらの薬剤はQT延長の原因となる電解質異常を起こすおそれがある。 |
11. 副作用
11.1 重大な副作用
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 精神神経系 | めまい、頭痛、傾眠、不眠症 | 錯感覚、不安、振戦 | 感覚鈍麻、嗜眠、睡眠障害、末梢性ニューロパチー、平衡障害、不快感、リビドー亢進、激越、うつ病、精神障害、精神病性障害 | 幻覚 |
| 消化器 | 悪心、嘔吐、腹痛 | 胃炎、腹部不快感、食欲不振、消化不良、下痢 | 食欲亢進、味覚異常 | |
| 循環器 | 動悸 | 房室ブロック、期外収縮、高血圧、低血圧 | ||
| 血液 | 貧血、赤血球増加、白血球減少、好酸球増加 | |||
| 肝臓 | 肝機能異常 | 高ビリルビン血症 | ||
| 皮膚 | 発疹、そう痒症、ざ瘡、多汗症 | 皮膚炎、蕁麻疹、脱毛症 | ||
| その他 | ほてり、耳鳴、無力症、関節痛、筋痛、高尿酸血症、低カリウム血症、コルチゾール上昇 | 呼吸困難、耳痛、眼痛、霧視、屈折障害、倦怠感、胸部不快感、胸痛、側腹部痛、四肢痛、口腔咽頭痛、喀血、コルチゾール低下 | 咽喉刺激感、甲状腺機能低下症、筋力低下、筋痙縮 |
13. 過量投与
13.1 症状
QT延長を起こすおそれがある。
13.2 処置
心電図検査を実施し、患者の状態を十分に観察すること。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 マウス及びラットを用いたがん原性試験(2年間強制経口投与)においてがん原性は認められなかったが、当該試験においてヒトの主代謝物の1つの曝露量(AUC)は臨床曝露量を下回っており、そのがん原性リスクは明らかにされていない。
15.2.2 マウスのがん原性試験において、ビタミンKの低下によると思われる出血が投与24週間以降の雄マウスにおいて認められた1)。
16. 薬物動態
16.1 血中濃度
16.1.1 単回及び反復投与
健康成人に本剤100mg又は200mg注)を食後に単回及び1日1回10日間反復経口投与した時の未変化体の血漿中濃度推移及び薬物動態パラメータを図16-1及び表16-1に示す。
健康成人に本剤100mg又は200mgを1日1回食後反復経口投与した時の未変化体の血漿中濃度は10日以内に定常状態に達し、約2倍の累積がみられた3)。
健康成人に本剤100mg又は200mgを1日1回食後反復経口投与した時の未変化体の血漿中濃度は10日以内に定常状態に達し、約2倍の累積がみられた3)。
図16-1 健康成人における本剤100mg又は200mgを食後に単回及び1日1回10日間反復投与時の血漿中濃度推移
| tmax(h) | Cmax(ng/mL) | AUCa)(ng・h/mL) | t1/2(h) | |
| 単回投与 | ||||
| 100mg | 4.0(4.0-5.0) | 201.1(17.5) | 3,190.8(23.2) | 25.6(35.2) |
| 200mg | 4.5(2.0-5.0) | 212.4(26.9) | 3,275.7(17.5) | 29.4(18.8) |
| 反復投与 | ||||
| 100mg | 4.5(4.0-5.0) | 327.7(16.5) | 4,207.5(20.9) | 26.4(32.3) |
| 200mg | 4.0(3.0-5.0) | 422.0(20.1) | 5,230.0(16.2) | 33.0(10.4) |
16.1.2 反復投与
多剤耐性肺結核患者に標準治療と併用して本剤1回100mgを1日2回56日間食後投与した時の未変化体の血漿中濃度は14日以内で定常状態に達した。また、QTc延長作用に主に関与している代謝物(DM-6705)の血漿中濃度は投与開始後6週間で定常状態に達した。未変化体及び代謝物(DM-6705)の薬物動態パラメータを表16-2に示す4)(外国人データを含む)。
| tmax(h) | Cmax(ng/mL) | AUC24h(ng・h/mL) | t1/2(h) | |
| 未変化体 (144例,t1/2:66例) | 3.02(0.00-9.97) | 414(39.9) | 7,925(37.5) | 37.8(34.3) |
| 代謝物(DM-6705) (144例,t1/2:140例) | 9.97(0.00-24.0) | 151(44.6) | 3,125(44.7) | 231(36.7) |
16.2 吸収
16.2.1 食事の影響
16.3 分布
デラマニド及びDM-6705のヒト血清蛋白結合率は、99.5%以上であった6)(in vitro、平衡透析法)。
16.4 代謝
16.5 排泄
健康成人に、14C-デラマニド100mgを食後に単回経口投与した時、糞中及び尿中にそれぞれ投与した放射能の89%及び3%が排泄された。未変化体の糞中からの回収率は投与量の53〜75%であったが、尿中からは回収されなかった8)(外国人データ)。
16.7 薬物相互作用
16.7.1 抗結核薬
健康成人において、本剤は併用したリファンピシン[R]・イソニアジド[H]・ピラジナミド[Z]のCmax及びAUCに影響を及ぼさなかったが、エタンブトール[E]のCmax及びAUCは本剤の併用によってそれぞれ27%及び23%増加した。本剤のCmax及びAUCは[R]/[H]/[Z]/[E]との併用投与により45%減少した9)(外国人データ)。
16.7.2 抗HIV薬
16.7.3 In vitro試験
注)本剤の承認された用量は、通常1回100mgを1日2回である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 第II相国際共同試験
多剤耐性肺結核患者(481例、日本人12例を含む)を対象に、プラセボ対照無作為化二重盲検並行群間比較試験を実施し、本剤100mg1日2回又は200mg注)1日2回を標準治療に上乗せして56日間投与時の有効性及び安全性を検討した。本剤100mg群及びプラセボ群の喀痰中菌陰性化率は、それぞれ45.4%(64/141例)及び29.6%(37/125例)であり、対比較において、統計学的に有意な差が認められた(p=0.0083、空洞形成の有無を層としたCochran-Mantel-Haenszel検定)14)。
本剤100mg群の副作用発現頻度は、161例中62例(38.5%)であった。主な副作用は、不眠症13例(8.1%)、嘔吐10例(6.2%)、心電図QT延長10例(6.2%)及び傾眠7例(4.3%)であった。
本剤100mg群の副作用発現頻度は、161例中62例(38.5%)であった。主な副作用は、不眠症13例(8.1%)、嘔吐10例(6.2%)、心電図QT延長10例(6.2%)及び傾眠7例(4.3%)であった。
17.1.2 最終治療転帰
第II相国際共同試験に組入れられた多剤耐性肺結核患者(その後の6箇月継続投与試験に参加した患者を含む)の2年後の最終治療転帰について、治癒又は治療完了した患者の割合は、本剤100mg1日2回又は200mg注)1日2回を6箇月以上#標準治療に上乗せした患者集団で74.5%(143/192例)、標準治療への上乗せが2箇月以下だった患者集団では55.0%(126/229例)であった15)。
#:第II相国際共同試験で56日(2箇月)、継続投与試験で6箇月
17.3 その他
17.3.1 QT間隔に対する影響
第II相国際共同試験において、多剤耐性肺結核患者(481例、日本人12例を含む)を対象に、本剤100mg1日2回又は200mg注)1日2回を標準治療に上乗せして56日間投与した結果、QTcF間隔の平均変化量は投与期間とともに増加し、用量依存的なQT延長が認められた(表17-1)4)。なお、本剤100mg1日2回群は56日目の投与後4時間において最大16.8msecを示し、その時のプラセボ群の変化量は5.0msecであった。また、本剤200mg1日2回群は56日目の投与後10時間において最大20.8msecを示し、その時のプラセボ群の変化量は5.2msecであった。その後の6箇月継続投与試験では、QTcF間隔の平均変化量は6週目以降安定し、6箇月の投薬期間中はそのまま変化量が増大することなく推移した(表17-2)16)。また、本剤を56日間投与した結果、QTcF間隔の変化がいずれかの時点で60msec以上延長した患者は、本剤100mg1日2回群で7.5%(12/161例)、本剤200mg1日2回群で10.6%(17/160例)であった4)。このうち1例はQTcF間隔が500msecを超えていた。その後の6箇月継続投与試験では、本剤100mg1日2回群で3.6%(5/137例)、本剤200mg1日2回群で3.9%(3/76例)であった16)。
| 投与日 | QTcFの変化量(msec) | ||
| 本剤100mg1日2回+OBR(161例) | 本剤200mg1日2回+OBR(160例) | プラセボ+OBR(160例) | |
| 1日目 | −0.1(11.7) | −1.2(10.5) | −3.2(10.4) |
| 14日目 | 6.7(13.2) | 6.8(13.1) | −1.2(14.6) |
| 28日目 | 6.1(17.7) | 11.4(15.1) | 0.1(15.1) |
| 56日目 | 12.8(16.6) | 14.7(16.0) | −0.4(14.5) |
| 週目 | 本剤100mg1日2回+OBR | 本剤200mg1日2回+OBR | ||
| 例数 | QTcFの変化量(msec) | 例数 | QTcFの変化量(msec) | |
| 2 | 115 | 10.4(194.2) | 68 | 11.2(192.2) |
| 6 | 110 | 13.5(140.8) | 65 | 9.60(195.2) |
| 10 | 74 | 16.5(133.8) | 39 | 10.4(249.0) |
| 14 | 104 | 13.7(141.7) | 60 | 10.0(217.5) |
| 18 | 86 | 13.0(167.9) | 43 | 12.3(188.5) |
| 22 | 94 | 14.4(147.0) | 49 | 9.73(223.7) |
| 26 | 98 | 14.6(140.7) | 55 | 13.7(154.3) |
注)本剤の承認された用量は、通常1回100mgを1日2回である。
18. 薬効薬理
18.1 作用機序
結核菌特有のミコール酸の生合成を阻害する17)。
18.2 抗菌作用
18.3 治療効果
マウス慢性結核症モデルにおいて、経口投与による肺内生菌数の用量相関的な減少が認められ、治療効果を示した。また、免疫応答及び免疫不全マウス結核症モデルにおいても、同程度の治療効果を示した17)。
18.4 既存抗結核薬との併用効果
18.5 耐性
19. 有効成分に関する理化学的知見
19.1. デラマニド
20. 取扱い上の注意
吸湿性を有するためPTP包装のまま保存すること。
21. 承認条件
日本人での投与経験が極めて限られていることから、製造販売後一定期間は、全症例を対象に使用成績調査を実施することにより、本剤使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
PTP
20錠(10錠×2)
23. 主要文献
- 社内資料:デラマニドの毒性試験(2014年7月4日承認、CTD2.6.6)
- 社内資料:ラット胎盤通過性及び乳汁移行(2014年7月4日承認、CTD2.6.4.4、2.6.4.6)
- 社内資料:反復投与試験(2014年7月4日承認、CTD2.7.6.2)
- 社内資料:多剤耐性肺結核患者を対象としたプラセボとの二重盲検試験(2014年7月4日承認、CTD2.7.6.4)
- 社内資料:単回投与試験(2014年7月4日承認、CTD2.7.6.2)
- Sasahara,K.et al., Drug Metab Dispos., 43 (8), 1267-1276, (2015) »PubMed
- Shimokawa,Y.et al., Drug Metab Dispos., 43 (8), 1277-1283, (2015) »PubMed
- 社内資料:14C-デラマニド単回投与試験(2014年7月4日承認、CTD2.7.6.3)
- 社内資料:エタンブトール及びRifater併用時の相互作用(2014年7月4日承認、CTD2.7.6.2)
- 社内資料:抗HIV薬併用時の相互作用(2014年7月4日承認、CTD2.7.6.2)
- 社内資料:エファビレンツ併用時の相互作用(2014年7月4日承認、CTD2.7.6.2)
- Shimokawa,Y.et al., Biol Pharm Bull., 37 (11), 1727-1735, (2014) »PubMed
- Sasabe,H.et al., Antimicrob Agents Chemother., 60 (6), 3497-3508, (2016) »PubMed
- Gler,M.T.et al., N Engl J Med., 366 (23), 2151-2160, (2012) »PubMed
- Skripconoka,V.et al., Eur Respir J., 41 (6), 1393-1400, (2013) »PubMed
- 社内資料:多剤耐性肺結核患者を対象とした長期投与試験(2014年7月4日承認、CTD2.7.6.4)
- Matsumoto,M.et al., PLoS Medicine., 3 (11), 2131-2144, (2006)
- 社内資料:臨床試験で分離した結核菌(多剤耐性、超多剤耐性)に対するデラマニドの感受性(2014年7月4日承認、CTD2.6.2.2)
- 社内資料:日本で分離された結核菌(多剤耐性、超多剤耐性)に対するデラマニドの感受性1(2014年7月4日承認、CTD2.6.2.2)
- 社内資料:日本で分離された結核菌(多剤耐性、超多剤耐性)に対するデラマニドの感受性2(2014年7月4日承認、CTD2.6.2.2)
- Chen,X.et al., Antimicrob Agents Chemother., 61 (6), e02402-16, (2017) »PubMed
- 社内資料:マウス慢性結核症モデルでの多剤耐性結核症に対するデラマニドを含む併用療法の解析(2014年7月4日承認、CTD2.6.2.5)
- Fujiwara,M.et al., Tuberculosis., 108, 186-194, (2018) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
製品情報問い合わせ先
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
26. 製造販売業者等
26.1 製造販売元
大塚製薬株式会社
東京都千代田区神田司町2-9