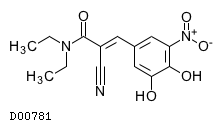
医薬品情報
| 総称名 | スタレボ |
|---|---|
| 一般名 | レボドパ カルビドパ水和物 エンタカポン |
| 欧文一般名 | Levodopa Carbidopa Hydrate Entacapone |
| 製剤名 | レボドパ・カルビドパ水和物・エンタカポン配合錠 |
| 薬効分類名 | 抗パーキンソン剤 |
| 薬効分類番号 | 1169 |
| ATCコード | N04BA03 |
| KEGG DRUG |
D10293
カルビドパ・レボドパ・エンタカポン
|
| KEGG DGROUP |
DG01967
抗パーキンソン病薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年12月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| スタレボ配合錠L50 | Stalevo Combination Tablets | オリオンファーマ・ジャパン | 1169102F1027 | 79.1円/錠 | 処方箋医薬品注) |
| スタレボ配合錠L100 | Stalevo Combination Tablets | オリオンファーマ・ジャパン | 1169102F2023 | 79.4円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
パーキンソン病[レボドパ・カルビドパ投与において症状の日内変動(wearing-off現象)が認められる場合]
5. 効能または効果に関連する注意
5.1 原則として、本剤はレボドパ・カルビドパとエンタカポンの併用投与を行っている患者に対し、既存治療に替えて使用する。
5.2 レボドパ・カルビドパ投与による治療(少なくともレボドパとして1日300mg)においてwearing-off現象が認められる患者への本剤の使用は、1日総レボドパ量が600mg以下であり、ジスキネジーを有しない場合とし、エンタカポンの併用よりも本剤の投与が適切であるか慎重に判断すること。
6. 用法及び用量
成人には、レボドパ・カルビドパ・エンタカポンとして1回50mg/5mg/100mg〜200mg/20mg/200mgの間で1回1又は2錠を経口投与する。
なお、症状により用量及び投与回数を調節するが、1日総レボドパ量として1,500mg、総カルビドパ量として150mg、総エンタカポン量として1,600mgを超えないこと。また、投与回数は1日8回を超えないこと。
なお、症状により用量及び投与回数を調節するが、1日総レボドパ量として1,500mg、総カルビドパ量として150mg、総エンタカポン量として1,600mgを超えないこと。また、投与回数は1日8回を超えないこと。
7. 用法及び用量に関連する注意
7.1 既存治療から本剤への切り替え
7.1.1 レボドパ・カルビドパとエンタカポンの併用投与が行われている場合
本剤投与へ切り替える際の1回レボドパ用量及びエンタカポン用量は、既存治療における各々の用量と一致させること。本剤2錠への切り替えは、既存治療において1回エンタカポン用量が200mgであり、レボドパ用量が一致する場合にのみ行うこと。
7.1.2 レボドパ・カルビドパの投与が行われ、エンタカポンは併用されていない場合
(1)エンタカポンはレボドパの生物学的利用率を高めるため、エンタカポンが併用されていない患者では、本剤の投与開始によりレボドパによるドパミン作動性の副作用(ジスキネジー等)があらわれる場合がある。このため、本剤の投与開始時には患者の状態を十分観察し、ドパミン作動性の副作用がみられた場合は、本剤の用量を調節する又は切り替え前の治療に戻すなど適切な処置を行うこと。
(2)本剤投与へ切り替える際の1回レボドパ用量は、既存治療における用量と一致させること。エンタカポンの通常用量は1回100mgであることから、必ず本剤1回1錠へ切り替えること。
7.2 本剤による治療中
7.2.1 用量の調節が必要な場合には、1回用量を調節するほか、投与間隔や投与回数の変更及び必要に応じてレボドパ製剤とエンタカポンの併用による調節も考慮すること。レボドパ製剤又はエンタカポン単剤を追加する必要がある場合には、本剤との組合せによる治療が適切であるか慎重に検討すること。
7.2.2 本剤に他のレボドパ製剤を追加する場合でも、1日総レボドパ量は1,500mgを超えないこと。
7.2.3 エンタカポンの1回最大用量は200mgであり、1回あたり本剤2錠を超えて投与しないこと。また、本剤1錠にエンタカポン単剤を追加する場合にもエンタカポンとしての投与量は1回200mgまでとし、1日総エンタカポン量は1,600mgを超えないこと。
7.2.4 1回エンタカポン用量を200mgに増量した場合、ジスキネジー等が発現することがあるので、1回200mgへの増量は慎重に検討すること。また、増量した際は観察を十分に行い、これらの症状が発現した場合には症状の程度に応じて1回エンタカポン用量を減量するなど適切な処置を行うこと。
7.2.5 肝障害のある患者では、やむを得ず1回エンタカポン用量を200mgに増量する場合には、観察を十分に行いながら特に慎重に投与すること。[9.3.1参照]
7.2.6 体重40kg未満の低体重の患者では、エンタカポンの1回200mgへの増量は慎重に検討すること。[9.1.9参照]
7.3 本剤中止時
7.3.1 本剤からエンタカポンを併用しないレボドパ・カルビドパによる治療に切り替える場合には、パーキンソン病症状が十分にコントロールされるよう、必要に応じてレボドパ増量等も考慮すること。
8. 重要な基本的注意
8.2 パーキンソン病患者において、まれに重度のジスキネジーに続発する又は悪性症候群に続発する横紋筋融解症があらわれることがある。また、エンタカポン投与中に横紋筋融解症の発現も報告されているので、患者の状態を注意深く観察しながら投与すること。[2.2、11.1.1、11.1.2参照]
8.3 パーキンソン病治療薬を突然中止した際に悪性症候群様症状や横紋筋融解症が発現するおそれがあるので、本剤及び他のドパミン系治療薬の中止が必要な場合は、患者の状態を十分観察しながら徐々に減量すること。本剤を徐々に減量したにもかかわらず何らかの症状・徴候が認められた場合には、必要に応じて他のレボドパ製剤を追加するなど適切な処置を行うこと。[2.2、11.1.1、11.1.2参照]
8.4 前兆のない突発的睡眠、傾眠、起立性低血圧等があらわれることがあるので、本剤投与中の患者には自動車の運転、高所での作業等、危険を伴う作業には従事させないように注意すること。[11.1.3参照]
8.6 レボドパ又はドパミン受容体作動薬を投与された患者において、病的賭博(個人的生活の崩壊等の社会的に不利な結果を招くにもかかわらず、持続的にギャンブルを繰り返す状態)、病的性欲亢進、強迫性購買、暴食等の衝動制御障害が報告されている。また、レボドパを投与された患者において、衝動制御障害に加えてレボドパを必要量を超えて求めるドパミン調節障害症候群が報告されている。患者及び家族等にこれらの症状について説明し、これらの症状が発現した場合には、減量又は投与を中止するなど適切な処置を行うこと。
8.7 溶血性貧血、血小板減少があらわれることがあるので、定期的に血液検査を実施するなど観察を十分に行うこと。[11.1.6参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 褐色細胞腫又はパラガングリオーマの患者
高血圧クリーゼのリスクが増大するおそれがある。
9.1.2 胃潰瘍、十二指腸潰瘍のある患者又はその既往歴のある患者
症状が悪化するおそれがある。
9.1.3 重篤な心疾患又はその既往歴のある患者
症状が悪化するおそれがある。
9.1.4 肺疾患、気管支喘息のある患者
症状が悪化するおそれがある。
9.1.5 内分泌系疾患のある患者
症状が悪化するおそれがある。
9.1.6 糖尿病の患者
血糖値の上昇を誘発し、インスリン必要量を増大させるとの報告がある。
9.1.7 慢性開放隅角緑内障の患者
眼圧上昇を起こし、緑内障が悪化するおそれがある。
9.1.8 自殺傾向を伴ううつ病等の精神症状のある患者
9.1.9 体重40kg未満の低体重の患者
エンタカポンを1回200mg投与した場合、ジスキネジーの発現が増加することがある。[7.2.6参照]
9.2 腎機能障害患者
9.2.1 腎障害のある患者
副作用の発現が増加するおそれがある。
9.3 肝機能障害患者
9.3.1 肝障害又はその既往歴のある患者
肝障害のある患者でエンタカポンの血中濃度が上昇したとの報告がある。[7.2.5参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。レボドパ・カルビドパでは、動物実験(ウサギ)で催奇形性が報告されている。また、エンタカポンでは、生殖発生毒性試験において、ラットの1,000mg/kg/日投与群で胎児の骨化遅延が認められている。
9.6 授乳婦
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能(腎機能、肝機能等)が低下している。
10. 相互作用
相互作用序文
エンタカポンはカテコール-O-メチルトランスフェラーゼ(COMT)阻害剤であり、COMTによって代謝される薬剤の血中薬物濃度を増加させる可能性があるので、このような薬剤と併用する場合には注意して投与すること。また、エンタカポンは薬物代謝酵素CYP2C9を阻害することが示唆されていることから、本酵素により代謝される薬剤と併用する場合には注意して投与すること。[16.4参照]
薬物代謝酵素用語
カテコール-O-メチルトランスフェラーゼ(COMT)
薬物代謝酵素用語
CYP2C9
10.2 併用注意
| COMTにより代謝される薬剤 アドレナリン ノルアドレナリン イソプレナリン ドパミン等 | 心拍数増加、不整脈、血圧変動があらわれるおそれがある。吸入を含めて投与経路にかかわらず注意すること。 | カテコール基を有するこれらの薬剤はCOMTにより代謝されるが、エンタカポンはこれらの薬剤の代謝を阻害し、作用を増強させる可能性がある。 |
| 選択的MAO-B阻害剤 セレギリン等 | 血圧上昇等を起こすおそれがある。 本剤とセレギリンを併用する場合は、セレギリンの1日量は10mgを超えないこと。 | 選択的MAO-B阻害剤は用量の増加とともにMAO-Bの選択的阻害効果が低下し、非選択的MAO阻害による危険性があるため、本剤との併用により、生理的なカテコールアミンの代謝が阻害される可能性がある。 |
| ワルファリン | エンタカポンはR-ワルファリン(光学異性体)のAUCを18%増加させ、プロトロンビン比(INR値)を13%増加させたとの報告がある。併用する場合にはINR等の血液凝固能の変動に十分注意すること。 | 機序は不明である。 |
| 鉄剤 | 鉄剤の効果が減弱する。鉄剤と併用する場合は、少なくとも2〜3時間以上あけて服用すること。 | 本剤は消化管内で鉄とキレートを形成することがある。 |
| レセルピン製剤 テトラベナジン | 脳内ドパミンが減少し、本剤の作用が減弱するおそれがある。 | 脳内ドパミンを減少させてパーキンソン症状を悪化させる。 |
| 血圧降下剤 メチルドパ レセルピン等 | 血圧低下作用が増強されるおそれがある。 | 作用機序は異なるが、本剤と血圧降下剤の併用により相加的血圧低下が起こる可能性がある。 |
| 抗精神病薬 フェノチアジン系薬剤(クロルプロマジン等) ブチロフェノン系薬剤(ハロペリドール等) その他(ペロスピロン等) | 本剤の作用が減弱され、パーキンソン病症状が悪化するおそれがある。 | これらの薬剤によりドパミン受容体が遮断される。 |
| 他の抗パーキンソン剤 抗コリン剤 アマンタジン ブロモクリプチン | 精神神経系の副作用が増強されるおそれがある。 | それぞれの薬剤で精神神経系の副作用が報告されていることから、併用により精神神経系の副作用が増強されることがある。 |
| NMDA受容体拮抗剤 メマンチン等 | 本剤の作用を増強するおそれがある。 | これらの薬剤により、ドパミン遊離が促進する可能性がある。 |
| パパベリン | 本剤の作用が減弱され、パーキンソン病症状が悪化するおそれがある。 | 明確な機序は不明であるが、以下のような説がある。 ・パパベリンが線条体でのドパミン受容体を遮断する。 ・パパベリンがアドレナリン作動性神経小胞でレセルピン様作用を示す。 |
| イソニアジド | 本剤の作用が減弱され、パーキンソン病症状が悪化するおそれがある。 | 機序は不明であるが、イソニアジドによりドパ脱炭酸酵素が阻害されると考えられている。 |
| イストラデフィリン | エンタカポンとイストラデフィリンとの併用によりジスキネジーの発現頻度の上昇が認められた。 | 機序は不明である。 |
| スピラマイシン | レボドパの血中濃度が低下し、本剤の作用が減弱するおそれがある。 | カルビドパの吸収が阻害されることにより、レボドパの血中濃度が低下したとの報告がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
国内における本剤のパーキンソン病患者における臨床試験成績は得られていない。副作用の発現頻度は、エンタカポン単剤の国内臨床試験成績に基づき分類した。
11.1.1 悪性症候群(1%未満)
11.1.2 横紋筋融解症(頻度不明)
11.1.3 突発的睡眠(1%未満)、傾眠(5%以上)
前兆のない突発的睡眠、傾眠があらわれることがある。[8.4参照]
11.1.5 肝機能障害(頻度不明)
胆汁うっ滞性肝炎等の肝機能障害があらわれることがある。
11.1.6 溶血性貧血、血小板減少(いずれも頻度不明)[8.7参照]
11.1.7 閉塞隅角緑内障(頻度不明)
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 皮膚障害 | 多汗症 | 発疹(紅斑性又は斑状丘疹状の皮疹)、蕁麻疹、紫斑、皮膚・毛髪・髭・爪・汗の変色注1)、脱毛症、血管浮腫 | ||
| 精神障害 | 不眠症 | 悪夢、妄想 | 不安、病的性欲亢進、異常な夢 | 激越、精神病、衝動制御障害(病的賭博、リビドー亢進、性欲過剰等)、易刺激性、失見当識、自殺企図、ドパミン調節障害症候群 |
| 神経系障害 | ジスキネジー(37.5%)、ジストニー | 頭痛、浮動性めまい、体位性めまい、パーキンソニズム悪化(アップダウン現象等) | 味覚異常、運動過多、振戦 | 失神、回転性めまい、運動低下、オンオフ現象、精神的機能障害(記憶障害、認知症等)、感覚鈍麻 |
| 眼障害 | 霧視、視力障害 | |||
| 胃腸障害 | 便秘(20.2%)、悪心 | 上腹部痛、下痢注2)、胃不快感、食欲不振、嘔吐、レッチング、消化不良、胃炎 | 腹痛 | 鼓腸、大腸炎、腹部不快感、嚥下障害、食欲減退、口内乾燥、腹部膨満、流涎過多、口内炎、胃腸出血 |
| 心臓障害 | 心拍数不整、動悸、不整脈、虚血性心疾患(狭心症、心筋梗塞等) | |||
| 肝胆道系障害 | AST増加、ALT増加 | γ-GTP増加 | ||
| 腎及び尿路障害 | 着色尿注1)(14.4%) | 尿潜血陽性、頻尿、BUN上昇 | 尿閉、排尿異常 | |
| 血液及びリンパ系障害 | 貧血 | ヘモグロビン減少、白血球数減少、赤血球数減少、白血球数増加 | ヘマトクリット減少、鉄欠乏性貧血 | 顆粒球数減少 |
| 全身障害 | けん怠感、末梢性浮腫、口渇 | 疲労、無力症、歩行障害、胸痛、浮腫 | ||
| 筋骨格系障害 | 関節痛、筋肉痛 | 背部痛、筋痙攣 | 筋痙縮 | |
| その他 | CK増加、LDH増加、ALP増加、血圧低下、起立性低血圧、高血圧、体重減少、転倒 | 呼吸困難 | 細菌感染、尿路感染、血清鉄減少、血圧上昇、DNA抗体陽性、クームス試験陽性、ほてり、発声障害、唾液・痰・口腔内粘膜・便の変色注1) |
12. 臨床検査結果に及ぼす影響
ニトロプルシドナトリウム水和物の検尿テープによる尿検査では、ケトン体反応が偽陽性になる場合がある。また、グルコースオキシダーゼ法を用いた場合、糖尿の検査結果が偽陰性を呈することがある。
13. 過量投与
13.1 症状
急性症状としては激越、錯乱、昏睡、徐脈、心室性頻脈、チェーン・ストークス呼吸、皮膚・舌・結膜の変色、着色尿等が報告されている。また、エンタカポンの過量投与による急性症状としては活動性低下、傾眠、蕁麻疹等が報告されている。なお、過量投与例の最高1日投与量はレボドパでは10,000mg以上(海外)、エンタカポンでは40,000mg以上(海外)であった。
13.2 処置
必要に応じて入院を指示する。また、呼吸器系、循環器系及び腎臓が適切に機能しているか慎重に観察する。不整脈を起こす可能性がある場合は、心電図のモニタリングを実施し、患者を注意深く観察するとともに、必要に応じて適切な抗不整脈治療を行う。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 麦角系ドパミン作動薬(ブロモクリプチン、ペルゴリド等)を併用した患者において、線維性合併症が報告されている。
15.1.2 本剤は起立性低血圧を誘発することがあるので、起立性低血圧を引き起こすおそれのある薬剤(α遮断剤、α・β遮断剤、交感神経末梢遮断剤等)を服用している場合には注意すること。
15.1.3 エンタカポン単剤の国内臨床試験(8週投与)において、エンタカポンはUPDRS(Unified Parkinson’s Disease Rating Scale)PartI(精神機能、行動及び気分)、PartII(日常生活動作)、PartIII(運動能力検査)の改善効果でプラセボ群との間に有意な差は認められなかった。
15.1.4 レボドパは特定のアミノ酸と競合するため、高蛋白食によりレボドパの吸収が低下するとの報告がある。
15.1.5 抗パーキンソン剤はフェノチアジン系化合物、レセルピン誘導体等による口周部等の不随意運動(遅発性ジスキネジア)を通常軽減しない。場合によってはこのような症状を増悪顕性化させることがある。
15.1.6 悪性黒色腫が発現したとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男子に本剤100/10/100mgを空腹時に単回経口投与したとき、血漿中のレボドパは投与後1.3時間で最高濃度に達し、消失半減期は1.5時間であった。血漿中のカルビドパは投与後3時間で最高濃度に達し、消失半減期は1.8時間であった。血漿中のエンタカポンは投与後0.5時間で最高濃度に達し、消失半減期は1.1時間であった3)4)。
健康成人男子に本剤100/10/100mg又は同用量のレボドパ・カルビドパ配合錠及びエンタカポン単剤の併用(標準製剤)を単回経口投与したときのレボドパ、カルビドパ及びエンタカポンの血漿中濃度推移
◆本剤投与時、◇レボドパ・カルビドパ配合錠及びエンタカポン単剤の併用投与時
平均値±標準偏差(n=128)
健康成人男子に本剤100/10/100mg又は同用量のレボドパ・カルビドパ配合錠及びエンタカポン単剤の併用(標準製剤)を単回経口投与したときのレボドパ、カルビドパ及びエンタカポンの薬物動態パラメータ
| 投与製剤(n=128) | Cmax(ng/mL) | Tmax(h) | AUClast(ng・h/mL) | T1/2(h) |
| 本剤 | 1,040±272 | 1.33(0.25〜4) | 2,210±498 | 1.53±0.274 |
| 標準製剤 | 1,120±323 | 0.5(0.25〜4) | 2,150±461 | 1.54±0.204 |
| 投与製剤(n=128) | Cmax(ng/mL) | Tmax(h) | AUClast(ng・h/mL) | T1/2(h) |
| 本剤 | 55.1±20.2 | 3(1.33〜6) | 254±97.2 | 1.80±0.303 |
| 標準製剤 | 56.3±21.2 | 3(1〜5) | 260±98.5 | 1.82±0.283 |
| 投与製剤(n=128) | Cmax(ng/mL) | Tmax(h) | AUClast(ng・h/mL) | T1/2(h) |
| 本剤 | 809±465 | 0.5(0.25〜5) | 976±296 | 1.12±0.987 |
| 標準製剤 | 690±401 | 1.67(0.25〜5) | 912±305 | 1.19±1.19 |
平均値±標準偏差、Tmaxに関しては中央値(最小値〜最大値)
健康成人男子に本剤50/5/100mgを空腹時に単回経口投与したとき、血漿中のレボドパは投与後1.3時間で最高濃度に達し、消失半減期は1.6時間であった。血漿中のカルビドパは投与後3時間で最高濃度に達し、消失半減期は1.9時間であった。血漿中のエンタカポンは投与後1時間で最高濃度に達し、消失半減期は1.4時間であった3)。
健康成人男子に本剤50/5/100mg(2錠)又は同用量のレボドパ・カルビドパ配合錠及びエンタカポン単剤の併用(標準製剤)を単回経口投与したときのレボドパ、カルビドパ及びエンタカポンの薬物動態パラメータ
| 投与製剤(n=64) | Cmax(ng/mL) | Tmax(h) | AUClast(ng・h/mL) | T1/2(h) |
| 本剤 | 895±253 | 1.33(0.25〜4) | 2,195±478 | 1.63±0.269 |
| 標準製剤 | 964±281 | 0.75(0.25〜4) | 2,144±467 | 1.65±0.295 |
| 投与製剤(n=64) | Cmax(ng/mL) | Tmax(h) | AUClast(ng・h/mL) | T1/2(h) |
| 本剤 | 49.6±18.8 | 3(1.33〜5) | 225±87.2 | 1.92±0.546 |
| 標準製剤 | 52.4±19.6 | 3(1.33〜4) | 234±93.8 | 1.87±0.321 |
| 投与製剤(n=64) | Cmax(ng/mL) | Tmax(h) | AUClast(ng・h/mL) | T1/2(h) |
| 本剤 | 1,215±606 | 1(0.25〜5) | 1,828±535 | 1.38±1.09 |
| 標準製剤 | 1,083±520 | 1.67(0.25〜5) | 1,736±480 | 1.26±0.864 |
平均値±標準偏差、Tmaxに関しては中央値(最小値〜最大値)
生物学的同等性
健康成人男子(128例)に本剤100/10/100mg又は同用量のレボドパ・カルビドパ配合錠及びエンタカポン単剤の併用を空腹時に単回経口投与した結果は下表のとおりであった3)4)。
| 測定物質 | 薬物動態パラメータ | 幾何平均比※(90%信頼区間) |
| レボドパ | Cmax | 0.93(0.89〜0.96) |
| AUClast | 1.03(1.01〜1.05) | |
| カルビドパ | Cmax | 0.98(0.95〜1.01) |
| AUClast | 0.97(0.94〜1.00) | |
| エンタカポン | Cmax | 1.17(1.09〜1.26) |
| AUClast | 1.08(1.04〜1.11) |
健康成人男子(64例)に本剤50/5/100mgを2錠又は同用量のレボドパ・カルビドパ配合錠及びエンタカポン単剤の併用を空腹時に単回経口投与した結果は下表のとおりであった3)。
| 測定物質 | 薬物動態パラメータ | 幾何平均比※(90%信頼区間) |
| レボドパ | Cmax | 0.93(0.89〜0.98) |
| AUClast | 1.02(1.00〜1.05) | |
| カルビドパ | Cmax | 0.95(0.90〜1.00) |
| AUClast | 0.96(0.92〜1.02) | |
| エンタカポン | Cmax | 1.12(1.03〜1.23) |
| AUClast | 1.05(1.00〜1.10) |
16.2 吸収
16.2.1 食事の影響
健康成人男子(31例)に本剤100/10/100mgを食後投与したとき、空腹時投与と比較してレボドパのCmax及びAUCはそれぞれ16%及び10%低下、カルビドパのCmax及びAUCはそれぞれ30%及び45%低下、エンタカポンのCmax及びAUCはそれぞれ11%及び8%上昇した3)。
16.3 分布
16.3.1 蛋白結合
16.4 代謝
レボドパの主な代謝経路は、ドパ脱炭酸酵素(DDC)を介したドパミンへの代謝及びCOMTを介した3-O-メチルドパへの代謝であり、最終代謝産物はホモバニリン酸であった7)。
カルビドパの主な代謝経路は、酸化及びメチル化であった2)。
エンタカポンはZ体(in vitro COMT活性阻害作用は未変化体と同程度)への異性化を受ける。日本人健康成人における25〜800mgの単回経口投与においてZ体のCmax及びAUCは未変化体(E体)の3〜8%であった。また、未変化体及びZ体はグルクロン酸抱合を受ける。
ヒト肝ミクロソームを用いたin vitro試験から、エンタカポンはCYP2C9を阻害することが示唆された(IC50は約4μM)。その他のP450アイソザイム(CYP1A2、CYP2A6、CYP2D6、CYP2E1、CYP3A及びCYP2C19)は阻害しない、もしくは、わずかに阻害する程度である8)。[10.参照]
カルビドパの主な代謝経路は、酸化及びメチル化であった2)。
エンタカポンはZ体(in vitro COMT活性阻害作用は未変化体と同程度)への異性化を受ける。日本人健康成人における25〜800mgの単回経口投与においてZ体のCmax及びAUCは未変化体(E体)の3〜8%であった。また、未変化体及びZ体はグルクロン酸抱合を受ける。
ヒト肝ミクロソームを用いたin vitro試験から、エンタカポンはCYP2C9を阻害することが示唆された(IC50は約4μM)。その他のP450アイソザイム(CYP1A2、CYP2A6、CYP2D6、CYP2E1、CYP3A及びCYP2C19)は阻害しない、もしくは、わずかに阻害する程度である8)。[10.参照]
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
国内では、本剤のパーキンソン病患者を対象とした臨床試験は行っていない。レボドパ・カルビドパあるいはレボドパ・ベンセラジド配合錠と併用時のエンタカポン単剤の臨床試験結果が参照可能である。
17.1.1 国内第II相臨床試験
エンタカポン単剤の承認時までに実施した二重盲検比較試験(国内CCOM998A1203試験)
Wearing-off現象を有するパーキンソン病患者341例を対象とした二重盲検比較試験において、レボドパ・カルビドパあるいはレボドパ・ベンセラジド配合錠にエンタカポン単剤1回100mg及び1回200mgを併用した群はいずれも、プラセボを併用した群と比較し、症状日誌に基づく起きている間のON時間(動きやすい・動けると感じる時間:レボドパ薬効発現時間)を有意に延長させた10)。
副作用発現頻度は、エンタカポン100mg投与群で52.2%(59/113例)及びエンタカポン200mg投与群で72.8%(83/114例)であった。主な副作用は、エンタカポン100mg群で着色尿15.9%(18/113例)、ジスキネジー増悪14.2%(16/113例)、便秘増悪10.6%(12/113例)、エンタカポン200mg群でジスキネジー増悪21.1%(24/114例)、着色尿14.9%(17/114例)、便秘増悪12.3%(14/114例)であった。
副作用発現頻度は、エンタカポン100mg投与群で52.2%(59/113例)及びエンタカポン200mg投与群で72.8%(83/114例)であった。主な副作用は、エンタカポン100mg群で着色尿15.9%(18/113例)、ジスキネジー増悪14.2%(16/113例)、便秘増悪10.6%(12/113例)、エンタカポン200mg群でジスキネジー増悪21.1%(24/114例)、着色尿14.9%(17/114例)、便秘増悪12.3%(14/114例)であった。
日本人患者に経口投与後のON時間の観察期からの変化(平均値±標準誤差)
| プラセボ併用群(n=95) | エンタカポン100mg併用群(n=98) | エンタカポン200mg併用群(n=88) | ||
| ON時間(時間) | ||||
| 観察期 | 平均値±標準偏差 | 8.2±2.0 | 8.1±2.1 | 8.3±2.2 |
| 最終評価時 | 平均値±標準偏差 | 8.7±2.6 | 9.4±2.7 | 9.7±2.8 |
| 変化量(最終評価時−観察期) | 平均値±標準誤差 | 0.5±0.2 | 1.4±0.3 | 1.4±0.2 |
| 変化量の群間比較[95%信頼区間] 検定結果(分散分析) | エンタカポン群−プラセボ群 | − | 0.8498[0.1989;1.5007] P=0.0107 | 0.8575[0.1886;1.5263] P=0.0122 |
| エンタカポン200mg群−100mg群 | − | − | 0.0077[−0.6563;0.6716] P=0.9819 | |
18. 薬効薬理
18.1 作用機序
パーキンソン病におけるレボドパ補充療法では、投与されたレボドパは血液脳関門を通過して脳内でドパミンとなり、パーキンソニズムの諸症状を緩解する。レボドパは末梢でDDC及びCOMTにより大部分が代謝されるため、代謝酵素阻害剤を併用しない場合脳内に取り込まれるレボドパ量はごくわずかである。
カルビドパは末梢性のDDC阻害剤であり、エンタカポンは、末梢でCOMTを選択的に阻害することから、レボドパ・カルビドパ・エンタカポンを配合した本剤は、末梢においてDDC及びCOMTの両方を阻害することでレボドパの脳内移行をより効率化し、レボドパの生物学的利用率を増大させる。
カルビドパは末梢性のDDC阻害剤であり、エンタカポンは、末梢でCOMTを選択的に阻害することから、レボドパ・カルビドパ・エンタカポンを配合した本剤は、末梢においてDDC及びCOMTの両方を阻害することでレボドパの脳内移行をより効率化し、レボドパの生物学的利用率を増大させる。
18.2 パーキンソン病モデルにおけるエンタカポン投与によるレボドパ・カルビドパ作用の増強効果
19. 有効成分に関する理化学的知見
19.1. レボドパ
19.2. カルビドパ水和物
19.3. エンタカポン
22. 包装
<スタレボ配合錠L50>
100錠[10錠(PTP)×10]
<スタレボ配合錠L100>
100錠[10錠(PTP)×10]
23. 主要文献
- Thulin,PC.et al., Neurology, 50 (6), 1920-1921, (1998) »PubMed
- Vickers,S.et al., Drug Metab.Dispos., 2 (1), 9-22, (1974) »PubMed
- 社内資料:レボドパ・カルビドパ・エンタカポン配合剤の生物学的同等性及び食事の影響試験成績
- 社内資料:レボドパ・カルビドパ・エンタカポン配合剤の生物学的同等性試験成績
- Rizzo,V.et al., J.Pharm.Biomed.Anal., 14 (8-10), 1043-1046, (1996) »PubMed
- 社内資料:血漿蛋白結合率(コムタン錠2007年1月26日承認、CTD2.6.4.4(3))
- Cedarbaum,J.M., Clin.Pharmacokinet., 13 (3), 141-178, (1987) »PubMed
- 社内資料:チトクロームP450分子種活性への影響(コムタン錠2007年1月26日承認、CTD2.6.4.5(4))
- 社内資料:健康成人における臨床第I相試験(単回経口投与)(コムタン錠2007年1月26日承認、CTD2.7.6.3.1)
- Mizuno,Y.et al., Mov.Disord., 22 (1), 75-80, (2007) »PubMed
- 社内資料:エンタカポンのレセルピン処置マウスの運動活性に対する作用(コムタン錠2007年1月26日承認、CTD2.6.2.2(5)1))
- 社内資料:エンタカポンの片側ドパミン神経破壊ラットの回転行動に対する作用(コムタン錠2007年1月26日承認、CTD2.6.2.2(5)2))
- 社内資料:エンタカポンの片側ドパミン神経破壊ラットの回転行動に対するレボドパ節減効果(コムタン錠2007年1月26日承認、CTD2.6.2.2(5)2))
- 社内資料:エンタカポンのMPTP処置マーモセットの運動活性及び運動機能障害に対する作用(コムタン錠2007年1月26日承認、CTD2.6.2.2(5)3))
24. 文献請求先及び問い合わせ先
文献請求先
オリオンファーマ
コールセンター
電話:0120-8686-37 受付時間 9:00〜17:30(土日、祝日、その他当社休業日を除く)
製品情報問い合わせ先
オリオンファーマ
コールセンター
電話:0120-8686-37 受付時間 9:00〜17:30(土日、祝日、その他当社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
オリオンファーマ・ジャパン株式会社
〒100-0004
東京都千代田区大手町1-6-1 大手町ビルSPACES大手町