医薬品情報
| 総称名 | リクシアナ |
|---|---|
| 一般名 | エドキサバントシル酸塩水和物 |
| 欧文一般名 | Edoxaban Tosilate Hydrate |
| 製剤名 | エドキサバントシル酸塩水和物錠 |
| 薬効分類名 | 経口FXa阻害剤 |
| 薬効分類番号 | 3339 |
| ATCコード | B01AF03 |
| KEGG DRUG |
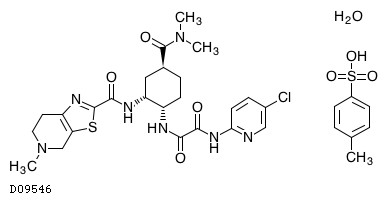
D09546
エドキサバントシル酸塩水和物
|
| KEGG DGROUP |
DG03320
直接経口抗凝固薬 (DOAC)
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年11月 改訂(第8版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リクシアナ錠15mg | LIXIANA TABLETS | 第一三共 | 3339002F1020 | 224.7円/錠 | 処方箋医薬品注) |
| リクシアナ錠30mg | LIXIANA TABLETS | 第一三共 | 3339002F2026 | 411.3円/錠 | 処方箋医薬品注) |
| リクシアナ錠60mg | LIXIANA TABLETS | 第一三共 | 3339002F3022 | 416.8円/錠 | 処方箋医薬品注) |
1. 警告
1.1 本剤の投与により出血が発現し、重篤な出血の場合には、死亡に至るおそれがある。本剤の使用にあたっては、出血の危険性を考慮し、本剤投与の適否を慎重に判断すること。本剤による出血リスクを正確に評価できる指標は確立されていないため、本剤投与中は、血液凝固に関する検査値のみならず、出血や貧血等の徴候を十分に観察すること。これらの徴候が認められた場合には、直ちに適切な処置を行うこと。[2.2、2.4-2.6、7.3、7.6、8.2、8.3、8.6、8.7、8.9、9.1.1、9.1.2、9.2.1-9.2.3、9.3.1、9.3.2参照]
1.2 脊椎・硬膜外麻酔あるいは腰椎穿刺等との併用により、穿刺部位に血腫が生じ、神経の圧迫による麻痺があらわれるおそれがある。併用する場合には神経障害の徴候及び症状について十分注意し、異常が認められた場合には直ちに適切な処置を行うこと。[7.7参照]
2. 禁忌
次の患者には投与しないこと
<効能共通>
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 出血している患者(頭蓋内出血、後腹膜出血又は他の重要器官における出血等)[出血を助長するおそれがある。][1.1参照]
2.3 急性細菌性心内膜炎の患者[血栓剥離に伴う血栓塞栓様症状を呈するおそれがある。]
<非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制、静脈血栓塞栓症の治療及び再発抑制、慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制>
<下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制>
4. 効能または効果
リクシアナ錠15mg
○非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制
○静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制
○慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制
○下記の下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制
膝関節全置換術、股関節全置換術、股関節骨折手術
リクシアナ錠30mg
○非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制
○静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制
○慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制
○下記の下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制
膝関節全置換術、股関節全置換術、股関節骨折手術
リクシアナ錠60mg
○非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制
○静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制
○慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制
5. 効能または効果に関連する注意
<効能共通>
5.1 <参考>
| 効能又は効果 | 錠15mg | 錠30mg | 錠60mg |
| 非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制 | ○注1)、注2) | ○ | ○ |
| 静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制 | ○注2) | ○ | ○ |
| 慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制 | ○注2) | ○ | ○ |
| 下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制 | ○ | ○ | − |
<静脈血栓塞栓症の治療及び再発抑制>
5.2 ショックや低血圧が遷延するような血行動態が不安定な患者又は血栓溶解剤の使用や血栓摘除術が必要な患者では、本剤は血行動態安定後に投与すること。有効性及び安全性は確立していない。
<慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制>
5.4 肺高血圧症のWHO機能分類クラスIII及びIVにおける有効性及び安全性は確立していない。
5.5 「17.臨床成績」の項の内容を熟知し、臨床試験に組み入れられた患者の背景(前治療等)を十分に理解した上で、適応患者を選択すること。[17.1.4参照]
5.6 慢性血栓塞栓性肺高血圧症の治療に十分な知識及び経験を有する医師のもとで、本剤の投与が適切と判断される患者に対して適用すること。
6. 用法及び用量
リクシアナ錠15mg
<非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制>
通常、成人には、エドキサバンとして以下の用量を1日1回経口投与する。
体重60kg以下:30mg
体重60kg超:60mg なお、腎機能、併用薬に応じて1日1回30mgに減量する。
また、出血リスクが高い高齢の患者では、年齢、患者の状態に応じて1日1回15mgに減量できる。
<静脈血栓塞栓症の治療及び再発抑制、慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制>
通常、成人には、エドキサバンとして以下の用量を1日1回経口投与する。
体重60kg以下:30mg
体重60kg超:60mg なお、腎機能、併用薬に応じて1日1回30mgに減量する。
<下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制>
通常、成人には、エドキサバンとして30mgを1日1回経口投与する。
リクシアナ錠30mg
<非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制>
通常、成人には、エドキサバンとして以下の用量を1日1回経口投与する。
体重60kg以下:30mg
体重60kg超:60mg なお、腎機能、併用薬に応じて1日1回30mgに減量する。
また、出血リスクが高い高齢の患者では、年齢、患者の状態に応じて1日1回15mgに減量できる。
<静脈血栓塞栓症の治療及び再発抑制、慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制>
通常、成人には、エドキサバンとして以下の用量を1日1回経口投与する。
体重60kg以下:30mg
体重60kg超:60mg なお、腎機能、併用薬に応じて1日1回30mgに減量する。
<下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制>
通常、成人には、エドキサバンとして30mgを1日1回経口投与する。
リクシアナ錠60mg
<非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制>
通常、成人には、エドキサバンとして以下の用量を1日1回経口投与する。
体重60kg以下:30mg
体重60kg超:60mg なお、腎機能、併用薬に応じて1日1回30mgに減量する。
また、出血リスクが高い高齢の患者では、年齢、患者の状態に応じて1日1回15mgに減量できる。
<静脈血栓塞栓症の治療及び再発抑制、慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制>
通常、成人には、エドキサバンとして以下の用量を1日1回経口投与する。
体重60kg以下:30mg
体重60kg超:60mg なお、腎機能、併用薬に応じて1日1回30mgに減量する。
7. 用法及び用量に関連する注意
リクシアナ錠15mg
<非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制、静脈血栓塞栓症の治療及び再発抑制、慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制>
7.1 腎機能障害のある患者では、腎機能に応じて次のように投与すること。[9.2.1、16.6.2、16.6.3、17.1.1、17.1.3、17.1.4参照]
| クレアチニンクリアランス(CLcr)値(mL/min) | 投与法 |
| 30≦CLcr≦50 | 30mgを1日1回経口投与すること。 |
| 15≦CLcr<30 | 有効性及び安全性は確立していないので、本剤投与の適否を慎重に判断すること。投与する場合は30mgを1日1回経口投与すること注)。 |
7.2 P糖蛋白阻害作用を有する薬剤を併用する場合には、併用薬に応じて次のように投与すること。[10.2、16.7.2-16.7.7、17.1.1、17.1.3、17.1.4参照]
| 併用薬 | 投与法 |
| キニジン硫酸塩水和物、ベラパミル塩酸塩、エリスロマイシン、シクロスポリン | 併用する場合には、本剤30mgを1日1回経口投与すること。 |
| アジスロマイシン、クラリスロマイシン、イトラコナゾール、ジルチアゼム、アミオダロン塩酸塩、HIVプロテアーゼ阻害剤(リトナビル等)等 | 治療上の有益性と危険性を十分に考慮し、本剤との併用が適切と判断される患者にのみ併用すること。併用する場合には、本剤30mgを1日1回経口投与することを考慮すること。 |
<非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制>
7.3 高齢の患者(80歳以上を目安とする)で、以下のいずれも満たす場合、治療上の有益性と出血リスクを考慮して本剤投与の適否を慎重に判断し、投与する場合には本剤15mgを1日1回経口投与することを考慮すること。[1.1、5.1、7.1、9.1.1、9.1.2、9.8.2、10.2、17.1.2参照]
●次の出血性素因を1つ以上有する。
・頭蓋内、眼内、消化管等重要器官での出血の既往
・低体重(45kg以下)
・クレアチニンクリアランス15mL/min以上30mL/min未満
・非ステロイド性消炎鎮痛剤の常用
・抗血小板剤の使用
●本剤の通常用量又は他の経口抗凝固剤の承認用量では出血リスクのため投与できない。
<下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制>
7.4 クレアチニンクリアランス30mL/min以上50mL/min未満の患者では、個々の患者の静脈血栓塞栓症発現リスク及び出血リスクを評価した上で、15mg1日1回に減量することを考慮すること。[9.2.1、16.6.2参照]
7.6 本剤の初回投与は、手術後12時間を経過し、手術創等からの出血がないことを確認してから行うこと。[1.1参照]
7.7 本剤の初回投与は、硬膜外カテーテル抜去あるいは腰椎穿刺から少なくとも2時間を経過してから行うこと。また、初回投与以降にこれらの処置を行う場合には、前回投与から12時間以上の十分な時間を空け、かつ、予定している次回の投与の少なくとも2時間以上前に実施すること。[1.2参照]
リクシアナ錠30mg
<非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制、静脈血栓塞栓症の治療及び再発抑制、慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制>
7.1 腎機能障害のある患者では、腎機能に応じて次のように投与すること。[9.2.1、16.6.2、16.6.3、17.1.1、17.1.3、17.1.4参照]
| クレアチニンクリアランス(CLcr)値(mL/min) | 投与法 |
| 30≦CLcr≦50 | 30mgを1日1回経口投与すること。 |
| 15≦CLcr<30 | 有効性及び安全性は確立していないので、本剤投与の適否を慎重に判断すること。投与する場合は30mgを1日1回経口投与すること注)。 |
7.2 P糖蛋白阻害作用を有する薬剤を併用する場合には、併用薬に応じて次のように投与すること。[10.2、16.7.2-16.7.7、17.1.1、17.1.3、17.1.4参照]
| 併用薬 | 投与法 |
| キニジン硫酸塩水和物、ベラパミル塩酸塩、エリスロマイシン、シクロスポリン | 併用する場合には、本剤30mgを1日1回経口投与すること。 |
| アジスロマイシン、クラリスロマイシン、イトラコナゾール、ジルチアゼム、アミオダロン塩酸塩、HIVプロテアーゼ阻害剤(リトナビル等)等 | 治療上の有益性と危険性を十分に考慮し、本剤との併用が適切と判断される患者にのみ併用すること。併用する場合には、本剤30mgを1日1回経口投与することを考慮すること。 |
<非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制>
7.3 高齢の患者(80歳以上を目安とする)で、以下のいずれも満たす場合、治療上の有益性と出血リスクを考慮して本剤投与の適否を慎重に判断し、投与する場合には本剤15mgを1日1回経口投与することを考慮すること。[1.1、5.1、7.1、9.1.1、9.1.2、9.8.2、10.2、17.1.2参照]
●次の出血性素因を1つ以上有する。
・頭蓋内、眼内、消化管等重要器官での出血の既往
・低体重(45kg以下)
・クレアチニンクリアランス15mL/min以上30mL/min未満
・非ステロイド性消炎鎮痛剤の常用
・抗血小板剤の使用
●本剤の通常用量又は他の経口抗凝固剤の承認用量では出血リスクのため投与できない。
<下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制>
7.4 クレアチニンクリアランス30mL/min以上50mL/min未満の患者では、個々の患者の静脈血栓塞栓症発現リスク及び出血リスクを評価した上で、15mg1日1回に減量することを考慮すること。[9.2.1、16.6.2参照]
7.6 本剤の初回投与は、手術後12時間を経過し、手術創等からの出血がないことを確認してから行うこと。[1.1参照]
7.7 本剤の初回投与は、硬膜外カテーテル抜去あるいは腰椎穿刺から少なくとも2時間を経過してから行うこと。また、初回投与以降にこれらの処置を行う場合には、前回投与から12時間以上の十分な時間を空け、かつ、予定している次回の投与の少なくとも2時間以上前に実施すること。[1.2参照]
リクシアナ錠60mg
<非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制、静脈血栓塞栓症の治療及び再発抑制、慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制>
7.1 腎機能障害のある患者では、腎機能に応じて次のように投与すること。[9.2.1、16.6.2、16.6.3、17.1.1、17.1.3、17.1.4参照]
| クレアチニンクリアランス(CLcr)値(mL/min) | 投与法 |
| 30≦CLcr≦50 | 30mgを1日1回経口投与すること。 |
| 15≦CLcr<30 | 有効性及び安全性は確立していないので、本剤投与の適否を慎重に判断すること。投与する場合は30mgを1日1回経口投与すること注)。 |
7.2 P糖蛋白阻害作用を有する薬剤を併用する場合には、併用薬に応じて次のように投与すること。[10.2、16.7.2-16.7.7、17.1.1、17.1.3、17.1.4参照]
| 併用薬 | 投与法 |
| キニジン硫酸塩水和物、ベラパミル塩酸塩、エリスロマイシン、シクロスポリン | 併用する場合には、本剤30mgを1日1回経口投与すること。 |
| アジスロマイシン、クラリスロマイシン、イトラコナゾール、ジルチアゼム、アミオダロン塩酸塩、HIVプロテアーゼ阻害剤(リトナビル等)等 | 治療上の有益性と危険性を十分に考慮し、本剤との併用が適切と判断される患者にのみ併用すること。併用する場合には、本剤30mgを1日1回経口投与することを考慮すること。 |
<非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制>
7.3 高齢の患者(80歳以上を目安とする)で、以下のいずれも満たす場合、治療上の有益性と出血リスクを考慮して本剤投与の適否を慎重に判断し、投与する場合には本剤15mgを1日1回経口投与することを考慮すること。[1.1、5.1、7.1、9.1.1、9.1.2、9.8.2、10.2、17.1.2参照]
●次の出血性素因を1つ以上有する。
・頭蓋内、眼内、消化管等重要器官での出血の既往
・低体重(45kg以下)
・クレアチニンクリアランス15mL/min以上30mL/min未満
・非ステロイド性消炎鎮痛剤の常用
・抗血小板剤の使用
●本剤の通常用量又は他の経口抗凝固剤の承認用量では出血リスクのため投与できない。
8. 重要な基本的注意
<効能共通>
8.1 プロトロンビン時間−国際標準比(PT-INR)や活性化部分トロンボプラスチン時間(APTT)等の通常の凝固能検査は、本剤の薬効をモニタリングする指標とはならないので、臨床症状を十分に観察すること。
8.3 患者には、鼻出血、皮下出血、歯肉出血、血尿、喀血、吐血及び血便等、異常な出血の徴候が認められた場合、医師に連絡するよう指導すること。[1.1参照]
8.4 患者の判断で本剤の服用を中止することのないよう十分な服薬指導をすること。服用を忘れた場合は、一度に2回分を服用せず、直ちに本剤を1回分服用し、次の服用まで12時間以上空けるよう、患者に指導すること。
8.5 本剤と他の抗凝固剤との切り替えの際は、次の事項に留意すること。
8.5.1 ワルファリンから本剤に切り替える場合は、ワルファリンの投与を中止した後、PT-INR等、血液凝固能検査を実施し、治療域の下限以下になったことを確認した後、可及的速やかに本剤の投与を開始すること。[5.3参照]
8.5.2 未分画ヘパリンから本剤へ切り替える場合は、持続静注中止4±1時間後に本剤の投与を開始すること。[5.3参照]
8.5.3 他の抗凝固剤(ワルファリン及び未分画ヘパリン以外)から本剤へ切り替える場合は、次回の投与が予定される時間から本剤の投与を開始すること。健康成人にリバーロキサバン又はアピキサバンを3日間投与後、本剤単回投与に切り替えたときのプロトロンビン時間(PT)、APTT又は抗FXa活性への影響は、本剤反復投与4日目と同程度であった。同様に、ダビガトランから本剤に切り替えたときのAPTTは、ダビガトラン反復投与3日目と同程度であった。[5.3参照]
8.5.4 本剤からワルファリンに切り替える場合は、抗凝固作用が維持されるよう注意し、PT-INRが治療域の下限を超えるまでは、本剤30mgを投与している患者では15mg1日1回とワルファリン、60mgを投与している患者では30mg1日1回とワルファリンを併用投与すること。もしくは、本剤の投与終了後、PT-INRが治療域の下限を超えるまでは、ワルファリンと非経口抗凝固剤(ヘパリン等)を併用投与すること。なお、本剤の投与終了後24時間を経過するまでは、PT-INRはワルファリンの抗凝固作用を正確に反映しないため、PT-INRは本剤の次回投与直前に測定する必要がある。[5.1、17.1.1、17.1.3、17.1.4参照]
8.5.5 本剤からワルファリン以外の他の抗凝固剤に切り替える場合は、本剤の投与を中止し、次回の本剤投与が予定される時間に抗凝固剤の投与を開始すること。
8.6 本剤の投与中に手術や侵襲的処置を行う場合、本剤の投与後24時間以上経過した後に行うことが望ましい。手術や侵襲的処置の開始を遅らせることができない場合は、緊急性と出血リスクを評価すること。本剤の投与再開は、手術や侵襲的処置後、患者の臨床状態に問題がなく出血がないことを確認してから、可及的速やかに行うこと。なお、必要に応じて代替療法(ヘパリン等)の使用を考慮すること。[1.1参照]
8.7 本剤投与中の患者で生命を脅かす出血又は止血困難な出血の発現時に本剤の抗凝固作用の中和を必要とする場合には、中和剤であるアンデキサネット アルファ(遺伝子組換え)の電子添文を必ず参照し、「2.禁忌」「7.用法及び用量に関連する注意」「8.重要な基本的注意」「9.特定の背景を有する患者に関する注意」「11.副作用」等の使用上の注意の記載を確認すること。[1.1参照]
<下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制>
8.8 原則として、術後の入院中に限って使用すること。
8.9 本剤の投与期間については、患者個々の静脈血栓塞栓症及び出血のリスクを考慮して決定すべきであり、静脈血栓塞栓症のリスク低下後に漫然と継続投与しないこと。なお、国内臨床試験において、下肢整形外科手術施行患者を対象として15日間以上投与した場合の有効性及び安全性は検討されていない。[1.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 出血する可能性が高い患者
9.1.2 低体重の患者
9.2 腎機能障害患者
<効能共通>
<非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制、静脈血栓塞栓症の治療及び再発抑制、慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制>
<下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制>
9.3 肝機能障害患者
<効能共通>
9.3.1 高度の肝機能障害のある患者
凝固因子の産生が低下していることがあり、出血の危険性が増大するおそれがある。[1.1参照]
<非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制、静脈血栓塞栓症の治療及び再発抑制、慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制>
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で胎児への移行が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
動物実験(ラット)で乳汁中に移行することが報告されている。
動物実験(ラット)で乳汁中に移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
<効能共通>
9.8.1 患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
<非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制>
9.8.2 高齢(80歳以上を目安とする)で出血リスクが高い場合には、必要に応じて減量を考慮すること。出血の危険性が増大するおそれがある。[7.3参照]
10. 相互作用
相互作用序文
本剤はP糖蛋白の基質である。
薬物代謝酵素用語
P糖蛋白
10.2 併用注意
| 抗凝固剤 ヘパリンナトリウム、ワルファリンカリウム、エノキサパリンナトリウム、フォンダパリヌクスナトリウム、ダビガトランエテキシラートメタンスルホン酸塩等 [16.7.10参照] | これらの薬剤との併用により、出血の危険性を増大させるおそれがある。 | 相互に抗血栓作用を増強することが考えられる。 |
| 血栓溶解剤 ウロキナーゼ、t-PA製剤等 | これらの薬剤との併用により、出血の危険性を増大させるおそれがある。 | 相互に抗血栓作用を増強することが考えられる。 |
| 血小板凝集抑制作用を有する薬剤 アスピリン、ジピリダモール、チクロピジン塩酸塩、クロピドグレル硫酸塩等 [7.3、16.7.9参照] | これらの薬剤との併用により、出血の危険性を増大させるおそれがある。併用については、治療上の有益性と危険性を考慮して慎重に判断すること。抗血小板剤2剤との併用時には、出血リスクが特に増大するおそれがあるため、本剤との併用についてはさらに慎重に検討し、治療上の有益性が危険性を上回ると判断された場合のみ、これらの薬剤と併用すること。 | 相互に抗血栓作用を増強することが考えられる。 |
| 非ステロイド性消炎鎮痛剤 ジクロフェナクナトリウム、ナプロキセン等 [7.3参照] | <効能共通> これらの薬剤との併用により、出血の危険性を増大させるおそれがある。 <非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制、静脈血栓塞栓症の治療及び再発抑制、慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制> これらの薬剤と本剤の併用については、治療上の有益性と危険性を考慮して慎重に判断すること。 | 相互に抗血栓作用を増強することが考えられる。 |
| 選択的セロトニン再取り込み阻害剤 セロトニン・ノルアドレナリン再取り込み阻害剤 | これらの薬剤との併用により、出血の危険性を増大させるおそれがある。 | 相互に抗血栓作用を増強することが考えられる。 |
| P糖蛋白阻害作用を有する薬剤 キニジン硫酸塩水和物、ベラパミル塩酸塩、エリスロマイシン、シクロスポリン、アジスロマイシン、クラリスロマイシン、イトラコナゾール、ジルチアゼム、アミオダロン塩酸塩、HIVプロテアーゼ阻害剤(リトナビル等)等 [7.2、7.5、16.7.2-16.7.7参照] | 本剤の血中濃度を上昇させ、出血の危険性を増大させるおそれがある。 | P糖蛋白を阻害することにより、本剤のバイオアベイラビリティを上昇させると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 出血
消化管出血(1.3%)、頭蓋内出血(0.3%)、眼内出血(0.2%)、創傷出血(0.1%未満)、後腹膜出血(頻度不明)、脾破裂に至る脾臓出血(頻度不明)等の重大な出血があらゆる組織及び器官に生じることがあり、死亡に至った症例も報告されている。臨床的に問題となる出血又は出血の増悪がみられた場合には投与を中止すること。[8.2参照]
11.1.2 急性腎障害(頻度不明)
11.1.3 肝機能障害(頻度不明)、黄疸(頻度不明)
AST、ALTの上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.1.4 間質性肺疾患(頻度不明)
血痰、肺胞出血を伴う場合もある。咳嗽、息切れ、呼吸困難、発熱、肺音の異常等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施すること。間質性肺疾患が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.5 血小板減少症(頻度不明)[8.2参照]
11.2 その他の副作用
| 1〜10%未満 | 1%未満 | 頻度不明 | |
| 血液 | 貧血 | 血小板数増加、好酸球増多 | |
| 出血傾向 | 鼻出血、血尿(尿中血陽性等)、皮下出血、挫傷、創傷出血 | 月経過多、関節内血腫 | |
| 肝臓 | 肝機能異常 | γ-GTP上昇、ALT上昇、ビリルビン上昇、AST上昇、ALP上昇、LDH上昇 | |
| 精神神経系 | 頭痛 | 浮動性めまい | |
| 消化器 | 下痢 | 悪心、腹痛 | |
| 過敏症 | 発疹、そう痒 | 血管性浮腫、蕁麻疹 | |
| その他 | 浮腫、尿酸上昇、トリグリセリド上昇、発熱 |
13. 過量投与
13.1 症状
本剤を過量投与した場合、出血性の合併症を引き起こすおそれがある。
13.2 処置
本剤は血液透析により除去されにくい3)。症状に応じて、外科的止血、血液製剤(濃厚赤血球輸血、新鮮凍結血漿輸注)等の適切な治療の開始を検討すること。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
海外において実施された3抗体(ループスアンチコアグラント、抗カルジオリピン抗体、抗β2グリコプロテインI抗体)のいずれもが陽性で、血栓症の既往がある抗リン脂質抗体症候群患者を対象とした直接作用型経口抗凝固薬(リバーロキサバン)とワルファリンの非盲検無作為化試験において、血栓塞栓性イベントの再発が、ワルファリン群61例では認められなかったのに対し、リバーロキサバン群では59例中7例に認められたとの報告がある4)。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性にエドキサバン30mgを空腹時単回経口投与したときの血漿中濃度推移及び薬物動態パラメータは次のとおりであった。また、食後に投与したときCmaxは13%上昇したが、AUCに影響は認められなかった5)。
エドキサバン単回経口投与時の血漿中濃度推移(空腹時)
(平均値±標準偏差、n=34)
| 投与量 | n | Cmax(ng/mL) | Tmaxa)(h) | t1/2(h) | AUC0-24h(ng・h/mL) |
| 30mg | 34 | 218.9(34.1) | 1.0(0.5〜3.0) | 4.9(19.2) | 1,187.0(21.7) |
健康成人39例にエドキサバン30〜150mg注)を単回経口投与したとき、Cmax及びAUCは概ね投与量に比例して上昇した。
投与後72時間までの血漿中濃度データに基づくt1/2は10〜14時間であった(外国人データ)。
投与後72時間までの血漿中濃度データに基づくt1/2は10〜14時間であった(外国人データ)。
16.1.2 反復投与
健康成人男性9例にエドキサバン120mg注)を8日間反復経口投与したとき、蓄積性は認められなかった6)。
16.2 吸収
健康成人35例にエドキサバン60mgを経口投与した際の絶対的バイオアベイラビリティは61.8%であった(外国人データ)。
16.3 分布
16.3.1 蛋白結合率
健康成人男性18例にエドキサバン90mg及び120mg注)を単回経口投与したとき、投与2、6及び12時間後のex vivo血漿蛋白結合率は40.0〜58.9%であった(外国人データ)。
16.3.2 分布容積
健康成人男性35例にエドキサバン30mgを単回静脈内投与したとき、本剤の分布容積は107Lであった(外国人データ)。
16.4 代謝
エドキサバンはカルボキシエステラーゼ1による加水分解、抱合及びCYP3A4による代謝を受け、CYP3A4による代謝は投与量の10%未満であった(外国人データ)。
16.5 排泄
健康成人男性35例にエドキサバン30mgを単回静脈内投与したとき、全身クリアランスは21.8L/hであり、その約50%(10.7L/h)が腎クリアランスであった。健康成人男性6例にエドキサバン60mgを単回経口投与したマスバランス試験において、投与後168時間までに投与された放射能の35.4%及び62.2%が、それぞれ尿中及び糞中へ排泄され、その大部分(それぞれ23.8%、49.1%)はエドキサバンであった。血漿中にも主にエドキサバンとして存在した(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 高齢者
健康高齢男性4例にエドキサバン90mg注)を1日1回8日間反復経口投与したとき、健康成人男性と比較しAUCtauは33%高値を示した(外国人データ)。
16.6.2 腎機能障害患者
腎機能障害患者24例にエドキサバン15mgを単回経口投与したとき、クレアチニンクリアランス(CLcr)の低下に伴いt1/2の遅延とAUC0-infの上昇が認められた7)(外国人データ)。[7.1、7.4参照]
| パラメータ | 腎機能障害程度(CLcr:mL/min) | ||||
| CLcr>80 | 80≧CLcr≧50 (軽度) | 50>CLcr≧30 (中等度) | 30>CLcr (高度) | 腹膜透析 | |
| Cmax(ng/mL) | 81.2(31.7) | 104(46.7) | 108(38.5) | 87.4(34.1) | 91.7(57.0) |
| C24h(ng/mL) | 2.34(28.1) | 3.44(62.5) | 5.90(38.4) | 6.88(36.2) | 8.24(53.9) |
| AUC0-inf(ng・h/mL) | 443(22.3) | 620(24.5) | 794(25.6) | 835(25.1) | 963(42.5) |
| t1/2a)(h) | 8.60(3.83) | 8.15(2.82) | 9.44(2.12) | 16.9(10.4) | 12.2(5.29) |
| CL/F(mL/min) | 564(22.3) | 403(24.5) | 315(25.6) | 299(25.1) | 260(42.5) |
| CLR(mL/min) | 197(16.5) | 121(37.8) | 67.4b)(37.8) | 32.5(49.3) | − |
16.6.3 高度腎機能障害患者
16.6.4 肝機能障害患者
軽度及び中等度の肝機能障害患者16例にエドキサバン15mgを単回経口投与したとき、健康成人と比較し薬物動態に大きな差異は認められなかった9)(外国人データ)。
16.7 薬物相互作用
エドキサバンは臨床用量で想定される血漿中濃度で主要なヒトCYP分子種を阻害あるいは誘導しなかった。エドキサバンはP糖蛋白の基質であることが示唆された。(in vitro試験データ)
16.7.1 ジゴキシン
ジゴキシン(0.25mg/日)とエドキサバン(60mg/日)を併用したとき、ジゴキシン及びエドキサバンの薬物動態への影響はわずかであった(外国人データ)。
16.7.2 ケトコナゾール
16.7.3 キニジン
16.7.4 ベラパミル
16.7.5 エリスロマイシン
16.7.6 シクロスポリン
16.7.7 アミオダロン
16.7.8 リファンピシン
リファンピシン(600mg/日)とエドキサバン60mgを併用したとき、エドキサバンのAUCは約34%低下したが、PT及びAPTTには影響が認められなかった(外国人データ)。
16.7.9 アスピリン
アスピリン(100mg/日あるいは325mg/日)とエドキサバン60mgを併用したとき、単独投与時に比べて出血時間が1.3〜1.6倍に延長した(外国人データ)。[10.2参照]
16.7.10 ワルファリンナトリウム
ワルファリンナトリウム(国内未承認)を反復経口投与しPT-INRが2.0〜3.0となるように調整後、ワルファリン最終投与の24時間後にエドキサバン60mg1日1回投与に切り替えたとき、エドキサバン投与1時間後にPT-INRは投与前の2.31(算術平均)から3.83まで上昇したが、24時間後にはプラセボ群と同程度(1.81)まで低下した。なお、薬物動態学的な相互作用は認められなかった(外国人データ)。[10.2参照]
注)本剤の承認用量は15mg、30mg及び60mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制>
17.1.1 国際共同第III相試験
日本を含む国際共同第III相二重盲検試験において、心房細動患者(有効性評価21,105例、安全性評価21,026例)に、エドキサバン30mg(低用量群、減量基準注)を満たす患者では15mg)又は60mg(高用量群、減量基準注)を満たす患者では30mg)、もしくは対照薬としたワルファリンナトリウムを1日1回経口投与した。観察期間の中央値は2.8年であった。主要評価項目とした脳卒中又は全身性塞栓症の発現率について、対照薬群に対する各エドキサバン群の非劣性が検証された10)。
| エンドポイント | イベント発現例数/被験者数 (年間発現率) | ||
| ワルファリン群に対するハザード比 (信頼区間) | |||
| エドキサバン低用量群注1) | エドキサバン高用量群 | ワルファリン群 | |
| 脳卒中又は全身性塞栓症注2) | 253/7,002 (1.61%) | 182/7,012 (1.18%) | 232/7,012 (1.50%) |
| 1.07a) (0.87-1.31)b) | 0.79a) (0.63-0.99)b) | − | |
| 虚血性脳卒中注2) | 226/7,002 (1.43%) | 135/7,012 (0.87%) | 144/7,012 (0.93%) |
| 1.54 (1.25-1.90)c) | 0.94 (0.75-1.19)c) | − | |
| 出血性脳卒中注2) | 18/7,002 (0.11%) | 40/7,012 (0.26%) | 76/7,012 (0.49%) |
| 0.23 (0.14-0.39)c) | 0.53 (0.36-0.78)c) | − | |
| 全身性塞栓症注2) | 11/7,002 (0.07%) | 8/7,012 (0.05%) | 13/7,012 (0.08%) |
| 0.83 (0.37-1.85)c) | 0.62 (0.26-1.50)c) | − | |
| 心血管死注3) | 527/7,034 (2.71%) | 530/7,035 (2.74%) | 611/7,036 (3.17%) |
| 0.85 (0.76-0.96)c) | 0.86 (0.77-0.97)c) | − | |
| 全死亡注3) | 737/7,034 (3.80%) | 773/7,035 (3.99%) | 839/7,036 (4.35%) |
| 0.87 (0.79-0.96)c) | 0.92 (0.83-1.01)c) | − | |
| 重大な心血管系イベントd)、注3) | 913/7,034 (4.90%) | 827/7,035 (4.41%) | 926/7,036 (4.98%) |
| 0.98 (0.87-1.11)e) | 0.89 (0.78-1.00)e) | − | |
| 非致死性心筋梗塞注3) | 148/7,034 (0.78%) | 117/7,035 (0.62%) | 125/7,036 (0.66%) |
| 1.18 (0.93-1.49)c) | 0.93 (0.72-1.20)c) | − | |
| 大出血注4) | 254/7,002 (1.61%) | 418/7,012 (2.75%) | 524/7,012 (3.43%) |
| 0.47 (0.41-0.55)c) | 0.80 (0.71-0.91)c) | − | |
試験終了時、PT-INRが2.0以上で安定するまでワルファリンと本剤30mg(本剤を減量している患者では15mg)1日1回を併用してエドキサバン高用量群からワルファリンへ切り替えた際、切り替えから30日間の脳卒中又は全身性塞栓症の発現率は、ワルファリン群と同程度であった。[8.5.4参照]
副作用発現頻度は、エドキサバン高用量群で28.9%(2,024/7,012例)であった。主な副作用は、鼻出血6.2%(434/7,012例)、血尿3.5%(247/7,012例)であった。
副作用発現頻度は、エドキサバン高用量群で28.9%(2,024/7,012例)であった。主な副作用は、鼻出血6.2%(434/7,012例)、血尿3.5%(247/7,012例)であった。
日本人集団(有効性評価1,010例、安全性評価1,010例)では次の成績が得られ、有効性・安全性ともに試験全体の成績と同様の傾向が認められた。
| エンドポイント | イベント発現例数/被験者数 (年間発現率) | ||
| ワルファリン群に対するハザード比 (95%信頼区間) | |||
| エドキサバン低用量群注1) | エドキサバン高用量群 | ワルファリン群 | |
| 脳卒中又は全身性塞栓症注2) | 18/337 (2.24%) | 12/336 (1.47%) | 13/337 (1.56%) |
| 1.46 (0.65-3.31) | 0.95 (0.39-2.34) | − | |
| 大出血注3) | 14/337 (1.74%) | 27/336 (3.38%) | 33/337 (4.03%) |
| 0.44 (0.24-0.82) | 0.84 (0.51-1.40) | − | |
副作用発現頻度は、エドキサバン高用量群で49.7%(167/336例)であった。主な副作用は、鼻出血8.6%(29/336例)、血尿5.7%(19/336例)であった。
17.1.2 国内第III相試験
国内で実施した第III相二重盲検試験において、80歳以上で出血リスクが高く注1)既存の経口抗凝固薬を承認された用法及び用量注2)で投与することが困難な非弁膜症性心房細動患者(有効性評価984例、安全性評価982例)に、エドキサバン15mg又はプラセボを1日1回経口投与した。観察期間の中央値は1.3年であった。主要評価項目とした脳卒中又は全身性塞栓症の発現率について、エドキサバン群の優越性が検証された11)。[7.3参照]
注1)高度腎機能障害(CLcr15mL/min以上30mL/min未満)、重要器官(頭蓋内、眼内、消化管等)での出血の既往、低体重(45kg以下)、酸性非ステロイド性消炎鎮痛剤の連用又は抗血小板剤1剤の併用のいずれか1つ以上に該当する場合
注2)ワルファリン(PT-INR1.6〜2.6でコントロール)、ダビガトラン110mg1日2回、リバーロキサバン10mg1日1回、アピキサバン2.5mg1日2回又はエドキサバン30mg1日1回
| エンドポイント | イベント発現例数/被験者数 (年間発現率) | ハザード比 (95%信頼区間) | |
| エドキサバン群 | プラセボ群 | ||
| 脳卒中又は全身性塞栓症注1) | 15/492 (2.3%) | 44/492 (6.7%) | 0.34 (0.19-0.61) |
| 大出血注2) | 20/492 (3.3%) | 11/490 (1.8%) | 1.87 (0.90-3.89) |
副作用発現頻度は、エドキサバン群で11.4%(56/492例)であった。主な副作用は、貧血3.3%(16/492例)、尿中血陽性1.2%(6/492例)であった。
<静脈血栓塞栓症の治療及び再発抑制>
17.1.3 国際共同第III相試験
日本を含む国際共同第III相二重盲検試験において、急性症候性静脈血栓塞栓症患者(有効性評価8,240例、安全性評価8,240例)に、ヘパリンによる初期治療注1)後、エドキサバン60mg(減量基準注2)を満たす患者では30mg)又は対照薬としたワルファリンナトリウムを1日1回、3〜12ヵ月間経口投与した注3)。主要評価項目とした無作為割付後12ヵ月間での症候性静脈血栓塞栓症の再発(深部静脈血栓症、非致死性肺塞栓症、致死性肺塞栓症の複合エンドポイント)について、対照薬群に対するエドキサバン群の非劣性が検証された12)。
注1)エドキサバン群では低分子量ヘパリン(エノキサパリンナトリウム(以下、エノキサパリン、本適応は国内未承認))又は未分画ヘパリン、ワルファリン群では低分子量ヘパリン(エノキサパリン[本適応は国内未承認])又は未分画ヘパリンとワルファリンナトリウムを、PT-INRが規定の値に達するまで5〜12日間投与した後、各治験薬に切り替えた。[5.3参照]
注2)無作為割付時の体重60kg以下、CLcr30mL/min以上50mL/min以下、ベラパミル又はキニジン併用、及び無作為割付後のケトコナゾール(経口剤:国内未承認)、イトラコナゾール、エリスロマイシン、アジスロマイシン、クラリスロマイシン、又はドロネダロン(国内未承認)併用[7.1、7.2参照]
注3)試験全体の投与終了日後にワルファリンに切り替える場合、PT-INRが2.0〜3.0に到達するまで低分子量ヘパリン(エノキサパリン(本適応は国内未承認)、日本では未分画ヘパリン)又はフォンダパリヌクス(静脈血栓塞栓症の再発抑制は国内未承認)とワルファリンを併用した。[8.5.4参照]
| エンドポイント | イベント発現例数/被験者数 (発現率) | ハザード比 (95%信頼区間) | ||
| エドキサバン群 | ワルファリン群 | |||
| 症候性VTE再発注1) | 130/4,118 (3.2%) | 146/4,122 (3.5%) | 0.89a) (0.70-1.13) | |
| 登録時:症候性DVT注1) | 83/2,468 (3.4%) | 81/2,453 (3.3%) | 1.02 (0.75-1.38) | |
| 登録時:症候性PE注1) | 47/1,650 (2.8%) | 65/1,669 (3.9%) | 0.73 (0.50-1.06) | |
| 大出血又は臨床的に重要な出血注2) | 349/4,118 (8.5%) | 423/4,122 (10.3%) | 0.81 (0.71-0.94) | |
副作用発現頻度は、エドキサバン群で25.0%(1,029/4,118例)であった。主な副作用は、鼻出血3.3%(134/4,118例)、月経過多2.1%(85/4,118例)であった。
なお、日本人集団(有効性評価209例、安全性評価209例)では次に示す成績が得られた。
| エンドポイント | イベント発現例数/被験者数 (発現率) | ハザード比 (95%信頼区間) | |
| エドキサバン群 | ワルファリン群 | ||
| 症候性VTE再発注1) | 5/106 (4.7%) | 5/103 (4.9%) | 1.00 (0.28-3.66) |
| 大出血又は臨床的に重要な出血注2) | 11/106 (10.4%) | 16/103 (15.5%) | 0.67 (0.31-1.47) |
副作用発現頻度は、エドキサバン群で49.1%(52/106例)であった。主な副作用は、肝酵素上昇7.5%(8/106例)であった。
<慢性血栓塞栓性肺高血圧症患者における血栓・塞栓形成の抑制>
17.1.4 国内第III相医師主導治験
国内で実施した第III相単盲検医師主導治験において、慢性血栓塞栓性肺高血圧症患者(有効性評価72例、安全性評価74例)に、エドキサバン60mg(減量基準注1)を満たす患者では30mg)又は対照薬としたワルファリンカリウムを1日1回、12ヵ月間経口投与した注2)。本試験は、ワルファリンによる抗凝固療法が安定して継続されている患者を対象とした注3)。主要評価項目としたベースラインに対する無作為割付1年後の安静時の肺血管抵抗比について、対照薬群に対するエドキサバン群の非劣性が検証された13)。大出血又は臨床的に重要な出血の発現率に、投与群間で明らかな違いは認められなかった。
注1)無作為割付時の体重60kg以下、CLcr15mL/min以上50mL/min以下、P糖蛋白阻害作用を有する薬剤(キニジン硫酸塩水和物、ベラパミル塩酸塩、エリスロマイシン、シクロスポリン、アジスロマイシン、クラリスロマイシン、ケトコナゾール、イトラコナゾール、ジルチアゼム、アミオダロン塩酸塩、HIVプロテアーゼ阻害剤)併用[7.1、7.2参照]
注2)エドキサバン群で本剤からワルファリンに切り替える場合は、抗凝固作用が維持されるよう注意し、PT-INRが治療域の下限を超えるまでは、本剤30mgを投与している患者では15mg1日1回とワルファリン、60mgを投与している患者では30mg1日1回とワルファリンを併用投与することとした。[8.5.4参照]
注3)組み入れられた被験者全員が肺動脈血栓内膜摘除術(PEA)又はバルーン肺動脈形成術(BPA)の施行歴を有していた。[5.5参照]
| エドキサバン群 | ワルファリン群 | |
| ベースラインの平均値(標準偏差)(例数) | 2.406(1.003) (36) | 2.597(1.127) (36) |
| 投与1年後の平均値(標準偏差)(例数) | 2.274(0.932) (36) | 2.582(0.941) (34) |
| 安静時肺血管抵抗比(対数変換値)の最小二乗平均値注1)(例数) [95%信頼区間] | −0.069 (36) [−0.149〜0.010] | 0.014 (34) [−0.068〜0.096] |
| 安静時肺血管抵抗比(対数変換値)の最小二乗平均の群間差 [95%信頼区間] | −0.083 [−0.198〜0.031]a) | |
| 大出血又は臨床的に重要な出血注2) イベント発現例数/被験者数(発現率) | 1/37 (2.7%) | 2/37 (5.4%) |
副作用発現頻度は、エドキサバン群で27.0%(10/37例)であった。主な副作用は、歯肉出血8.1%(3/37例)、鼻出血5.4%(2/37例)であった。
<下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制>
17.1.5 国際共同第III相試験(人工膝関節全置換術施行患者)
日本及び台湾で実施した第III相二重盲検試験において、人工膝関節全置換術施行患者(有効性評価594例、安全性評価703例)に、エドキサバン30mgを1日1回、11〜14日間経口投与、又は対照薬としたエノキサパリン2,000IUを1日2回、11〜14日間皮下注射した。静脈血栓塞栓症の発現率について、対照薬群に対するエドキサバン群の非劣性が検証された。大出血又は臨床的に重要な出血の発現率には、投与群間の有意な差は認められなかった。エドキサバン群で大出血は4例に発現し、その内訳は、ヘモグロビン量が2g/dLを超えて低下した症例が3例、4単位を超える輸血を必要とし、かつ、ヘモグロビン量が2g/dLを超えて低下した症例が1例であった14)。
| エドキサバン群 | エノキサパリン群 | ||
| 全体集団 | 静脈血栓塞栓症発現率(例数) [95%信頼区間] | 7.4%(22/299) [4.9〜10.9] | 13.9%(41/295) [10.4〜18.3] |
| 静脈血栓塞栓症発現率の群間差 [95%信頼区間] | −6.5% [−11.6〜−1.6] | ||
| 大出血又は臨床的に重要な出血の発現率(例数) [95%信頼区間] | 6.2%(22/354) [4.1〜9.2] | 3.7%(13/349) [2.2〜6.3] | |
| 日本人集団 | 静脈血栓塞栓症発現率(例数) [95%信頼区間] | 7.3%(20/273) [4.8〜11.0] | 12.2%(33/270) [8.8〜16.7] |
| 静脈血栓塞栓症発現率の群間差 [95%信頼区間] | −4.9% [−10.0〜0.1] | ||
| 大出血又は臨床的に重要な出血の発現率(例数) [95%信頼区間] | 6.2%(20/323) [4.0〜9.4] | 4.0%(13/323) [2.4〜6.8] | |
副作用発現頻度は、エドキサバン群で38.1%(135/354例)であった。主な副作用は、γ-GTP上昇8.8%(31/354例)、皮下出血6.2%(22/354例)であった。
17.1.6 国内第III相試験(人工股関節全置換術施行患者)
国内で実施した第III相二重盲検試験において、人工股関節全置換術施行患者(有効性評価503例、安全性評価604例)に、エドキサバン30mgを1日1回、11〜14日間経口投与、又は対照薬としたエノキサパリン2,000IUを1日2回、11〜14日間皮下注射した。静脈血栓塞栓症の発現率について、対照薬群に対するエドキサバン群の非劣性が検証された。大出血又は臨床的に重要な出血の発現率には、投与群間の有意な差は認められなかった。エドキサバン群で大出血は2例に発現し、いずれもヘモグロビン量が2g/dLを超えて低下した症例であった15)。
| エドキサバン群 | エノキサパリン群 | |
| 静脈血栓塞栓症発現率(例数) [95%信頼区間] | 2.4%(6/255) [1.1〜5.0] | 6.9%(17/248) [4.3〜10.7] |
| 静脈血栓塞栓症発現率の群間差 [95%信頼区間] | −4.5% [−8.6〜−0.9] | |
| 大出血又は臨床的に重要な出血の発現率(例数) [95%信頼区間] | 2.6%(8/303) [1.3〜5.1] | 3.7%(11/301) [2.1〜6.4] |
副作用発現頻度は、エドキサバン群で39.9%(121/303例)であった。主な副作用は、γ-GTP上昇12.5%(38/303例)、ALT上昇8.3%(25/303例)であった。
17.1.7 国内第III相試験(股関節骨折手術施行患者)
国内で実施した第III相試験において、股関節骨折手術施行患者(有効性評価73例、安全性評価88例)に、オープンラベルでエドキサバン30mgを1日1回、11〜14日間経口投与、もしくはエノキサパリン2,000IUを1日2回、11〜14日間皮下注射した。静脈血栓塞栓症の発現率と、大出血又は臨床的に重要な出血の発現率は、次のとおりであった。エドキサバン群で大出血は1例に発現し、ヘモグロビン量が2g/dLを超えて低下した症例であった16)。
| エドキサバン群 | エノキサパリン群a) | |
| 静脈血栓塞栓症発現率(例数) [95%信頼区間] | 6.5%(3/46) [2.2〜17.5] | 3.7%(1/27) [0.7〜18.3] |
| 大出血又は臨床的に重要な出血の発現率(例数) [95%信頼区間] | 3.4%(2/59) [0.9〜11.5] | 6.9%(2/29) [1.9〜22.0] |
副作用発現頻度は、エドキサバン群で37.3%(22/59例)であった。主な副作用は、尿中血陽性6.8%(4/59例)であった。
18. 薬効薬理
18.1 作用機序
エドキサバンはin vitroでヒトの活性化血液凝固第X因子(FXa)を競合的かつ選択的に阻害した。トロンビンなど、他の凝固関連因子のセリンプロテアーゼに対する阻害活性は弱かった17)。
18.2 抗凝固作用
エドキサバンはin vitroでヒト血漿におけるPT、APTT及びトロンビン時間(TT)を延長した。その凝固時間延長作用の強さはPT>APTT>TTの順であった17)。
18.3 血栓モデルにおける抗血栓作用
ラットの静脈血栓モデル、静脈うっ血血栓モデル、動静脈シャントモデル及び組織因子誘発DICモデルにおいて、エドキサバンは単回経口投与により用量依存的に血栓形成を抑制した。ラット静脈血栓モデルにおいて、エドキサバンは抗血栓作用を示す用量でAPTTに影響せずにPTを延長した18)。
18.4 止血に及ぼす影響
ラット尾出血モデルにおいて、抗血栓用量よりも高い用量のエドキサバン、ワルファリン及びエノキサパリンは出血時間を有意に延長した。出血時間2倍延長用量(BT2)とラットの静脈血栓モデルにおける血栓形成50%抑制用量(ED50)との比(BT2/ED50)は、エドキサバンが10.5より大きく、エノキサパリンは3.4であった19)。
18.5 血液凝固因子製剤による抗凝固作用のリバース
ヒト血漿でのエドキサバンによるin vitro PT延長作用は、遺伝子組換え活性化血液凝固第VII因子、血液凝固因子抗体迂回活性複合体及び血液凝固第IX因子複合体により抑制された20)。
19. 有効成分に関する理化学的知見
19.1. エドキサバントシル酸塩水和物
22. 包装
<リクシアナ錠15mg>
(プラスチックボトル:バラ) 100錠
(PTP) 100錠(10錠×10) 140錠(14錠×10)
<リクシアナ錠30mg>
(プラスチックボトル:バラ) 100錠
(PTP) 100錠(10錠×10) 140錠(14錠×10)
<リクシアナ錠60mg>
(プラスチックボトル:バラ) 100錠
(PTP) 100錠(10錠×10) 140錠(14錠×10)
23. 主要文献
- Brodsky S,et al., J Am Soc Nephrol., 29 (12), 2787-2793, (2018) »PubMed
- Zakrocka I,et al., Adv Clin Exp Med., 31 (2), 165-173, (2022) »PubMed
- 社内資料:血液透析患者における薬物動態(2014年9月26日承認、CTD2.7.6.3)
- Pengo V,et al., Blood, 132 (13), 1365-1371, (2018) »PubMed
- 社内資料:健康成人男性を対象とした単回投与試験(2011年4月22日承認、CTD2.7.6.1)
- 社内資料:健康成人男性を対象とした反復投与試験(2011年4月22日承認、CTD2.7.6.5)
- 社内資料:腎機能障害患者における薬物動態(2011年4月22日承認、CTD2.7.6.10)
- 社内資料:高度腎機能障害を有する非弁膜症性心房細動患者を対象とした第III相試験成績(2014年9月26日承認、CTD2.7.6.15)
- 社内資料:肝機能障害患者における薬物動態(2011年4月22日承認、CTD2.7.6.38)
- 社内資料:心房細動患者を対象とした第III相国際共同試験成績(ENGAGE AF-TIMI 48)(2014年9月26日承認、CTD2.7.6.11)
- 社内資料:出血リスクが高い高齢心房細動患者を対象とした第III相試験成績(ELDERCARE-AF)
- 社内資料:急性症候性静脈血栓塞栓症患者を対象とした第III相国際共同試験成績(Hokusai-VTE)(2014年9月26日承認、CTD2.7.6.16)
- 社内資料:慢性血栓塞栓性肺高血圧症患者における第III相試験成績(KABUKI)
- 社内資料:人工膝関節全置換術施行患者における第III相試験成績(2011年4月22日承認、CTD2.7.6.26)
- 社内資料:人工股関節全置換術施行患者における第III相試験成績(2011年4月22日承認、CTD2.7.6.27)
- 社内資料:股関節骨折手術施行患者における第III相試験成績(2011年4月22日承認、CTD2.7.6.30)
- 社内資料:エドキサバンのXa酵素阻害作用(2011年4月22日承認、CTD2.6.2.2)
- 社内資料:ラット各種血栓モデルにおける抗血栓作用(2011年4月22日承認、CTD2.6.2.2)
- 社内資料:出血時間に及ぼす影響(2011年4月22日承認、CTD2.6.2.3)
- 社内資料:血液凝固因子製剤による抗凝固活性のリバース(2011年4月22日承認、CTD2.6.2.3)
24. 文献請求先及び問い合わせ先
文献請求先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
製品情報問い合わせ先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
26. 製造販売業者等
26.1 製造販売元
第一三共株式会社
東京都中央区日本橋本町3-5-1