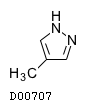医薬品情報
| 総称名 | ホメピゾール |
|---|---|
| 一般名 | ホメピゾール |
| 欧文一般名 | Fomepizole |
| 製剤名 | ホメピゾール点滴静注液 |
| 薬効分類名 | エチレングリコール・メタノール中毒用剤 |
| 薬効分類番号 | 3929 |
| ATCコード | V03AB34 |
| KEGG DRUG |
D00707
ホメピゾール
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年12月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ホメピゾール点滴静注1.5g「タケダ」 | Fomepizole Intravenous Infusion 1.5g | 武田薬品工業 | 3929411A1020 | 140398円/瓶 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
○エチレングリコール中毒
○メタノール中毒
6. 用法及び用量
通常、ホメピゾールとして初回は15mg/kg、2回目から5回目は10mg/kg、6回目以降は15mg/kgを、12時間ごとに30分間以上かけて点滴静注する。[14.2参照]
なお、血液透析を併用する場合は、以下に従い投与する。
なお、血液透析を併用する場合は、以下に従い投与する。
| 透析開始時 | 直前の本剤投与から6時間未満の場合は、透析直前には投与しない。 |
| 直前の本剤投与から6時間以上経過している場合は、透析直前に投与する。 | |
| 透析中 | 透析開始時から4時間ごとに投与する。 |
| 透析終了時 | 直前の本剤投与から1時間未満の場合は、透析終了時には投与しない。 |
| 直前の本剤投与から1時間以上3時間以内の場合は、通常用量の1/2量を透析終了直後に投与する。 | |
| 直前の本剤投与から3時間超経過している場合は、透析終了直後に投与する。 | |
| 透析終了後 | 直前の本剤投与から12時間ごとに投与する。 |
8. 重要な基本的注意
8.1 本剤の投与に際しては、学会のガイドライン等、最新の情報を参考にすること。
8.2 重篤な代謝性アシドーシスや腎不全等が認められる場合は、必要に応じて血液透析を実施すること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
副作用発現に留意し、経過を十分に観察しながら投与すること。一般に生理機能が低下していることが多い。
10. 相互作用
10.2 併用注意
| エタノール | エタノール及び本剤の血中濃度が上昇することがある。 | 本剤のアルコールデヒドロゲナーゼ阻害作用により、エタノールの消失速度が40%低下したとの報告がある。また、併用により本剤の消失速度が50%低下したとの報告があるが機序は不明である。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
呼吸困難、喘鳴、潮紅等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | |
| 精神神経系 | 頭痛 | 痙攣発作、激越、回転性めまい、傾眠、不安、眼振、異常感 |
| 消化器 | 腹痛、嘔吐、消化不良 | |
| 注射部位 | 注射部位反応(灼熱感、疼痛、炎症) | リンパ管炎、静脈炎 |
| 循環器 | 徐脈、頻脈、循環虚脱、低血圧 | |
| 血液 | 好酸球増加症、貧血 | |
| その他 | 発熱、発疹、腰痛、しゃっくり、咽頭炎、霧視、ASTの上昇 |
13. 過量投与
13.1 症状
健康成人を対象として、本剤を100mg/kgまで単回経口投与した外国臨床試験において悪心、浮動性めまい等の症状が認められている。
13.2 処置
本剤は血液透析により除去されるので、本剤の過量投与が明白な場合又は疑われる場合は必要に応じて血液透析を行うこと。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は固化することがあるので、このような場合には体温付近まで加温し、融解した後に使用すること。固化による本剤の有効性、安全性及び安定性への影響はない。
14.1.2 調製後は速やかに使用し、やむを得ず保存を必要とする場合でも調製後24時間以内に使用すること。
14.1.3 各バイアルは一回限りの使用とし、必要量を抜き取った後のバイアル内の残液は使用しないこと(本剤は保存剤を含有していない)。
14.1.4 下表を参考に、患者体重に基づき必要量を100mL以上の日局生理食塩液又は日局5%ブドウ糖注射液にて、1.0〜15.0mg/mLとなるように希釈すること。
<通常用量:15mg/kg>
通常用量の1/2量を投与する場合は〔 〕内の数字を参照すること。
| 患者体重(kg) | 必要量(mL) | 100mLで希釈した場合の濃度(mg/mL) |
| 20 | 0.30〔0.15〕 | 3.0〔1.5〕 |
| 30 | 0.45〔0.23〕 | 4.5〔2.3〕 |
| 40 | 0.60〔0.30〕 | 6.0〔3.0〕 |
| 50 | 0.75〔0.38〕 | 7.5〔3.8〕 |
| 60 | 0.90〔0.45〕 | 9.0〔4.5〕 |
| 70 | 1.05〔0.53〕 | 10.55〔5.3〕 |
| 80 | 1.20〔0.60〕 | 12.0〔6.0〕 |
| 90 | 1.35〔0.68〕 | 13.5〔6.8〕 |
| 100 | 1.50〔0.75〕 | 15.0〔7.5〕 |
<通常用量:10mg/kg>
通常用量の1/2量を投与する場合は〔 〕内の数字を参照すること。
| 患者体重(kg) | 必要量(mL) | 100mLで希釈した場合の濃度(mg/mL) |
| 20 | 0.20〔0.10〕 | 2.0〔1.0〕 |
| 30 | 0.30〔0.15〕 | 3.0〔1.5〕 |
| 40 | 0.40〔0.20〕 | 4.0〔2.0〕 |
| 50 | 0.50〔0.25〕 | 5.0〔2.5〕 |
| 60 | 0.60〔0.30〕 | 6.0〔3.0〕 |
| 70 | 0.70〔0.35〕 | 7.0〔3.5〕 |
| 80 | 0.80〔0.40〕 | 8.0〔4.0〕 |
| 90 | 0.90〔0.45〕 | 9.0〔4.5〕 |
| 100 | 1.00〔0.50〕 | 10.0〔5.0〕 |
14.2 薬剤投与時の注意
30分間以上かけて静脈内に点滴投与すること。本剤を5分間で静脈内に投与した場合に静脈の灼熱感及び静脈硬化症が認められたとの報告がある。[6.参照]
15. その他の注意
15.1 臨床使用に基づく情報
外国で、本剤を投与された重症エチレングリコール中毒患者において、因果関係は不明であるが、多臓器不全、播種性血管内凝固症候群、無尿の報告がある。
15.2 非臨床試験に基づく情報
15.2.1 細菌を用いる復帰突然変異試験において陽性であることが報告されている。
15.2.2 幼若ラットに本剤を110mg/Lの濃度で含有する液体飼料を6週間摂取させた試験で、精巣毒性(精巣重量、血漿中テストステロン濃度の低値等)が認められている。また、エタノールと併用投与した場合に精巣毒性の増強が認められている。
16. 薬物動態
16.4 代謝
ホメピゾールはCYP2D6及びCYP2E1に対して阻害作用を示し、CYP1A2、CYP2A6、CYP2C9及びCYP3A4に対して弱い阻害作用を示す(in vitro)3)。
16.5 排泄
健康成人にホメピゾールとして7mg/kgを静脈内に単回投与した時注)、投与48時間後までの累積尿中排泄率はホメピゾール未変化体2.0±0.4%、ホメピゾール代謝物(4-カルボキシピラゾール)65.9±4.5%であった4)(外国人データ)。
注)本剤の国内承認用法及び用量は10mg/kg又は15mg/kgを静脈内投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 海外第III相臨床試験(前向き非盲検非対照試験)
(1)エチレングリコール中毒患者22例を対象に前向き非盲検非対照試験を実施した。ホメピゾールとして初回は15mg/kg、2回目から5回目は10mg/kg、6回目以降は15mg/kgを、12時間ごとに30分間以上かけて点滴静注し、血漿中エチレングリコール濃度が20mg/dL未満になるまで投与を継続した時の結果は以下のとおりであった。
なお、血液透析を併用する場合には、規定された投与方法に従って投与した。
なお、血液透析を併用する場合には、規定された投与方法に従って投与した。
(2)メタノール中毒患者15例を対象に前向き非盲検非対照試験を実施した。ホメピゾールとして初回は15mg/kg、2回目から5回目は10mg/kg、6回目以降は15mg/kgを、12時間ごとに30分間以上かけて点滴静注し、血中メタノール濃度が20mg/dL未満になるまで投与を継続した時の結果は以下のとおりであった。
なお、血液透析を併用する場合には、規定された投与方法に従って投与した。[6.参照]
なお、血液透析を併用する場合には、規定された投与方法に従って投与した。[6.参照]
18. 薬効薬理
18.1 作用機序
ホメピゾールは、肝臓アルコールデヒドロゲナーゼによるエチレングリコールあるいはメタノールの代謝を阻害し、それらから生成される有害な代謝物の生成を抑制することにより、エチレングリコール中毒あるいはメタノール中毒における中毒症状を改善する。
18.2 肝臓アルコールデヒドロゲナーゼ阻害活性
ヒト肝臓アルコールデヒドロゲナーゼを阻害し、Ki値は0.21μMである(in vitro)7)。
18.3 エチレングリコール中毒に対する作用
ホメピゾールを各種エチレングリコール中毒モデルに投与した時、中毒症状や代謝性アシドーシスの改善作用及びグリコール酸産生を抑制した7)。
18.4 メタノール中毒に対する作用
ホメピゾールをメタノール中毒モデル(サル)に投与した時、中毒症状や代謝性アシドーシスの改善作用及びギ酸産生を抑制した7)。
19. 有効成分に関する理化学的知見
19.1. ホメピゾール
20. 取扱い上の注意
本剤とゴム栓が接触した状態での長期保存安定性は十分に確認されていないので、立てて保管すること。
22. 包装
1バイアル
23. 主要文献
- Gracia R,et al., Clin Toxicol., 50, 743-748, (2012)
- Collins MD,et al., Arch Toxicol., 66, 652-659, (1992) »PubMed
- ホメピゾールの代謝に関する検討(2014年9月26日承認、CTD 2.6.4.1)
- ホメピゾールの薬物動態試験成績(2014年9月26日承認、CTD 2.7.6.2)
- ホメピゾールの臨床試験成績[1](2014年9月26日承認、CTD 2.7.6.8)
- ホメピゾールの臨床試験成績[2](2014年9月26日承認、CTD 2.7.6.13)
- ホメピゾールの非臨床薬理試験成績(2014年9月26日承認、CTD 2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
武田薬品工業株式会社
くすり相談室
〒103-8668
東京都中央区日本橋本町二丁目1番1号
電話:フリーダイヤル 0120-566-587 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
製品情報問い合わせ先
武田薬品工業株式会社
くすり相談室
〒103-8668
東京都中央区日本橋本町二丁目1番1号
電話:フリーダイヤル 0120-566-587 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
武田薬品工業株式会社
〒540-8645
大阪市中央区道修町四丁目1番1号