医薬品情報
| 総称名 | ザノサー |
|---|---|
| 一般名 | ストレプトゾシン |
| 欧文一般名 | Streptozocin |
| 製剤名 | 注射用ストレプトゾシン |
| 薬効分類名 | 抗悪性腫瘍剤 |
| 薬効分類番号 | 4219 |
| ATCコード | L01AD04 |
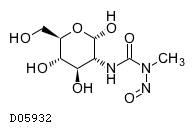
| KEGG DRUG |
D05932
ストレプトゾシン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年7月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ザノサー点滴静注用1g | ZANOSAR IV Infusion 1g | ノーベルファーマ | 4219406D1026 | 43310円/瓶 | 劇薬, 処方箋医薬品注) |
1. 警告
本剤の投与は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本療法が適切と判断される症例についてのみ実施すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
膵・消化管神経内分泌腫瘍
5. 効能または効果に関連する注意
「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分理解した上で、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと。[17.1.1参照]
6. 用法及び用量
下記用法・用量のいずれかを選択する。
(1)5日間連日投与法
通常、成人にはストレプトゾシンとして1回500mg/m2(体表面積)を1日1回5日間連日点滴静脈内投与し、37日間休薬する。これを1サイクルとして投与を繰り返す。
(2)1週間間隔投与法
通常、成人にはストレプトゾシンとして1回1,000mg/m2(体表面積)を1週間ごとに1日1回点滴静脈内投与する。なお、患者の状態により適宜増減するが、1回の投与量は1,500mg/m2(体表面積)を超えないこと。
7. 用法及び用量に関連する注意
7.1 本剤投与の際は、腎毒性を軽減するために輸液を行い、尿量確保に注意すること。
7.2 本剤は、いずれの投与量においても1回量を30分〜2時間かけて点滴静脈内投与すること。
7.3 本剤の投与にあたっては、以下の基準を参考に必要に応じて、休薬、減量、中止又は増量すること。
GradeはCTCAE ver.4.0に準じる。
7.3.1 休薬基準
(1)5日間連日投与法において、以下に示した程度の副作用が認められた場合は、休薬すること。
| 副作用 | 程度 |
| 好中球数減少 | 500/mm3未満の場合、1,500/mm3以上に回復するまで休薬する。 |
| 発熱性好中球減少症 | Grade3の場合、回復するまで休薬する。 |
| 血小板数減少 | 5万/mm3未満の場合、10万/mm3以上に回復するまで休薬する。 |
| 非血液毒性(肝転移を有する患者では、γ-GTPを除く) | Grade3の場合、Grade2以下に回復するまで休薬する。 |
| 血清クレアチニン上昇 | 施設基準値の1.5倍を超える場合、1.5倍以下に回復するまで休薬する。 |
(2)1週間間隔投与法において、以下に示した程度の副作用が認められた場合は、休薬すること。
| 副作用 | 程度 |
| 好中球数減少 | 1,500/mm3未満の場合、1,500/mm3以上に回復するまで休薬する。 |
| 発熱性好中球減少症 | Grade3の場合、回復するまで休薬する。 |
| 血小板数減少 | 10万/mm3未満の場合、10万/mm3以上に回復するまで休薬する。 |
| 非血液毒性(肝転移を有する患者では、γ-GTPを除く) | Grade3の場合、Grade2以下かつ毒性が許容可能となるまで休薬する。 |
| 血清クレアチニン上昇 | 施設基準値の1.5倍を超える場合、1.5倍以下に回復するまで休薬する。 |
| 総ビリルビン上昇 | 施設基準値の1.5倍を超える場合、1.5倍以下に回復するまで休薬する。 |
| AST及びALT上昇 | 施設基準値の2.5倍を超える場合、2.5倍以下に回復するまで休薬する。肝転移を有する患者では施設基準値の5倍を超える場合、5倍以下に回復するまで休薬する。 |
| 血清尿素窒素上昇 | 30mg/dLを超える場合、30mg/dL以下に回復するまで休薬する。 |
| 悪心・嘔吐 | Grade3の場合、Grade2以下に回復するまで休薬する。 |
7.3.2 減量基準
1週間間隔投与法において、以下に示した程度の副作用が認められた場合は、休薬後の投与再開時に、投与量を1段階(250mg/m2)ずつ減量すること。ただし、750mg/m2未満での投与及び減量後の増量は行わないこと。
| 副作用 | 程度 |
| 好中球数減少 | 500/mm3未満 |
| 発熱性好中球減少症 | Grade3 |
| 血小板数減少 | 5万/mm3未満 |
| 非血液毒性(肝転移を有する患者では、γ-GTPを除く) | Grade3 |
| 血清クレアチニン上昇 | 施設基準値の1.5倍を超える場合 |
7.3.3 中止基準
(1)5日間連日投与法において、以下に示した程度の副作用が認められた場合、又は連続で4週間以上の休薬を要する副作用が認められた場合は、本剤の投与を中止すること。
| 副作用 | 程度 |
| 発熱性好中球減少症 | 以下のいずれかの条件を満たす場合: 1)Grade4が発現した場合 2)Grade3の発現後に回復し、投与再開後、再度Grade3以上が発現した場合 |
| 血小板数減少 | 5万/mm3未満となった後に回復し、投与再開後、再度5万/mm3未満になった場合 |
| 非血液毒性(肝転移を有する患者では、γ-GTPを除く) | Grade4 |
| 腎障害 | 重篤な腎障害が発現した場合 |
| 糖尿病 | コントロールできない糖尿病が発現した場合 |
(2)1週間間隔投与法において、以下に示した程度の副作用が認められた場合、又は連続で4週間以上の休薬を要する副作用が認められた場合は、本剤の投与を中止すること。
| 副作用 | 程度 |
| 好中球数減少 | 500/mm3未満となった後に回復し、減量投与にも係わらず、再度500/mm3未満になった場合 |
| 発熱性好中球減少症 | 以下のいずれかの条件を満たす場合: 1)Grade4が発現した場合 2)Grade3の発現後に回復し、減量投与にも係わらず、再度Grade3以上が発現した場合 |
| 血小板数減少 | 5万/mm3未満となった後に回復し、減量投与にも係わらず、再度5万/mm3未満になった場合 |
| 非血液毒性(肝転移を有する患者では、γ-GTPを除く) | Grade4 |
| 腎障害 | 重篤な腎障害が発現した場合 |
| 糖尿病 | コントロールできない糖尿病が発現した場合 |
7.3.4 増量基準
1週間間隔投与法において、1回1,000mg/m2で投与を開始し、12週目までの忍容性が良好な場合には、1回1,250mg/m2に増量することができる。さらに18週目までの忍容性が認められる場合には、最大1回1,500mg/m2まで増量することができる。
8. 重要な基本的注意
8.1 重篤な腎障害があらわれることがあるので、本剤の投与開始前及び投与中は定期的に血清クレアチニン、血中尿素窒素等の腎機能検査及び尿蛋白等の尿検査を行うこと。[11.1.1参照]
8.2 重篤な骨髄抑制があらわれることがあるので、本剤の投与開始前及び投与中は定期的に血液検査(血球数算定、白血球分画等)を行うこと。[11.1.2参照]
8.3 錯乱及び嗜眠が発現したとの報告があるので、本剤投与中の患者には自動車の運転等危険を伴う機械を操作する際には注意させること。
8.4 耐糖能異常があらわれることがあるので、本剤の投与開始前及び投与中は定期的に血糖値の測定を行うこと。また、本剤の投与を開始する前に血糖値を適切にコントロールしておくこと。[9.1.1、11.1.3参照]
8.5 γ-GTP、AST、ALT等の上昇を伴う肝障害があらわれることがあるので、本剤の投与開始前及び投与中は定期的に肝機能検査を行うこと。[11.1.4参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.2 腎機能障害患者
副作用が強くあらわれるおそれがある。
9.4 生殖能を有する者
9.4.1 妊娠可能な女性に対しては、適切な避妊法を用いるよう指導すること。本剤を雌ラットに投与した場合、生殖機能への影響が報告されている。[9.5参照]
9.4.2 パートナーが妊娠する可能性のある男性に対しては、適切な避妊法を用いるよう指導すること。本剤を雄ラットに投与した場合、生殖機能への影響が報告されている。
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
10. 相互作用
10.2 併用注意
| アミノグリコシド系抗生物質等 | 腎毒性を増悪させるおそれがある。 | 機序不明 本剤とこれらの薬剤ともに腎毒性を有する。 |
| 他の抗悪性腫瘍剤 放射線照射 | 骨髄抑制等の副作用が増強することがある。患者の状態を十分に観察し、異常が認められた場合には、減量、休薬等の適切な処置を行うこと。 | 抗悪性腫瘍剤及び放射線照射の一般的な副作用として骨髄抑制作用を有する。 |
| ドキソルビシン | ドキソルビシンの半減期を延長し、重篤な骨髄抑制に至るおそれがある。 ドキソルビシンの投与量の減量を考慮すること。 | 本剤の投与に起因する肝障害によりドキソルビシンの胆汁中排泄が低下する可能性がある。 |
| ステロイド剤(外用剤を除く) | 高血糖が発現するおそれがある。 | 機序不明 |
| フェニトイン | 併用投与により、本剤の細胞毒性が低下するとの報告がある。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 腎障害(頻度不明)
腎不全、ファンコニー症候群、腎性尿崩症、高窒素血症、無尿、尿糖、ケトン尿、腎尿細管性アシドーシス、低リン酸血症、高クロール血症、低カリウム血症、低カルシウム血症、低尿酸血症等があらわれることがある。[8.1参照]
11.1.2 骨髄抑制
白血球数減少(4.5%)、リンパ球数減少(13.6%)、好中球数減少(13.6%)、血小板数減少(頻度不明)、貧血(ヘマトクリット減少、ヘモグロビン減少、頻度不明)等があらわれることがある。[8.2参照]
11.1.3 耐糖能異常
11.1.4 肝障害(50.0%)
γ-GTP、AST、ALT上昇を伴う肝障害があらわれることがある。[8.5参照]
11.2 その他の副作用
| 10%以上 | 4〜10%未満 | 頻度不明 | |
| 感染症 | 鼻咽頭炎 | 敗血症 | |
| 新生物 | 癌疼痛 | ||
| 代謝・栄養 | 食欲減退 | ||
| 精神・神経 | 味覚異常、不眠症 | 頭痛、不安、めまい、感覚鈍麻、末梢性ニューロパチー | 錯乱、嗜眠、うつ病 |
| 眼 | 眼精疲労、眼瞼炎 | ||
| 心・血管 | 血管障害(血管痛)(59.1%) | 不整脈、動悸、上室性期外収縮、高血圧、末梢血管障害 | 静脈炎 |
| 呼吸器 | 呼吸困難 | 発声障害 | |
| 消化器 | 悪心(45.5%)、便秘(45.5%)、嘔吐、口内炎、下痢 | 上腹部痛、口唇炎、腹部不快感、腹痛、口内乾燥、十二指腸潰瘍、痔核、心窩部不快感、口の感覚鈍麻 | 腸管穿孔 |
| 皮膚・皮下組織 | 皮膚炎、爪の障害、そう痒症、発疹 | ||
| 筋骨格・結合組織 | 背部痛、側腹部痛、関節滲出液、筋骨格硬直 | ||
| 腎・尿路 | 蛋白尿、血尿、頻尿、尿路痛 | ||
| 全身・投与局所 | 倦怠感 | 疲労、注射部位紅斑、末梢性浮腫、発熱 | 壊死、浮腫、灼熱感、圧痛 |
| 臨床検査 | 血中クレアチニン増加 | 血中アルブミン減少、血中コレステロール増加、尿蛋白、白血球数増加、CK増加、血圧上昇、Al-P増加 | 好酸球数増加、血中ビリルビン増加、LDH増加、クレアチニンクリアランスの減少 |
13. 過量投与
13.1 症状
海外で最高7.5g/m2/週まで投与され、汎血球減少症、敗血症、無尿、高窒素血症、腎不全、心不全等が報告されている。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 長袖の作業衣、防護マスク・メガネ、手袋を着用することが望ましい。
14.1.2 調製した薬液が粘膜に付着した場合、直ちに流水で洗い流す。皮膚、被服等に付着した場合、直ちに石鹸及び流水で洗い流す。
14.1.3 本剤に日局生理食塩液9.5mLを加え、十分転倒混和させた後、澄明で均一な溶液となるまで数分間静置する。この溶液1mL中には100mgのストレプトゾシンを含有する。
14.1.4 本剤には保存剤が添加されていないので、溶解後は速やかに使用すること。
14.2 薬剤投与時の注意
14.2.1 本剤は点滴静脈内投与とし、皮下又は筋肉内に注射しないこと。
14.2.2 点滴静脈内投与に際し、薬液が血管外に漏れた場合は、直ちに投与を中止し、適切な処置を行うこと。
14.2.3 本剤は下記薬剤と混注すると、沈殿が起こることがあるので、同じ静注ラインにより同時注入は避けること。
注射用プレドニゾロンコハク酸エステルナトリウム、フロセミド注射液
14.2.4 本剤はフルオロウラシル注射液と混注すると、本剤の活性低下をきたすことがあるので、同じ静注ラインにより同時注入は避けること。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 本剤は細菌、植物、哺乳動物細胞に対して変異原性がある。
15.2.2 動物実験(ラット、マウス、ハムスター)で、発癌性が報告されている。
16. 薬物動態
16.1 血中濃度
16.1.1 5日間連日投与法
日本人の切除不能又は遠隔転移を有する膵・消化管神経内分泌腫瘍患者15例に本剤500mg/m2を5日間連日点滴静脈内投与したとき、反復投与による薬物動態パラメータに影響はなかった1)。
| Cmax(μg/mL) | AUC0-∞(μg・h/mL) | t1/2(h) | |
| 投与1日目 | 36.610±6.824 | 31.226±4.955 | 0.615±0.056 |
| 投与5日目 | 39.357±8.226 | 33.271±6.863 | 0.665±0.086 |
16.1.2 1週間間隔投与法
日本人の切除不能又は遠隔転移を有する膵・消化管神経内分泌腫瘍患者7例に本剤1,000、1,250又は1,500mg/m2を単回点滴静脈内投与したとき、Cmax及びAUC0-∞は投与量に比例して増加した1)。
| 投与量(mg/m2) | Cmax(μg/mL) | AUC0-∞(μg・h/mL) | t1/2(h) |
| 1,000(n=7) | 68.394±9.498 | 63.383±10.174 | 0.637±0.046 |
| 1,250(n=3) | 102.250±19.968 | 81.512±11.800 | 0.604±0.033 |
| 1,500(n=3) | 119.030±4.076 | 97.321±5.393 | 0.546±0.055 |
16.3 分布
16.3.1 血液−脳関門通過性
進行癌患者3例(外国人)に[14C]標識ストレプトゾシンをストレプトゾシン総量1,500mg/m2(体表面積)で急速静脈内投与注)した時、全例で脳脊髄液中に[14C]が測定され、ストレプトゾシンの代謝物は、血液・脳関門を通過して髄液中に移行するものと考えられる2)。
16.3.2 髄液への移行性
進行癌患者(外国人)でのストレプトゾシン及びその[3H]、[14C]標識代謝物の分布に関する検討において、ストレプトゾシン総量1,500mg/m2(体表面積)を急速静脈内投与注)した時、脳脊髄液中[14C]濃度は3例全例で測定され、投与後1時間で血漿中濃度のほぼ1/3、投与後2時間では血漿中濃度と同程度であった。一方、脳脊髄液中[3H]は投与後2時間まで検出されなかった2)。
注)本剤の用法は「点滴静脈内投与」である。
16.4 代謝
本剤の代謝過程については不明であるが、外国人において、数種類の代謝物が検出されている。これらの代謝物の化学構造は解明されていない2)。
16.5 排泄
本剤は主に腎臓から排泄される。外国人において、静脈内投与量の約80%が投与後24時間までに、主に代謝物として尿中に排泄された。未変化体としての排泄は投与量の11%であった。本剤もしくは代謝物は、静脈内投与後24時間までに投与量の5%程度が呼気中に排泄された。糞中には投与量の1%未満が排泄された2)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第I/II相試験
WHO分類(2010年)でNET G1及び/又はNET G2に分類される、切除不能又は遠隔転移を有する膵・消化管神経内分泌腫瘍患者22例を対象に、42日間を1サイクルとして、[1]本剤500mg/m2を5日間連日点滴静脈内投与後、37日間休薬を4サイクル繰り返す(5日間連日投与法)又は[2]本剤1,000mg/m2を1週間間隔で点滴静脈内投与し、3サイクル目に1,250mg/m2、4サイクル目に1,500mg/m2に増量する(1週間間隔投与法)2とおりの用法・用量による検討を行った。
主要評価項目である5日間連日投与法における奏効率は6.7%(1/15例、95%信頼区間:0.2〜31.9%)であり、95%信頼区間の下限値は閾値奏効率(5%)を下回った。なお、奏効が認められた1例は膵神経内分泌腫瘍患者であり、消化管神経内分泌腫瘍患者では奏効が認められなかった。
副作用(臨床検査値異常を含む)は22例(100%)に認められた。主な副作用は、血管障害(血管痛)13例(59.1%)、悪心10例(45.5%)、便秘10例(45.5%)、γ-GTP増加7例(31.8%)、倦怠感5例(22.7%)、味覚異常5例(22.7%)、尿中ブドウ糖陽性5例(22.7%)等であった1)。[5.参照]
主要評価項目である5日間連日投与法における奏効率は6.7%(1/15例、95%信頼区間:0.2〜31.9%)であり、95%信頼区間の下限値は閾値奏効率(5%)を下回った。なお、奏効が認められた1例は膵神経内分泌腫瘍患者であり、消化管神経内分泌腫瘍患者では奏効が認められなかった。
副作用(臨床検査値異常を含む)は22例(100%)に認められた。主な副作用は、血管障害(血管痛)13例(59.1%)、悪心10例(45.5%)、便秘10例(45.5%)、γ-GTP増加7例(31.8%)、倦怠感5例(22.7%)、味覚異常5例(22.7%)、尿中ブドウ糖陽性5例(22.7%)等であった1)。[5.参照]
18. 薬効薬理
18.1 作用機序
18.2 抗腫瘍作用
19. 有効成分に関する理化学的知見
19.1. ストレプトゾシン
22. 包装
1.0g[1バイアル]
23. 主要文献
- Izumi K,et al., Jpn J Clin Oncol., 52 (7), 708-16, (2022)
- Adolphe,AB,et al., Cancer Chemother Rep., 59 (3), 547-56, (1975) »PubMed
- Brenna O,et al., Dig.Dis.Sci., 48 (5), 906-10, (2003) »PubMed
- Bolzan AD and Bianchi MS., Mutat.Res., 512 (2-3), 121-34, (2002)
- Bhuyan BK, Cancer Res., 30 (7), 2017-23, (1970) »PubMed
- Bhuyan BK,et al., Cancer Chemother.Rep., 56 (6), 709-20, (1972) »PubMed
- Fraedrich K,et al., Clin.Cancer Res., 18 (17), 4621-32, (2012) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
ノーベルファーマ株式会社
カスタマーセンター
〒104-0033
東京都中央区新川1-17-24
電話:フリーダイヤル:0120-003-140
製品情報問い合わせ先
ノーベルファーマ株式会社
カスタマーセンター
〒104-0033
東京都中央区新川1-17-24
電話:フリーダイヤル:0120-003-140
26. 製造販売業者等
26.1 製造販売元
ノーベルファーマ株式会社
東京都中央区新川1-17-24