医薬品情報
| 総称名 | ジラゼプ塩酸塩 |
|---|---|
| 一般名 | ジラゼプ塩酸塩水和物 |
| 欧文一般名 | Dilazep Hydrochloride Hydrate |
| 製剤名 | ジラゼプ塩酸塩錠 |
| 薬効分類名 | 心・腎疾患治療剤 |
| 薬効分類番号 | 2171 |
| ATCコード | C01DX10 |
| KEGG DRUG |
D02631
ジラゼプ塩酸塩水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年12月 改訂(第1版)

|
4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ジラゼプ塩酸塩錠50mg「サワイ」 (後発品) | DILAZEP HYDROCHLORIDE Tablets[SAWAI] | 沢井製薬 | 2171005F1335 | 5.9円/錠 | 処方箋医薬品注) |
| ジラゼプ塩酸塩錠100mg「サワイ」 (後発品) | DILAZEP HYDROCHLORIDE Tablets[SAWAI] | 沢井製薬 | 2171005F2153 | 6.1円/錠 | 処方箋医薬品注) |
4. 効能または効果
5. 効能または効果に関連する注意
<腎機能障害軽度〜中等度のIgA腎症における尿蛋白減少>
5.1 腎機能障害が軽度〜中等度(クレアチニン・クリアランスとして50mL/min以上)のIgA腎症における尿蛋白減少の目的にのみ使用すること。
5.2 適切な病型診断(腎生検、あるいは血尿、尿蛋白、腎機能等多面的な検査に基づく臨床診断)のもとで使用を開始し、経過を見ながら投与開始後6ヵ月を目標として、尿蛋白・腎機能等を定期的に検査し以後の投薬継続の可否を検討する。病態の急速な進展がみられる場合には中止又は他の療法を考慮するなど適切な処置をとること。尿蛋白減少が認められ、投薬継続が必要な場合は、以後定期的に尿蛋白・腎機能等を測定しながら投薬すること。
6. 用法及び用量
<狭心症、その他の虚血性心疾患(心筋梗塞を除く)>
1回ジラゼプ塩酸塩水和物として50mgを1日3回経口投与する。年齢及び症状により適宜増減する。
<腎機能障害軽度〜中等度のIgA腎症における尿蛋白減少>
1回ジラゼプ塩酸塩水和物として100mgを1日3回経口投与する。年齢及び症状により適宜増減する。
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
副作用として一過性のALT上昇が報告されているため、肝機能障害を悪化させるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、投与しないことが望ましい。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット:静脈内投与)で乳汁中へ移行することが報告されている。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下している。
11. 副作用
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | |
| 精神神経系 | 頭痛、頭重感 | めまい、ふらつき、不眠、いらいら感、眠気 |
| 循環器 | 動悸、頻脈、熱感、顔面潮紅感、胸部圧迫感、胸部違和感、起立性低血圧 | |
| 消化器 | 悪心・嘔吐、便秘、腹痛、下痢、軟便、食欲不振、口渇 | |
| 過敏症 | 発疹、そう痒感、紅斑 | |
| 肝臓 | 一過性のALT上昇 | |
| 血液 | 白血球増多 | |
| 感覚器 | 苦味感 | |
| その他 | 易疲労感、喉頭部息づまり感、発汗、手指の張る感じ、肩こり |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 生物学的同等性試験
<ジラゼプ塩酸塩錠50mg「サワイ」>
ジラゼプ塩酸塩錠50mg「サワイ」とコメリアンコーワ錠50を健康成人男子にそれぞれ1錠(ジラゼプ塩酸塩水和物として50mg)空腹時単回経口投与(クロスオーバー法)し、血中ジラゼプ濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された1)。
| Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | AUC0-8hr(ng・hr/mL) | |
| ジラゼプ塩酸塩錠50mg「サワイ」 | 29.02±10.77 | 0.8±0.2 | 3.4±0.7 | 84.95±31.30 |
| コメリアンコーワ錠50 | 29.15±8.02 | 0.7±0.2 | 3.5±0.7 | 80.09±22.65 |
<ジラゼプ塩酸塩錠100mg「サワイ」>
ジラゼプ塩酸塩錠100mg「サワイ」とコメリアンコーワ錠50を健康成人男子にそれぞれジラゼプ塩酸塩水和物として100mg空腹時単回経口投与(クロスオーバー法)し、血中ジラゼプ濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された2)。
| 製剤投与量(ジラゼプ塩酸塩水和物として) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | AUC0-12hr(ng・hr/mL) | |
| ジラゼプ塩酸塩錠100mg「サワイ」 | 1錠(100mg) | 46.96±13.38 | 0.8±0.2 | 4.0±0.4 | 141.52±65.93 |
| コメリアンコーワ錠50 | 2錠(100mg) | 48.20±15.14 | 0.9±0.3 | 4.0±0.5 | 142.23±72.08 |
血中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎疾患患者9例にジラゼプ塩酸塩水和物100mgを1日3回7日間反復経口投与したとき、体内蓄積性は認められなかった3)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<狭心症、その他の虚血性心疾患(心筋梗塞を除く)>
17.1.1 国内臨床試験
労作性狭心症患者96例にジラゼプ塩酸塩水和物50mg(対照薬としてトリメタジジン塩酸塩3mg)を1日3回毎食後6週間経口投与した臨床試験及び狭心症患者111例にジラゼプ塩酸塩水和物50mg(対照薬としてニフェジピン10mg)を1日3回毎食後4週間投与した臨床試験において、狭心発作の緩解・消失、硝酸薬使用量の減少、心電図上の虚血性変化の改善、運動耐容能の増大等に有用性が認められた。トリメタジジン塩酸塩を対照薬とした臨床試験において、副作用はジラゼプ塩酸塩水和物投与時に1/47例(2.1%)認められ、症状は胃痛であった。ニフェジピンを対照薬とした臨床試験において、副作用はジラゼプ塩酸塩水和物投与時に3/54例(5.6%)認められ、症状はめまい、頭重、顔面紅潮感であった4)5)。
<腎機能障害軽度〜中等度のIgA腎症における尿蛋白減少>
17.1.2 国内臨床試験
プラセボとの二重盲検比較試験で腎機能障害軽度〜中等度のIgA腎症における尿蛋白減少に有用性が認められた6)。
18. 薬効薬理
18.1 作用機序
18.2 血流量増加作用
18.3 抗血小板作用
18.4 赤血球機能・血液流動性の改善作用
18.5 心筋保護作用
18.6 尿蛋白減少作用
19. 有効成分に関する理化学的知見
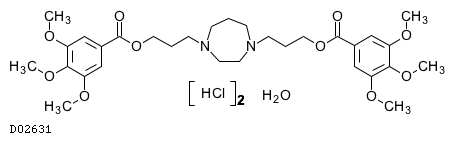
19.1. ジラゼプ塩酸塩水和物
22. 包装
<ジラゼプ塩酸塩錠50mg「サワイ」>
PTP
100錠(10錠×10)
<ジラゼプ塩酸塩錠100mg「サワイ」>
PTP
100錠(10錠×10)
23. 主要文献
- 社内資料:生物学的同等性試験(錠50mg)
- 社内資料:生物学的同等性試験(錠100mg)
- 安部俊男他, 腎と透析, 16, 179-184, (1984)
- 高崎浩他, 臨牀と研究, 54, 3826-3835, (1977)
- 高崎浩他, 臨牀と研究, 54, 2721-2732, (1977)
- 東條静夫他, 腎と透析, 20, 289-313, (1986)
- 佐野宣之他, 基礎と臨床, 8, 1331-1338, (1974)
- 鈴木ひとみ他, 薬理と治療, 10, 2175-2179, (1982)
- Nagase,M.et al, 日本腎臓学会誌, 27, 385-391, (1985) »DOI
- 阿部博幸, 臨床成人病, 12, 1297-1305, (1982)
- Ashikawa,K.et al., Circ.Res., 59, 704-711, (1986) »PubMed
- Nakagawa,Y.et al., Jpn.J.Pharmacol., 29, 271-283, (1979) »PubMed
- Sumiyoshi,A.et al., Thromb.Res., 23, 381-386, (1981) »PubMed
- 竹田晴生他, 動脈硬化, 12, 1007-1012, (1984) »DOI
- 武永美津子他, 動脈硬化, 12, 363-370, (1984) »DOI
- Inage,H.et al., 日本腎臓学会誌, 27, 1253-1260, (1985) »DOI
- Inage,H.et al., 日本腎臓学会誌, 27, 1261-1270, (1985) »DOI
- 葛谷文男, 基礎と臨床, 12, 1949-1952, (1978)
- 小杉功他, 臨牀と研究, 57, 309-312, (1980)
- 山上徹他, 循環器科, 14, 249-256, (1983)
- Shida,H.et al., Arzneimittelforschung, 31, 1902-1906, (1981) »PubMed
- 鈴木秀雄他, 基礎と臨床, 8, 2039-2043, (1974)
- Haga,N.et al., Arzneimittelforschung, 36, 913-916, (1986) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30