医薬品情報
| 総称名 | ロゼックス |
|---|---|
| 一般名 | メトロニダゾール |
| 欧文一般名 | Metronidazole |
| 製剤名 | メトロニダゾール ゲル |
| 薬効分類名 | がん性皮膚潰瘍臭改善薬 酒さ治療薬 |
| 薬効分類番号 | 2699 |
| KEGG DRUG |
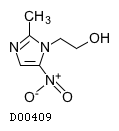
D00409
メトロニダゾール
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年9月 改訂(再審査結果)(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ロゼックスゲル0.75% | Rozex Gel | マルホ | 2699713Q1026 | 71.6円/g |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
○がん性皮膚潰瘍部位の殺菌・臭気の軽減
○酒さ
6. 用法及び用量
<がん性皮膚潰瘍部位の殺菌・臭気の軽減>
症状及び病巣の広さに応じて適量を使用する。潰瘍面を清拭後、1日1〜2回ガーゼ等にのばして貼付するか、患部に直接塗布しその上をガーゼ等で保護する。
<酒さ>
1日2回、患部を洗浄後、適量を塗布する。
7. 用法及び用量に関連する注意
<酒さ>
7.1 本剤の使用期間は通常12週間までとすること。12週間を超えて使用する場合には、その必要性を慎重に判断し、漫然と使用しないこと。国内臨床試験では、12週間の投与による有効性及び安全性が確認されている。
8. 重要な基本的注意
<効能共通>
8.1 本剤の使用中は、日光又は日焼けランプ等による紫外線曝露を避けること。本剤は紫外線照射により不活性体に転換され、効果が減弱することがある。
<がん性皮膚潰瘍部位の殺菌・臭気の軽減>
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 血液疾患のある患者
白血球減少、好中球減少があらわれることがある。
9.1.2 脳・脊髄腫瘍の患者
中枢神経系症状があらわれることがある。
9.5 妊婦
9.6 授乳婦
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| アルコール | 精神症状、腹部の疝痛、嘔吐、潮紅があらわれることがあるので、使用期間中は飲酒を避けること。 | 本剤はアルコールの代謝過程においてアルデヒド脱水素酵素を阻害し、血中アセトアルデヒド濃度を上昇させる。 |
| リトナビル含有製剤(内用液) | ジスルフィラム−アルコール反応を起こすおそれがある。 | リトナビル含有製剤(内用液)はエタノールを含有するので本剤により血中アセトアルデヒド濃度を上昇させる。 |
| ジスルフィラム | 精神症状(錯乱等)があらわれることがある。 | 不明 |
| クマリン系抗凝血剤 ワルファリン等 | ワルファリンの抗凝血作用を増強し、出血等があらわれることがある。 | 本剤はワルファリンの代謝を阻害し、その血中濃度を上昇させる。 |
| リチウム | リチウムの血中濃度が上昇し、リチウム中毒があらわれることがある。 | 不明 |
| 5-フルオロウラシル | 5-フルオロウラシルの血中濃度が上昇し、5-フルオロウラシルの作用が増強することがある。 | 発現機序の詳細は不明であるが、本剤が5-フルオロウラシルの全身クリアランスを低下させる。 |
| ブスルファン | ブスルファンの作用が増強されることがある。 | 本剤はブスルファンの血中濃度を上昇させる。 |
| シクロスポリン | シクロスポリンの作用が増強される可能性がある。 | 本剤はシクロスポリンの血中濃度を上昇させる。 |
| フェノバルビタール | 本剤の作用が減弱する可能性がある。 | フェノバルビタールは本剤の代謝酵素を誘導し、その血中濃度を低下させる。 |
11. 副作用
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 皮膚 | 潰瘍部位からの出血(9.5%)注) | 接触皮膚炎、乾燥、そう痒、つっぱり感、皮脂欠乏症 | 紅斑、皮膚不快感(皮膚灼熱感、皮膚疼痛、皮膚刺痛)、皮膚刺激、皮膚剥脱、顔面腫脹 |
| 神経系 | 末梢神経障害(四肢のしびれ、感覚鈍麻、錯感覚等)、味覚異常(金属味) | ||
| 胃腸障害 | 悪心 | ||
| 過敏症 | 蕁麻疹、血管浮腫 |
14. 適用上の注意
14.1 薬剤交付時の注意
<効能共通>
14.1.1 刺激感を伴う皮膚症状が認められた場合は、使用回数を減らす又は一時的に本剤の使用を中止し、必要に応じ医師の指示を受けるよう患者に指導すること。
14.2 薬剤使用時の注意
<がん性皮膚潰瘍部位の殺菌・臭気の軽減>
14.2.1 ガーゼ等の交換時に患部を刺激することにより、潰瘍部位の血管が損傷し、出血を招くことがあるので、浸潤させる等本剤塗布部位の乾燥に注意すること。
15. その他の注意
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 がん性皮膚潰瘍に伴う臭気を有する患者20例に1日最大30g(メトロニダゾールとして225mg)を7日間潰瘍部位に塗布後の平均最高血漿中濃度は852ng/mL(範囲:136〜2872ng/mL)であり、血漿中トラフ濃度(平均値±標準偏差)は投与7日目で380±281ng/mL、14日目で510±565ng/mLであった6)。[8.2参照]
16.1.2 酒さ患者65例に1日2回(朝及び夜)12週間投与したとき、血漿中にメトロニダゾールが検出された患者における血漿中トラフ濃度(平均値±標準偏差)は投与4週後で33±22ng/mL(59例)、投与12週後で31±18ng/mL(58例)であった7)。
16.2 吸収
経口剤に対する相対的バイオアベイラビリティは、41.2%であった8)(外国人データ)。
16.3 分布
16.3.1 組織分布
16.3.2 胎児への移行
16.3.3 母乳中への移行
16.4 代謝
主として肝臓で代謝される。
尿中に排泄されたニトロ基を含む代謝物中、未変化のメトロニダゾール及びそのグルクロン酸抱合体が30〜40%を占め、1-(2-ヒドロキシエチル)-2-ヒドロキシメチル-5-ニトロイミダゾール及びそのグルクロン酸抱合体が主代謝物で40〜50%を占めた13)(外国人データ)。
尿中に排泄されたニトロ基を含む代謝物中、未変化のメトロニダゾール及びそのグルクロン酸抱合体が30〜40%を占め、1-(2-ヒドロキシエチル)-2-ヒドロキシメチル-5-ニトロイミダゾール及びそのグルクロン酸抱合体が主代謝物で40〜50%を占めた13)(外国人データ)。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
<がん性皮膚潰瘍部位の殺菌・臭気の軽減>
17.1.1 国内第III相臨床試験
がん性皮膚潰瘍に伴う臭気を有する患者を対象に本剤1日最大30gを14日間投与した。その結果6)、改善率(「においがない」又は「においがあるが不快ではない」にまで改善した割合)は95.2%(21例中20例)であり、90%信頼区間(正確法)は79.3〜99.8%であった。
安全性評価対象例21例中2例(9.5%)に潰瘍部位からの出血の副作用が認められた。
安全性評価対象例21例中2例(9.5%)に潰瘍部位からの出血の副作用が認められた。
<酒さ>
17.1.2 国内第III相臨床試験
酒さに伴う炎症性皮疹(丘疹・膿疱)及び紅斑を有する患者注1)130例(各群:65例)を対象に、本剤又はプラセボを1日2回(朝及び夜)12週間投与した二重盲検比較試験を実施した7)。主要評価項目である投与12週後の炎症性皮疹数の変化率スコア及び紅斑重症度の変化スコアがともに3以上注2)の被験者の割合は、次のとおりであった。
本剤群の安全性評価対象例65例中6例(9.2%)に副作用が認められた。その内訳は接触皮膚炎が2例(3.1%)、適用部位乾燥、そう痒症、皮膚のつっぱり感、皮脂欠乏症が各1例(1.5%)であった。
本剤群の安全性評価対象例65例中6例(9.2%)に副作用が認められた。その内訳は接触皮膚炎が2例(3.1%)、適用部位乾燥、そう痒症、皮膚のつっぱり感、皮脂欠乏症が各1例(1.5%)であった。
| 有効性評価項目 | 投与群 | 被験者の割合 (例数) | プラセボ群との群間差a) | |
| 群間差 [両側95%信頼区間] | P値 | |||
| 炎症性皮疹数の変化率スコア及び紅斑重症度の変化スコアがともに3以上の被験者の割合 | 本剤群 | 72.3%(47/65) | 35.4% [17.9%〜51.3%] | <0.0001 |
| プラセボ群 | 36.9%(24/65) | − | − | |
17.2 製造販売後調査等
<がん性皮膚潰瘍部位の殺菌・臭気の軽減>
17.2.1 国内使用成績調査
有効性解析対象症例において、最終観察時(本剤使用開始から最大3ヵ月後)のにおい改善率(医師の評価が「においがない」又は「においはあるが不快でない」となった症例の割合)は80.2%(203/253例)であった。
安全性解析対象症例301例中10例(3.3%)に副作用が認められた。その内訳は適用部位出血6例(2.0%)、適用部位疼痛3例(1.0%)、適用部位乾燥、滲出液が各1例(0.3%)であった15)。
安全性解析対象症例301例中10例(3.3%)に副作用が認められた。その内訳は適用部位出血6例(2.0%)、適用部位疼痛3例(1.0%)、適用部位乾燥、滲出液が各1例(0.3%)であった15)。
18. 薬効薬理
18.1 作用機序
<がん性皮膚潰瘍部位の殺菌・臭気の軽減>
<酒さ>
18.2 抗菌作用
メトロニダゾールは、皮膚潰瘍部位において臭気物質(プトレシン、カダベリン)を産生する数種類のグラム陽性及びグラム陰性嫌気性菌に対して抗菌作用を発揮することによってがん性皮膚潰瘍に伴う臭気を軽減する22)。
19. 有効成分に関する理化学的知見
19.1. メトロニダゾール
20. 取扱い上の注意
凍結をさせないこと。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
チューブ
15g×10、50g×1
23. 主要文献
- Grey M.S., J.Obstet.Gynaecol.Br.Commonw., 68 (5), 723-729, (1961)
- Grey M.S.,et al., Br.J.Vener.Dis., 37, 278-279, (1961)
- Rustia M.,et al., J.Natl.Cancer Inst., 48 (3), 721-729, (1972) »PubMed
- Roe F.J.C.,et al., Surgery, 93 (1), 158-164, (1983)
- Rustia M.,et al., J.Natl.Cancer Inst., 63 (3), 863-868, (1979) »PubMed
- Watanabe K.,et al., Support Care Cancer, 24 (6), 2583-2590, (2016) »PubMed
- 社内資料:酒さ患者を対象とした第III相臨床試験(2022年5月26日承認、CTD2.7.6.3)
- 社内資料:海外第I相臨床試験(1.CG.03.SUM.0443試験)(2014年12月26日承認、CTD2.7.6.4)
- Buttar H.S.,et al., Arch.Int.Pharmacodyn., 245, 4-19, (1980) »PubMed
- Buttar H.S., J.Toxicol.Environ.Health, 9, 305-316, (1982) »PubMed
- Placidi G.F.,et al., Arch.Int.Pharmacodyn., 188, 168-179, (1970) »PubMed
- Buttar H.S.,et al., J.Pharm.Pharmacol., 31, 542-544, (1979) »PubMed
- Stambaugh J.E.,et al., J.Pharmacol.Exp.Ther., 161 (2), 373-381, (1968) »PubMed
- Ings R.M.J.,et al., Xenobiotica., 5 (4), 223-235, (1975)
- 社内資料:製造販売後調査結果概要
- Freeman C.D.,et al., Drugs, 54 (5), 679-708, (1997) »PubMed
- Bendesky A.,et al., Mutat.Res., 511, 133-144, (2002) »PubMed
- Miyachi Y.,et al., Br.J.Dermatol., 114 (2), 231-234, (1986) »PubMed
- Akamatsu H.,et al., Arch.Dermatol.Res., 282 (7), 449-454, (1990) »PubMed
- Krehmeier U.,et al., J.Infect.Chemother., 8 (2), 194-197, (2002) »PubMed
- Fararjeh M.,et al., Int.Immunopharmacol., 8 (2), 341-350, (2008) »PubMed
- Paul J.C.,et al., Ostomy Wound Manage., 54 (3), 18-27, (2008) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
マルホ株式会社
製品情報センター
〒531-0071
大阪市北区中津1-11-1
電話:0120-12-2834
製品情報問い合わせ先
マルホ株式会社
製品情報センター
〒531-0071
大阪市北区中津1-11-1
電話:0120-12-2834
26. 製造販売業者等
26.1 製造販売(輸入)
マルホ株式会社
大阪市北区中津1-5-22
26.2 提携
GALDERMA