医薬品情報
| 総称名 | オーファディン |
|---|---|
| 一般名 | ニチシノン |
| 欧文一般名 | Nitisinone |
| 製剤名 | ニチシノンカプセル |
| 薬効分類名 | 高チロシン血症I型治療剤 |
| 薬効分類番号 | 3999 |
| ATCコード | A16AX04 |
| KEGG DRUG |
D05177
ニチシノン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年6月 改訂(再審査結果)(第3版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オーファディンカプセル2mg | Orfadin Capsules 2mg | アステラス製薬 | 3999036M1029 | 4033.3円/カプセル | 劇薬, 処方箋医薬品 |
| オーファディンカプセル5mg | Orfadin Capsules 5mg | アステラス製薬 | 3999036M2025 | 8809.2円/カプセル | 劇薬, 処方箋医薬品 |
| オーファディンカプセル10mg | Orfadin Capsules 10mg | アステラス製薬 | 3999036M3021 | 16060.2円/カプセル | 劇薬, 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、ニチシノンとして1日1mg/kgを2回に分割して経口投与する。
なお、患者の状態に応じて適宜増減するが、1日2mg/kgを上限とする。
なお、患者の状態に応じて適宜増減するが、1日2mg/kgを上限とする。
7. 用法及び用量に関連する注意
7.1 本剤の投与に際しては、定期的に患者の状態を観察し、尿中サクシニルアセトン濃度、肝機能検査値、血中α-フェトプロテイン濃度等を測定し、それらを総合的に考慮して投与量を調節すること。なお、本剤投与開始1カ月後においても尿中サクシニルアセトンが検出される場合には、1日量を1.5mg/kgに増量することを検討すること。
7.2 本剤の有効性と安全性は小児において検討されており、小児及び成人における推奨用量(mg/kg)は同一である。
8. 重要な基本的注意
8.1 本剤による高チロシン血症I型の治療は、高チロシン血症I型により死亡、肝障害、肝がん、腎疾患が発生することが報告されているため、可能な限り早期に開始すること。
8.2 本剤の投与により血漿中チロシン濃度が上昇し、副作用発現リスクが増加するおそれがあるため、本剤投与時には以下の点に留意すること。
・チロシン及びフェニルアラニンを制限した食事療法を行うこと。
・定期的に血漿中チロシン濃度を測定し、血漿中チロシン濃度を500μmol/L未満に保つこと。
・血漿中チロシン濃度が500μmol/Lを超えた場合には、病態の悪化につながるため、血漿中チロシン濃度を低下させることを目的とした本剤の投与中止又は減量は避け、より厳しいチロシン及びフェニルアラニンを制限した食事療法で血漿中チロシン濃度の調整を行うこと。
8.3 血漿中チロシン濃度の上昇によって眼障害があらわれることがあるため、以下の点に留意すること。[11.1.1参照]
・本剤による治療開始前には、眼の細隙灯顕微鏡検査を行うことが望ましい。
・自動車の運転等危険を伴う機械の操作に従事する際に注意するよう患者に十分説明すること。
・患者に対し、眼障害の初期症状を説明し、それらの症状が認められた場合には、直ちに主治医等に相談するよう指導すること。
・眼障害の初期症状が認められた場合には、眼科医を受診させるなど適切な処置を行うこと。また、食事療法の順守を確認し、血漿中チロシン濃度を測定すること。
・患者に自覚症状がない場合があるため、血漿中チロシン濃度のコントロールが不良な場合等、患者の状態に応じて治療開始後も定期的に、眼の細隙灯顕微鏡検査を行うこと。
8.4 高チロシン血症I型の患者においては肝悪性腫瘍が発生することが報告されているため、肝機能検査及び肝画像検査を定期的に行うこと。また、α-フェトプロテイン値の上昇及び肝臓に小結節の所見がみられた患者では、肝悪性腫瘍の検査を行うこと。
8.5 本剤の投与中は血小板数及び白血球数の定期的な検査を行うこと。[11.1.2参照]
9. 特定の背景を有する患者に関する注意
9.4 生殖能を有する者
妊娠する可能性のある女性に投与する場合には、本剤による催奇形性について十分に説明すること。[9.5参照]
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)において、母乳を介した毒性として角膜混濁及び体重減少が報告されている。
10. 相互作用
相互作用序文
薬物代謝酵素用語
CYP2C9
薬物代謝酵素用語
有機アニオントランスポーター1(OAT1)
薬物代謝酵素用語
有機アニオントランスポーター3(OAT3)
薬物代謝酵素用語
CYP3A4
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 眼障害
結膜炎、角膜混濁、角膜炎、羞明、眼痛(各1〜10%未満)、眼瞼炎(0.1〜1%未満)等の眼障害があらわれることがある。異常が認められた場合には、食事療法の順守を確認し、適切な処置を行うこと。[8.3参照]
11.1.2 血小板減少症、白血球減少症、顆粒球減少症(各1〜10%未満)[8.5参照]
11.2 その他の副作用
| 0.1〜1%未満 | |
| 血液及びリンパ系障害 | 白血球増加症 |
| 皮膚及び皮下組織障害 | 剥脱性皮膚炎、紅斑性皮疹、そう痒症 |
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
10例の健康成人男性にニチシノン1mg/kgを空腹時に単回経口投与注)したときの薬物動態パラメータを以下に示す(外国人データ)。
| AUC(μg・h/mL) | Cmax(μg/mL) | Tmax※(h) | t1/2(h) |
| 599±153 | 7.7±1.0 | 2.8(1.7〜11.1) | 54.5±13.0 |
16.1.2 反復投与
日本人の高チロシン血症I型患者1例を含む医師主導型で開始されたNTBC試験において以下の知見が認められた(外国人データ)。
・反復投与後の時期による血中濃度の変動
用量で補正した血中ニチシノン濃度は、投与開始後最初の3年間でほぼ2倍になることが示された。また、3年目以降の上昇率は1年あたり6%程度であり、3年目までの上昇に比べて緩やかであった。
・投与開始年齢の影響
血中ニチシノン濃度に及ぼす投与開始年齢の影響を検討したところ、投与開始年齢が1歳上昇すると血中ニチシノン濃度は1.2〜2μmol/L増加すると考えられた。
・線形性
本剤の投与開始1年後の用量で補正した血中ニチシノン濃度の比較からは、ニチシノンの薬物動態における非線形性は示唆されなかった。
16.3 分布
健康成人男性にニチシノン1mg/kgを空腹時に単回経口投与注)したときの血漿蛋白結合率は、投与後の測定時間(0.25〜24時間)によらずほぼ一定で、96.2%(6例の平均値)であった(外国人データ)。主な結合蛋白はアルブミンであった(in vitro試験)。
16.4 代謝
16.7 薬物相互作用
16.7.1 臨床薬物相互作用試験
併用薬の薬物動態に及ぼす本剤の影響は以下の表に示すとおりである5)(外国人データ)。[10.2参照]
| 併用薬 | 併用薬の用量 | 本剤の用量注) 投与期間 | 例数 | 幾何平均比(90%信頼区間) (併用投与/単独投与) | |
| AUC | Cmax | ||||
| トルブタミド (CYP2C9基質) | 500mg単回 | 80mg/日 16日間 | 18 | 2.31(2.11〜2.53) | 1.16(1.11〜1.21) |
| フロセミド (OAT1/OAT3基質) | 20mg単回 | 80mg/日 15日間 | 18 | 1.72(1.63〜1.81) | 1.12(1.08〜1.15) |
| クロルゾキサゾン (CYP2E1基質) | 250mg単回 | 80mg/日 16日間 | 18 | 0.73(0.67〜0.80) | 0.82(0.67〜0.99) |
| メトプロロール (CYP2D6基質) | 50mg単回 | 80mg/日 16日間 | 18 | 0.95(0.88〜1.03) | 1.06(0.90〜1.25) |
16.7.2 In vitro試験
ニチシノンはCYP2C9を阻害した(IC50=46μmol/L)が、CYP1A2、2C19及び3Aに対しては阻害しなかった。また、ニチシノンはCYP1A2、2B6及び3Aに対して顕著な誘導作用を示さなかった6)。
ニチシノンは有機アニオントランスポーター1(OAT1)及びOAT3を阻害した(IC50=6.87μmol/L及び3.11μmol/L)。P-糖蛋白質(P-gp)、乳癌耐性蛋白質(BCRP)、有機アニオン輸送ポリペプチド1B1(OATP1B1)、OATP1B3及び有機カチオントランスポーター2(OCT2)に対する阻害作用は弱く、臨床用量では阻害しないと考えられた。P-gpの基質ではなかった7)。[10.参照]
ニチシノンは有機アニオントランスポーター1(OAT1)及びOAT3を阻害した(IC50=6.87μmol/L及び3.11μmol/L)。P-糖蛋白質(P-gp)、乳癌耐性蛋白質(BCRP)、有機アニオン輸送ポリペプチド1B1(OATP1B1)、OATP1B3及び有機カチオントランスポーター2(OCT2)に対する阻害作用は弱く、臨床用量では阻害しないと考えられた。P-gpの基質ではなかった7)。[10.参照]
注)本剤の承認された用法及び用量は「通常、ニチシノンとして1日1mg/kgを2回に分割して経口投与する。なお、患者の状態に応じて適宜増減するが、1日2mg/kgを上限とする。」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 海外NTBC試験
日本人の高チロシン血症I型患者1例を含む医師主導型として開始されたNTBC試験は、初回推奨用量は1mg/kg/日(1日2回経口投与)とし、チロシン及びフェニルアラニンを制限した食事療法との併用で行われた非盲検、非対照試験である。食事療法のみの報告値を対照群8)とし、207例を対象に解析したとき顕著な生存率の改善が認められた。
| 治療開始時又は診断時の年齢 | 生存率(%) | |||
| ニチシノンによる治療 | 食事療法のみの対照群※ | |||
| 5年 | 10年 | 5年 | 10年 | |
| <2カ月 | 82 | − | 28 | − |
| >2〜6カ月 | 95 | 95 | 51 | 34 |
| >6カ月 | 92 | 86 | 93 | 59 |
なお、90%以上の患者において本剤投与開始1週間後に尿中サクシニルアセトンの尿中排泄が正常化した。また、食事療法のみによる治療と比較して、肝細胞癌の発生リスクの低下(2.3〜3.7倍)が認められた。治療を早期に開始した場合、肝細胞癌の発生リスクはさらに低下(生後12カ月より前に開始した場合13.5倍)した。
日本人の高チロシン血症I型患者1例を含む医師主導型として開始されたNTBC試験及び海外定期的安全性最新報告等注)における投与期間ごとの報告において、主な副作用として、眼障害、血小板減少症、白血球減少症、顆粒球減少症が認められた。
注)NTBC試験291例、安全性追加報告書(1991年2月〜1997年8月)24例、定期的安全性最新報告97-98(1997年8月〜1998年12月)266例、定期的安全性最新報告99(1999年1月〜1999年12月)282例、定期的安全性最新報告00-01(2000年1月〜2001年4月)318例(なお、投与期間ごとに安全性情報を集計しているため、同じ患者が複数の報告書において調査対象となっている場合がある。)
18. 薬効薬理
18.1 作用機序
遺伝性高チロシン血症I型はチロシン分解経路の最終段階にあるフマリルアセト酢酸ヒドラーゼ(FAH)の遺伝子変異による常染色体劣性遺伝疾患である9)。FAHの活性が低下することにより、チロシン分解経路の中間代謝物であるフマリルアセト酢酸(FAA)及びマレイルアセト酢酸(MAA)、並びにこれらの代謝物であるサクシニルアセトン(SA)及びサクシニルアセト酢酸(SAA)が肝及び腎に蓄積し、これらの臓器に障害が生じると考えられている10)。ニチシノンは、チロシン分解経路においてFAHよりも上流に位置する4-ヒドロキシフェニルピルビン酸ジオキシゲナーゼを阻害することにより、FAA、MAA、SA及びSAAの産生及び蓄積を抑制すると考えられている。
18.2 サクシニルアセトン産生抑制作用
遺伝性高チロシン血症I型患者(乳児及び小児)において、ニチシノンの反復経口投与(0.1〜0.6mg/kg/日)により尿中SA及び血漿中SAが低下することが報告されている11)。
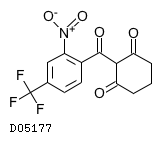
19. 有効成分に関する理化学的知見
19.1. ニチシノン
20. 取扱い上の注意
本品は2〜8℃で保存することにより品質保持をはかっているので、以下の点に注意すること。
・ボトルから取り出した後は、速やかに服用し、速やかにキャップを閉め、冷蔵庫に保管すること。
・凍結を避けること。
22. 包装
<オーファディンカプセル2mg>
60カプセル(ボトル)
<オーファディンカプセル5mg>
60カプセル(ボトル)
<オーファディンカプセル10mg>
60カプセル(ボトル)
23. 主要文献
- Vanclooster,A.et al., JIMD Rep., 5, 27-33, (2012) »PubMed
- Garcia Segarra,N.et al., J.Inherit.Metab.Dis., 33 (3), S507-S510, (2010)
- Kassel,R.et al., J.Pediatr.Gastroenterol.Nutr., 60 (1), e5-e7, (2015)
- Herebian,D.et al., Rapid Commun.Mass Spectrom., 24 (6), 791-800, (2010) »PubMed
- 社内報告書:臨床薬物相互作用試験・ニチシノンのCYP及びトランスポーターに対する阻害作用の評価
- 社内報告書:ニチシノンのCYP分子種に対する阻害及び誘導作用(2014年12月26日承認CTD2.7.2.2.1.3)
- 社内報告書:ニチシノンのトランスポーターに対する阻害作用及び基質評価
- van Spronsen,F.J.et al., Hepatology, 20 (5), 1187-1191, (1994) »PubMed
- Kvittingen,E.A.et al., J.Inherit.Metab.Dis., 14 (4), 554-562, (1991) »PubMed
- Mitchell,G.A.et al., The Metabolic and Molecular Bases of Inherited Disease,7th Ed., 1077-1106, (1995)
- Lindstedt,S.et al., Lancet, 340 (8823), 813-817, (1992) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
アステラス製薬株式会社
メディカルインフォメーションセンター
〒103-8411
東京都中央区日本橋本町2丁目5番1号
電話:フリーダイヤル 0120-189-371
製品情報問い合わせ先
アステラス製薬株式会社
メディカルインフォメーションセンター
〒103-8411
東京都中央区日本橋本町2丁目5番1号
電話:フリーダイヤル 0120-189-371
26. 製造販売業者等
26.1 製造販売
アステラス製薬株式会社
東京都中央区日本橋本町2丁目5番1号