医薬品情報
| 総称名 | オプスミット |
|---|---|
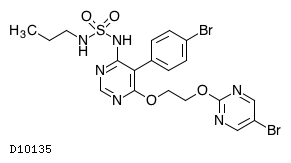
| 一般名 | マシテンタン |
| 欧文一般名 | Macitentan |
| 製剤名 | マシテンタン錠 |
| 薬効分類名 | エンドセリン受容体拮抗薬 |
| 薬効分類番号 | 2190 |
| ATCコード | C02KX04 |
| KEGG DRUG |
D10135
マシテンタン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年8月 改訂(第3版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オプスミット錠10mg | Opsumit 10mg film-coated tablets | ヤンセンファーマ | 2190035F1021 | 13334.9円/錠 | 劇薬, 処方箋医薬品※ |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
5.1 WHO機能分類クラスIにおける有効性及び安全性は確立していない。
5.2 本剤の使用にあたっては、最新の治療ガイドラインを参考に投与の要否を検討すること。
6. 用法及び用量
通常、成人には、マシテンタンとして10mgを1日1回経口投与する。
8. 重要な基本的注意
8.1 他のエンドセリン受容体拮抗薬において肝酵素値上昇が認められているため、肝機能検査を必ず投与開始前に行い、投与中は、必要に応じて肝機能検査を定期的に実施すること。本剤投与中に臨床的に顕著にAST、ALT値が上昇した場合、これら肝酵素値上昇に伴いビリルビン値が基準値上限の2倍を超える場合、又はこれら肝酵素値上昇に伴い黄疸などの肝障害の徴候を伴う場合には、本剤の投与を中止すること。[9.3.2参照]
8.3 本剤の投与により肺水腫の徴候がみられた場合は肺静脈閉塞性疾患の可能性を考慮すること。肺静脈閉塞性疾患が疑われた場合には、本剤の投与を中止すること。[9.1.3参照]
8.4 本剤は血管拡張作用を有するため、本剤の投与に際しては、血管拡張作用により患者が有害な影響を受ける可能性がある状態(降圧剤投与中、安静時低血圧、血液量減少、重度の左室流出路閉塞、自律神経機能障害等)にあるのかを十分検討すること。[9.1.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.2 腎機能障害患者
9.3 肝機能障害患者
9.3.1 重度の肝障害のある患者
9.3.2 投与開始前の肝酵素(AST、ALT)値のいずれか又は両方が基準値上限の3倍を超える患者
9.4 生殖能を有する者
9.5 妊婦
9.6 授乳婦
本剤投与中は授乳しないことが望ましい。動物実験(ラット)では、本剤は乳汁中に移行することが確認されている。また、母動物(ラット)に妊娠17日から分娩後20日まで経口投与した結果、出生児の体重の低値及び死亡の増加が認められている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下していることが多い。
10. 相互作用
相互作用序文
本剤は主にCYP3A4及びCYP2C9により代謝される。[16.4参照]
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2C9
10.1 併用禁忌
10.2 併用注意
| 強いCYP3A4阻害剤 ケトコナゾール注) HIV感染症治療薬(リトナビル等) [16.7.3参照] | 本剤の血中濃度が上昇し、本剤の副作用が発現しやすくなるおそれがある。 | 強いCYP3A4阻害作用により、本剤の曝露量を増加させる。 |
| 中程度のCYP3A4阻害作用かつ中程度のCYP2C9阻害作用を有する薬剤 フルコナゾール [16.7.6参照] | 本剤の血中濃度が上昇し、本剤の副作用が発現しやすくなるおそれがある。 | CYP3A4阻害作用及びCYP2C9阻害作用により、本剤の曝露量を増加させる可能性がある。 |
| CYP3A4誘導剤 エファビレンツ、モダフィニル、ルフィナミド等 | 本剤の血中濃度が低下し、本剤の効果が減弱するおそれがある。 | CYP3A4誘導作用により、本剤の曝露量を減少させる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 貧血(4.0%)
11.2 その他の副作用
| 5%以上 | 0.5%以上5%未満 | 頻度不明 | |
| 血液及びリンパ系障害 | 血小板減少 | ||
| 免疫系障害 | 過敏症(皮疹、蕁麻疹、血管浮腫) | ||
| 神経系障害 | 頭痛 | 片頭痛、浮動性めまい | |
| 血管障害 | 潮紅、低血圧 | ||
| 呼吸器、胸郭及び縦隔障害 | 鼻閉、呼吸困難 | ||
| 胃腸障害 | 悪心/嘔吐、腹痛、下痢 | ||
| 皮膚及び皮下組織障害 | そう痒症/発疹 | ||
| 生殖系および乳房障害 | 子宮出血増加(月経中間期出血、重度月経出血、不規則月経等) | ||
| 一般・全身障害 | 浮腫、末梢性浮腫、顔面浮腫、胸痛 | ||
| 臨床検査 | 肝機能検査異常、ALT増加、AST増加、ヘマトクリット減少、ヘモグロビン減少 | 白血球数減少 |
13. 過量投与
13.1 症状
外国において、健康男性にマシテンタン600mgを単回経口投与した時、主な有害事象は、頭痛、悪心、嘔吐であった。
13.2 処置
マシテンタンは血漿タンパクとの親和性が高く、透析により除去できないと考えられる。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。
PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することがある。
PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 海外臨床試験において、月経障害、卵巣嚢胞、白血球減少症及び白血球減少に関する有害事象がプラセボ群では1.1%(2/184例)、0.0%(0/184例)、1.6%(4/249例)及び0.0%(0/249例)であったのに対し、マシテンタン10mg投与では5.1%(10/194例)、1.5%(3/194例)、2.5%(6/242例)及び0.8%(2/242例)であり、プラセボに比べ、マシテンタンで多く報告された。
15.1.2 関連性は明確ではないが本剤投与後に精子数減少をみとめた症例が報告されており、本剤はヒトの精子形成に影響を及ぼすおそれがある。なお、他のエンドセリン受容体拮抗薬を服用した患者においても精子数減少が報告されている。
15.2 非臨床試験に基づく情報
ラット及びイヌの反復投与毒性試験において、精細管萎縮又は拡張が認められた。ラットの反復投与毒性試験において、可逆的な異常精子の割合の増加が認められた。イヌの反復投与毒性試験において、精子形成の低下が認められた。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人及び白人健康成人にマシテンタン10mgを単回経口投与した時、マシテンタンは速やかに吸収され、投与後5時間後に最高血漿中濃度(Cmax)に達した。活性代謝物は36時間後に達した。マシテンタン及び活性代謝物の血漿中濃度推移及び薬物動態パラメータは以下のとおりであり、日本人と白人で大きく異ならなかった1)。
健康成人にマシテンタン10mgを単回経口投与した時の血漿中濃度推移
| Cmax(ng/mL) | tmax(h) | AUC0-∞(ng・h/mL) | t1/2(h) | |
| 日本人 | ||||
| マシテンタン | 239(210,272) | 5.0(5.0-10.0) | 5664(5232,6132) | 12.4(10.5,14.7) |
| 活性代謝物 | 242(218,270) | 36.0(36.0-36.0) | 22936(20828,25257) | 41.4(38.5,44.5) |
| 白人 | ||||
| マシテンタン | 224(193,260) | 8.5(5.3-12.0) | 6665(5326,8340) | 13.8(11.3,17.0) |
| 活性代謝物 | 237(197,284) | 36.0(36.0-48.0) | 26934(22513,32224) | 52.6(47.8,57.9) |
16.1.2 反復投与
健康成人にマシテンタン10mgを10日間反復経口投与した時、マシテンタン及び活性代謝物の薬物動態パラメータは以下のとおりである2)。
| Cmax(ng/mL) | tmax(h) | AUC0-24(ng・h/mL) | t1/2(h) | |
| マシテンタン | ||||
| Day1 | 193.4(141.0,265.3) | 6.00(5.00-8.00) | 2802.4(2195.1,3577.7) | − |
| Day10 | 291.2(220.1,385.3) | 5.00(5.00-10.00) | 4190.1(3426.2,5124.5) | 11.1(8.8,13.9) |
| 活性代謝物 | ||||
| Day1 | 173.4(109.7,273.9) | 24.00(16.00-24.00) | 2562.1(1619.3,4054.0) | − |
| Day10 | 879.2(780.5,990.3) | 8.50(4.00-16.00) | 18684.1(15971.9,21856.9) | 46.6(41.7,52.1) |
肺動脈性肺高血圧症患者20例にマシテンタン10mgを1日1回少なくとも4週間以上反復経口投与した時、マシテンタン及び活性代謝物の血漿中濃度推移及び薬物動態パラメータは以下のとおりである3)(外国人データ)。
肺動脈性肺高血圧症患者にマシテンタン10mgを反復経口投与した時の血漿中濃度推移
| Cmax(ng/mL) | tmax(h) | AUC0-24(ng・h/mL) | |
| マシテンタン | 402.4(337.7,479.4) | 6.5(5.0-14.0) | 6613.3(5440.4,8038.9) |
| 活性代謝物 | 998.6(877.6,1136.4) | 6.5(5.0-24.0) | 20367.4(17734.8,23390.8) |
16.2 吸収
16.2.1 食事の影響
健康成人10例にマシテンタン10mgを空腹時又は食後に単回経口投与した時、食後投与時のマシテンタン及び活性代謝物のAUC0-∞、Cmaxは空腹時投与と同様であり、食事の影響は認められなかった6)(外国人データ)。
16.3 分布
16.3.1 タンパク結合率
血漿タンパク結合率は、マシテンタンは99%以上、活性代謝物は99.5%であり、主にアルブミン及びα1-酸性糖タンパク質と結合する7)。
16.4 代謝
本剤の主要な代謝はCYP酵素、主にCYP3A4及びCYP2Cファミリー(CYP2C8、CYP2C9及びCYP2C19)による。活性代謝物の生成は主にCYP3A4によるものであり、CYP2C8、CYP2C9及びCYP2C19の関与はわずかであった。薬理活性を有さない代謝物の生成は主にCYP2C9によるものであり、CYP2C8、CYP2C19及びCYP3A4の関与はわずかであった。[10.参照]
16.5 排泄
健康成人6例に14C-マシテンタン10mgを単回経口投与した時、投与後14日間までの放射能回収率は、尿中49.7%、糞中23.9%であった。尿中にマシテンタン及び活性代謝物は排泄されなかった8)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 高齢者での体内動態
高齢者でのマシテンタンの薬物動態は検討されていない。
肺動脈性肺高血圧症患者にマシテンタン10mgを24週間経口投与した時、年齢の増加に伴いマシテンタン及び活性代謝物のトラフ時血漿中濃度が高くなる傾向が認められた9)(外国人データ)。
肺動脈性肺高血圧症患者にマシテンタン10mgを24週間経口投与した時、年齢の増加に伴いマシテンタン及び活性代謝物のトラフ時血漿中濃度が高くなる傾向が認められた9)(外国人データ)。
16.6.2 肝機能障害患者における体内動態
16.6.3 腎機能障害患者における体内動態
16.7 薬物相互作用
16.7.1 ワルファリン
健康成人14例に、マシテンタン10mgとワルファリン25mgを併用投与した時、マシテンタンの薬物動態にワルファリンは影響を与えなかった。また、マシテンタンはワルファリンの薬物動態に影響を与えなかった11)(外国人データ)。
16.7.2 シルデナフィル
健康成人12例に、マシテンタン10mgとシルデナフィル20mgを併用投与した時、マシテンタンの薬物動態にシルデナフィルは影響を与えなかった。また、マシテンタンはシルデナフィルの薬物動態に影響を与えなかった12)(外国人データ)。
16.7.3 ケトコナゾール
16.7.4 シクロスポリン
健康成人10例に、マシテンタン10mg反復投与時にシクロスポリン100mgを併用した結果、マシテンタンのAUCτ及びCtroughはそれぞれ10%及び38%増加したが、活性代謝物のAUCτ及びCtroughに対する影響は認められなかった14)(外国人データ)。
16.7.5 リファンピシン
16.7.6 フルコナゾール
生理学的薬物動態モデルによる解析の結果、マシテンタン10mg単剤投与時に比べてフルコナゾール400mg/日の併用時では、マシテンタンのAUC及びCmaxがそれぞれ約3.8倍及び約1.3倍になることが推定された。活性代謝物のAUC及びCmaxはそれぞれ約1.0倍及び約0.6倍になることが推定された。[10.2参照]
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II/III相試験
肺動脈性肺高血圧症患者30例を対象に、マシテンタン10mgを1日1回24週間投与した結果、肺血管抵抗では、ベースラインと比べて39.5%低下し、投与前後で有意な改善が認められた。さらに、6分間歩行距離、WHO機能分類がベースラインから改善した。
| マシテンタン10mg | |
| 肺血管抵抗 | n=28 |
| 平均値±標準偏差(dyn・sec/cm5) | −250±230 |
| 変化率注) | 60.5 |
| 幾何平均値(95%信頼区間)(%) | (52.4,69.9) |
| 6分間歩行距離 | n=30 |
| 平均値±標準偏差(m) | 66±81 |
| WHO機能分類の改善 | 13例/30例(43.3%) |
17.1.2 海外第III相試験
肺動脈性肺高血圧症患者742例に、プラセボ、マシテンタン3mg又は10mgを盲検下長期投与するプラセボ対照第III相試験を実施した。
最初のmorbidity/mortality注)の発現のプラセボに対するハザード比は、マシテンタン10mgでは0.547(97.5%信頼区間:0.392〜0.762、logrank p<0.0001)であり、マシテンタン10mgの投与で45%のmorbidity/mortalityイベント発現リスク減少効果が認められた。
最初のmorbidity/mortality注)の発現のプラセボに対するハザード比は、マシテンタン10mgでは0.547(97.5%信頼区間:0.392〜0.762、logrank p<0.0001)であり、マシテンタン10mgの投与で45%のmorbidity/mortalityイベント発現リスク減少効果が認められた。
最初に起こったmorbidity/mortalityのKaplan-Meier曲線
注)morbidity/mortalityの定義:死亡、重大な合併症イベント(心房中隔切開術、肺移植、プロスタノイドの静脈内投与又は皮下投与の開始)又は、その他の肺動脈性肺高血圧症悪化(次のすべてを満たす:6分間歩行距離が投与前から15%以上短縮、肺動脈性肺高血圧症の症状の悪化、追加的な肺動脈性肺高血圧症治療薬の開始)
さらに、表に示すとおり投与6ヵ月後に肺血管抵抗、6分間歩行距離及びWHO機能分類の改善が認められた。
| プラセボ | マシテンタン10mg | |
| 肺血管抵抗 | n=50 | n=48 |
| 平均値±標準偏差(dyn・sec/cm5) | 156±353 | −226±395 |
| 変化率注1) | 115.8 | 71.3 |
| 幾何平均値(95%信頼区間)(%) | (104.7,128.1) | (62.4,81.4) |
| 6分間歩行距離 | n=249 | n=242 |
| 平均値±標準偏差(m) | −9.4±100.59 | 12.5±83.54 |
| 治療効果注2) | − | 22.0 |
| WHO機能分類の改善 | 32例/249例(12.9%) | 54例/242例(22.3%) |
| 治療効果注3) | − | 1.74 |
18. 薬効薬理
18.1 作用機序
18.2 血管収縮の阻害
マシテンタンはラットから摘出した内皮剥離大動脈のエンドセリン(ET)-1刺激誘発収縮(ETA受容体媒介性)及び上皮剥離気管のサラフォトキシンS6c刺激誘発収縮(ETB受容体媒介性)を阻害し、そのpA2値はそれぞれ7.6±0.2(ETA受容体)及び5.9±0.2(ETB受容体)であった17)。
18.3 病態モデルに対する作用
19. 有効成分に関する理化学的知見
19.1. マシテンタン
22. 包装
30錠[15錠(PTP)×2]
23. 主要文献
- Bruderer S, et al., Pharmacology., 91 (5-6), 331-338, (2013) »PubMed
- 社内資料:日本人健康成人男性を対象とした薬物動態試験(2015年3月26日承認、CTD2.7.6.2)
- 社内資料:肺動脈性肺高血圧症患者を対象とした継続投与試験(2015年3月26日承認、CTD2.7.6.2)
- 社内資料:日本人肺動脈性肺高血圧症患者を対象とした第II/III相試験(2015年3月26日承認、CTD2.7.6.2)
- Tahara N, et al., Circ J., 80, 1478-1483, (2016) »PubMed
- 社内資料:健康成人男性を対象とした食事の影響の検討(2015年3月26日承認、CTD2.7.6.2)
- 社内資料:血漿タンパク結合及び赤血球中への移行の検討(2015年3月26日承認、CTD2.7.2.3)
- Bruderer S, et al., Xenobiotica., 42, 901-910, (2012) »PubMed
- 社内資料:血漿中濃度に及ぼす年齢の影響(2015年3月26日承認、CTD2.7.2.3)
- Sidharta PN, et al., J Clin Pharmacol., 54 (3), 291-300, (2014) »PubMed
- 社内資料:健康成人男性を対象としたワルファリンとの薬物相互作用の検討(2015年3月26日承認、CTD2.7.6.2)
- 社内資料:健康成人男性を対象としたシルデナフィルとの薬物相互作用の検討(2015年3月26日承認、CTD2.7.6.2)
- Atsmon J, et al., Clin Pharmacokinet., 52 (8), 685-692, (2013) »PubMed
- Bruderer S, et al., AAPS J., 14, 68-78, (2012) »PubMed
- 社内資料:肺動脈性肺高血圧症患者を対象とした第III相試験(2015年3月26日承認、CTD2.7.6.2)
- Pulido T, et al., NEJM., 369, 809-818, (2013) »PubMed
- Iglarz M, et al., JPET., 327, 736-745, (2008)
- 社内資料:ET受容体へのET-1結合試験(2015年3月26日承認、CTD2.6.2.2)
- 社内資料:モノクロタリン誘発肺高血圧ラットモデルを用いた検討(2015年3月26日承認、CTD2.6.2.2)
- 社内資料:高血圧ラットモデルを用いた検討(2015年3月26日承認、CTD2.6.2.2)
- 社内資料:ブレオマイシン誘発肺線維症ラットモデルを用いた検討(2015年3月26日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
ヤンセンファーマ株式会社
メディカルインフォメーションセンター
〒101-0065
東京都千代田区西神田3-5-2
電話:フリーダイヤル 0120-183-275
製品情報問い合わせ先
ヤンセンファーマ株式会社
メディカルインフォメーションセンター
〒101-0065
東京都千代田区西神田3-5-2
電話:フリーダイヤル 0120-183-275
26. 製造販売業者等
26.1 製造販売元(輸入)
ヤンセンファーマ株式会社
〒101-0065
東京都千代田区西神田3-5-2
26.2 販売提携先
日本新薬株式会社
京都市南区吉祥院西ノ庄門口町14