医薬品情報
| 総称名 | ポマリスト |
|---|---|
| 一般名 | ポマリドミド |
| 欧文一般名 | Pomalidomide |
| 製剤名 | ポマリドミドカプセル |
| 薬効分類名 | 抗造血器悪性腫瘍剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L04AX06 |
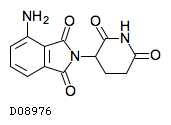
| KEGG DRUG |
D08976
ポマリドミド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年4月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ポマリストカプセル1mg | Pomalyst Capsules | ブリストル・マイヤーズスクイブ | 4291038M1026 | 36902円/カプセル | 毒薬, 処方箋医薬品注) |
| ポマリストカプセル2mg | Pomalyst Capsules | ブリストル・マイヤーズスクイブ | 4291038M2022 | 43981.4円/カプセル | 毒薬, 処方箋医薬品注) |
| ポマリストカプセル3mg | Pomalyst Capsules | ブリストル・マイヤーズスクイブ | 4291038M3029 | 48736.5円/カプセル | 毒薬, 処方箋医薬品注) |
| ポマリストカプセル4mg | Pomalyst Capsules | ブリストル・マイヤーズスクイブ | 4291038M4025 | 52418.9円/カプセル | 毒薬, 処方箋医薬品注) |
1. 警告
1.2 本剤の胎児への曝露を避けるため、本剤の使用については、適正管理手順(以下、「本手順」)が定められているので、関係企業、医師、薬剤師等の医療関係者、患者やその家族等の全ての関係者が本手順を遵守すること1)。[2.2、9.5参照]
1.3 妊娠する可能性のある女性に投与する場合は、投与開始前に妊娠検査を行い、陰性であることを確認した上で投与を開始すること。また、投与開始予定4週間前から投与終了4週間後まで、性交渉を行う場合はパートナーと共に極めて有効な避妊法の実施を徹底(男性は必ずコンドームを着用)させ、避妊を遵守していることを十分に確認するとともに定期的に妊娠検査を行うこと。なお、本剤の投与期間中に妊娠が疑われる場合には、直ちに本剤の投与を中止し、医師等に連絡するよう患者を指導すること。[9.4.1、9.5参照]
1.4 本剤は精液中へ移行することから、投与終了4週間後まで、性交渉を行う場合は極めて有効な避妊法の実施を徹底(男性は必ずコンドームを着用)させ、避妊を遵守していることを十分に確認すること。また、この期間中は妊婦との性交渉は行わせないこと。[9.4.2、16.3参照]
1.5 本剤の投与は、緊急時に十分対応できる医療施設において、造血器悪性腫瘍の治療に対して十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される患者のみに行うこと。また、治療開始に先立ち、患者又はその家族等に有効性及び危険性(胎児への曝露の危険性を含む)を十分に説明し、文書で同意を得てから投与を開始すること。
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
再発又は難治性の多発性骨髄腫
5. 効能または効果に関連する注意
5.1 本剤による治療は、少なくとも1つの標準的な治療が無効又は治療後に再発した患者を対象とすること。
6. 用法及び用量
<デキサメタゾン併用>
通常、成人にはポマリドミドとして1日1回4mgを21日間連日経口投与した後、7日間休薬する。これを1サイクルとして投与を繰り返す。なお、患者の状態により適宜減量する。
<ボルテゾミブ及びデキサメタゾン併用>
通常、成人にはポマリドミドとして1日1回4mgを14日間連日経口投与した後、7日間休薬する。これを1サイクルとして投与を繰り返す。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意
7.2 本剤投与により副作用が発現した場合には、下表を参考に本剤の休薬等を考慮すること。[8.2、9.1.2、11.1.3参照]
| 副作用 | 程度 | 処置 |
| 血小板減少 | 25,000/μL未満に減少 | 50,000/μL以上に回復するまで本剤を休薬し、再開は休薬前の投与量から1mg減量すること。 再開した後に再び発現した場合も同様とし、1mgに減量した後に再び副作用が発現した場合には、本剤の投与を中止すること。 |
| 好中球減少 | 500/μL未満に減少 又は 発熱性好中球減少症(好中球数が1,000/μL未満で、かつ1回でも38.3℃を超える又は1時間を超えて持続する38℃以上の発熱) | 1,000/μL以上に回復するまで本剤を休薬し、再開は休薬前の投与量から1mg減量すること。 G-CSF製剤を使用していない場合には、使用について考慮すること。 再開した後に再び発現した場合も同様とし、1mgに減量した後に再び副作用が発現した場合には、本剤の投与を中止すること。 |
| 皮疹注) | Grade 3 | Grade 1以下に回復するまで本剤を休薬し、再開は休薬前の投与量から1mg減量すること。なお再開は、患者の状態に応じて判断すること。 再開した後に再び発現した場合も同様とし、1mgに減量した後に再び副作用が発現した場合には、本剤の投与を中止すること。 |
| Grade 4又は水疱形成 | 本剤の投与を中止すること。 | |
| 上記以外の副作用注) | Grade 3又は4 | Grade 2以下に回復するまで本剤を休薬し、再開は休薬前の投与量から1mg減量すること。なお再開は、患者の状態に応じて判断すること。 再開した後に再び発現した場合も同様とし、1mgに減量した後に再び副作用が発現した場合には、本剤の投与を中止すること。 |
8. 重要な基本的注意
8.1 本剤投与開始から投与中止4週間後までは、献血、精子・精液の提供をさせないこと。[16.3参照]
8.2 本剤の投与により重篤な好中球減少症及び血小板減少症等の骨髄抑制が発現することがあるため、定期的に血液学的検査を行うこと。また、本剤の投与にあたっては、G-CSF製剤の適切な使用も考慮すること。[7.2、9.1.2、11.1.3参照]
8.3 海外臨床試験において、傾眠、錯乱、疲労、意識レベルの低下、めまいが報告されているので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作を避けるよう注意すること。
8.4 急性腎障害が発現することがあるため、定期的に血清クレアチニン、BUN等の腎機能検査、尿検査及び血液学的検査を行い、患者の状態を十分に観察すること。[11.1.8参照]
8.5 感染症があらわれることがあるので、血液学的検査及び画像検査を行うなど、観察を十分に行うこと。[11.1.4参照]
8.6 腫瘍崩壊症候群があらわれることがあるので、腫瘍量の多い患者では、血清中電解質濃度測定及び腎機能検査を行うなど、患者の状態を十分に観察すること。[11.1.6参照]
8.7 心不全、不整脈があらわれることがあるので、心機能検査(心エコー、心電図等)を行うなど、観察を十分に行うこと。[11.1.7参照]
8.8 肝機能障害、黄疸があらわれることがあるので、定期的に検査を行うなど、観察を十分に行うこと。[11.1.12参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 深部静脈血栓症のリスクを有する患者
9.1.2 骨髄抑制のある患者
9.1.3 サリドマイド又はレナリドミドによる重篤な過敏症の既往歴のある患者
9.2 腎機能障害患者
[16.6.1参照]
9.3 肝機能障害患者
[16.6.2参照]
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性には、本剤投与開始4週間前及び本剤投与開始3日前から投与開始直前までに妊娠検査を実施し、妊娠していないことを確認後に投与を開始すること。また、本剤の治療中は4週間を超えない間隔で、本剤の投与終了の際は本剤投与終了時及び本剤投与終了4週間後に妊娠検査を実施すること。投与開始予定4週間前から投与終了4週間後まで、性交渉を行う場合はパートナーと共に極めて有効な避妊法の実施を徹底(男性は必ずコンドームを着用)させ、避妊を遵守していることを十分に確認すること。なお、本剤の投与期間中に妊娠が疑われる場合には、直ちに本剤の投与を中止し、医師等に連絡するよう患者を指導すること。[1.3、9.5参照]
9.5 妊婦
9.6 授乳婦
授乳中の女性には投与しないことが望ましいが、やむを得ず投与する場合には授乳を中止させること。ラットで乳汁中に移行することが報告されている3)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
相互作用序文
本剤は主にCYP1A2及びCYP3A4によって代謝される。
薬物代謝酵素用語
CYP1A2
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| CYP1A2阻害剤 フルボキサミンマレイン酸塩、シプロフロキサシン等 [16.7.1、16.7.3参照] | 本剤とCYP1A2阻害剤及びCYP3A4阻害剤との併用により、また、本剤とCYP1A2阻害剤との併用により、本剤の血中濃度が増加したとの報告があるので、併用は避け、代替の治療薬への変更を考慮すること。やむを得ず併用投与する場合には、本剤の減量を考慮するとともに、患者の状態を慎重に観察し、有害事象の発現に十分注意すること。 | 本剤とCYP1A2阻害剤又はCYP3A4阻害剤を併用した場合に、本剤の代謝が阻害されると考えられる。 |
| CYP3A4阻害剤 ケトコナゾール、イトラコナゾール、クラリスロマイシン等 [16.7.2、16.7.3参照] | 本剤とCYP1A2阻害剤及びCYP3A4阻害剤との併用により、また、本剤とCYP1A2阻害剤との併用により、本剤の血中濃度が増加したとの報告があるので、併用は避け、代替の治療薬への変更を考慮すること。やむを得ず併用投与する場合には、本剤の減量を考慮するとともに、患者の状態を慎重に観察し、有害事象の発現に十分注意すること。 | 本剤とCYP1A2阻害剤又はCYP3A4阻害剤を併用した場合に、本剤の代謝が阻害されると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 深部静脈血栓症、肺塞栓症
11.1.2 脳梗塞(0.2%)
11.1.3 骨髄抑制
11.1.4 感染症
肺炎(8.9%)、敗血症(1.6%)等の重篤な感染症があらわれることがある。[8.5参照]
11.1.5 進行性多巣性白質脳症(PML)(頻度不明)
本剤投与中及び投与終了後は患者の状態を十分に観察し、意識障害、認知機能障害、麻痺症状(片麻痺、四肢麻痺)、構音障害、失語等の症状があらわれた場合は、MRIによる画像診断及び脳脊髄液検査を行うとともに、投与を中止し、適切な処置を行うこと。
11.1.6 腫瘍崩壊症候群(0.2%)
異常が認められた場合には直ちに投与を中止し、適切な処置を行い、症状が回復するまで患者の状態を十分に観察すること。[8.6参照]
11.1.7 心不全、不整脈
心不全(0.4%)、心房細動(0.8%)、頻脈性不整脈(0.1%)等があらわれることがある。[8.7参照]
11.1.8 急性腎障害(0.3%)
急性腎障害等の腎障害があらわれることがある。[8.4参照]
11.1.9 過敏症
血管浮腫(頻度不明)、発疹(5.6%)、蕁麻疹(0.2%)等の過敏症があらわれることがある。
11.1.10 末梢神経障害
末梢性感覚ニューロパチー(7.2%)、末梢性ニューロパチー(0.7%)、多発ニューロパチー(0.6%)等の末梢神経障害があらわれることがある。
11.1.11 間質性肺疾患(頻度不明)
11.1.12 肝機能障害、黄疸(頻度不明)
AST、ALT、γ-GTP、ビリルビン上昇等を伴う肝機能障害、黄疸があらわれることがある。[8.8参照]
11.1.13 催奇形性(頻度不明)
妊婦又は妊娠している可能性のある女性には投与しないこと。[9.5参照]
11.2 その他の副作用
| 10%以上 | 5〜10%未満 | 5%未満 | 頻度不明 | |
| 消化器 | 便秘 | 下痢 | 悪心、口内炎、腹痛、口内乾燥、嘔吐、腹部膨満、上腹部痛、痔出血 | 胃腸出血 |
| 循環器 | 低血圧、高血圧 | |||
| 呼吸器 | 呼吸困難、咳嗽、労作性呼吸困難、鼻出血、口腔咽頭痛、発声障害 | |||
| 筋骨格 | 筋痙縮 | 筋力低下、四肢痛、筋肉痛、背部痛、骨痛 | ||
| 代謝 | 食欲減退、低カリウム血症、低アルブミン血症、低リン酸血症、低カルシウム血症、低ナトリウム血症、高血糖、低マグネシウム血症、高カリウム血症、高カルシウム血症 | |||
| 精神・神経系 | 浮動性めまい、振戦、味覚不全、錯感覚、頭痛、失神、感覚鈍麻、錯乱状態、不眠症、うつ病、意識レベルの低下、傾眠 | |||
| 皮膚 | そう痒症、脱毛症、皮膚乾燥、寝汗、紅斑、多汗症、点状出血 | |||
| その他 | 疲労 | 発熱、無力症 | 末梢性浮腫、体重減少、回転性めまい、転倒、悪寒、倦怠感、CRP増加、浮腫、白内障、非心臓性胸痛、尿閉、慢性腎臓病、骨盤痛 |
14. 適用上の注意
14.1 薬剤調剤時の注意
脱カプセルをしないこと。
14.2 薬剤交付時の注意
14.2.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することがある。
14.2.2 カプセルを噛み砕いたり、開けたりせずに服用するよう指導すること。
15. その他の注意
16. 薬物動態
16.1 血中濃度
再発又は難治性の多発性骨髄腫患者に本剤0.5mg注)、2mg注)、4mgを単回経口投与及び反復経口投与したとき、本剤はいずれの用量でも速やかに吸収された。本剤の血漿中濃度推移と薬物動態パラメータは以下のとおりであり、本剤の血漿中濃度は投与約2〜4時間後に最高値に達し、t1/2は約6〜7時間であった。単回及び反復投与時のAUC及びCmaxはいずれも用量比例的に増加した。経口クリアランス(CL/F)及びみかけの分布容積(Vz/F)は、投与量にかかわらず同様であった。また、反復投与による蓄積性は認められなかった6)。
単回経口投与したときの血漿中濃度の推移(平均値±標準偏差)
| 用量 | 0.5mg注) (6例) | 2mg注) (6例) | 4mg (6例) | ||
| 測定日 | 1日目 | 1日目 | 10日目b | 1日目 | 10日目b |
| Cmax(ng/mL) | 9.1(18.8) | 35.6(15.9) | 37.6(20.9) | 70.2(49.7) | 71.2(40.6) |
| AUC24(ng・h/mL) | 84.9(14.9) | 364.4(20.3) | 411.5(17.7) | 685.7(43.1) | 713.8(40.1) |
| AUC∞(ng・h/mL) | 92.6(14.6) | 411.0(26.4) | 463.6(19.4) | 750.1(44.8) | 764.3(40.8) |
| tmaxa(h) | 2.0(0.9,4.0) | 3.0(2.0,6.0) | 3.0(1.0,4.0) | 3.0(1.0,5.8) | 4.0(2.0,4.0) |
| t1/2(h) | 6.4(12.4) | 6.9(20.7) | 7.3(8.8) | 6.0(21.1) | 5.5(24.4) |
| CL/F(L/h) | 5.4(14.6) | 4.9(26.4) | 4.9(17.7) | 5.3(44.8) | 5.6(40.1) |
| Vz/F(L) | 50(18.5) | 48.2(15.9) | 45.6(15.4) | 46(37.4) | 41.6(42.0) |
16.2 吸収
16.2.1 食事の影響
健康成人(27例)に本剤4mgを高脂肪・高カロリー食の食後に単回投与したときのCmaxは27%低下し、AUCは8%低下した7)(外国人データ)。
16.3 分布
16.4 代謝
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
16.6.2 肝機能障害患者
16.7 薬物相互作用
16.7.1 フルボキサミンマレイン酸塩
16.7.2 ケトコナゾール
16.7.3 フルボキサミンマレイン酸塩及びケトコナゾールの併用投与
16.7.4 その他の薬剤
多発性骨髄腫患者(14例)に本剤4mgをデキサメタゾン(20〜40mg)との併用で単回又は反復投与したとき、本剤4mg単独単回又は反復投与時と比べて本剤のAUC及びCmaxに影響は認められなかった16)(外国人データ)。
健康成人(16例)にカルバマゼピン(100〜200mg1日1〜2回)反復投与後に本剤4mgを単回投与したときの本剤のAUC及びCmaxは、本剤4mg単独単回投与時と比べてそれぞれ約20%及び25%減少した15)(外国人データ)。
注)本剤の承認用法・用量は、「1日1回4mgを21日間連日経口投与した後、7日間休薬する。これを1サイクルとして投与を繰り返す。」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<デキサメタゾン併用>
17.1.1 国内第II相試験
ボルテゾミブ及びレナリドミドによる治療が不良で、かつ直近の治療中又は治療終了後60日以内に病勢進行した再発の多発性骨髄腫患者を対象とした第II相試験(MM-011試験)を実施し、本剤注1)及び低用量デキサメタゾン注2)併用投与の有効性及び安全性を評価した。その結果、主要評価項目の奏効率は、25.0%[95%信頼区間:10.9〜39.1%](完全奏効1例、部分奏効8例)であった17)。
安全性評価症例において、36例中32例(88.9%)に副作用(臨床検査値異常を含む)が認められた。主な副作用は、好中球減少症25例(69.4%)、血小板減少症12例(33.3%)、発疹6例(16.7%)、白血球減少症5例(13.9%)、発熱5例(13.9%)、貧血4例(11.1%)、リンパ球減少症4例(11.1%)、末梢性浮腫4例(11.1%)、便秘4例(11.1%)、不眠症4例(11.1%)であった17)。[5.2、7.1参照]
安全性評価症例において、36例中32例(88.9%)に副作用(臨床検査値異常を含む)が認められた。主な副作用は、好中球減少症25例(69.4%)、血小板減少症12例(33.3%)、発疹6例(16.7%)、白血球減少症5例(13.9%)、発熱5例(13.9%)、貧血4例(11.1%)、リンパ球減少症4例(11.1%)、末梢性浮腫4例(11.1%)、便秘4例(11.1%)、不眠症4例(11.1%)であった17)。[5.2、7.1参照]
注1)本剤の用法・用量は28日を1サイクルとし、1日1回4mgを1〜21日目に経口投与する。なお、国内及び海外臨床試験では、本剤を投与される全ての患者に対して、本剤の投与開始時から抗血栓薬又は抗凝固薬を投与する規定であった。
注2)デキサメタゾンの用法・用量は28日を1サイクルとし、1日1回40mg(75歳を超える患者には20mg)を1、8、15、22日目に経口投与する。
17.1.2 海外第III相試験
ボルテゾミブ及びレナリドミドによる治療が不良で、かつ直近の治療中又は治療終了後60日以内に病勢進行した再発又は難治性の多発性骨髄腫患者を対象とした第III相試験(MM-003試験)を実施し、本剤注1)及び低用量デキサメタゾン注2)併用投与と高用量デキサメタゾン単独投与注3)の有効性及び安全性を評価した。その結果、本剤及び低用量デキサメタゾン併用投与群では、主要評価項目の無増悪生存期間(PFS)及び副次評価項目の全生存期間(OS)は、高用量デキサメタゾン単独投与群と比べて有意に延長した18)。
| 本剤注1)及び低用量デキサメタゾン注2)併用投与群 (302例) | 高用量デキサメタゾン単独投与注3)群 (153例) | |
| PFS | ||
| イベント発生者数(%) | 164(54.3) | 103(67.3) |
| 中央値a(週)[95%信頼区間]b | 15.7[13.0,20.1] | 8.0[7.0,9.0] |
| ハザード比c[95%信頼区間] | 0.45[0.35,0.59] | |
| p値(Log-rank検定) | <0.001 | |
| OS | ||
| 死亡患者数(%) | 76(25.2) | 58(37.9) |
| 中央値a(週)[95%信頼区間]b | NE[48.1,NE] | 34.0[23.4,39.9] |
| ハザード比c[95%信頼区間] | 0.53[0.37,0.74] | |
| p値(Log-rank検定) | <0.001 | |
PFSのKaplan-Meier曲線
OSのKaplan-Meier曲線
本剤投与群の安全性評価症例において、300例中247例(82.3%)に副作用(臨床検査値異常を含む)が認められた。主な副作用は、好中球減少症129例(43.0%)、貧血74例(24.7%)、疲労63例(21.0%)、血小板減少症58例(19.3%)、白血球減少症32例(10.7%)であった18)。[5.2、7.1参照]
注1)本剤の用法・用量は28日を1サイクルとし、1日1回4mgを1〜21日目に経口投与する。なお、国内及び海外臨床試験では、本剤を投与される全ての患者に対して、本剤の投与開始時から抗血栓薬又は抗凝固薬を投与する規定であった。
注2)デキサメタゾンの用法・用量は28日を1サイクルとし、1日1回40mg(75歳を超える患者には20mg)を1、8、15、22日目に経口投与する。
注3)デキサメタゾンの用法・用量は28日を1サイクルとし、1日1回40mg(75歳を超える患者には20mg)を1〜4日、9〜12日、17〜20日目に経口投与する。
17.1.3 国際共同第II相試験
レナリドミドを含む1又は2レジメンの治療歴を有する再発又は難治性の多発性骨髄腫患者を対象とした国際共同第II相試験(MM-014試験)を実施し、日本人コホート(18例)で本剤注1)、低用量デキサメタゾン注2)及びダラツムマブ(遺伝子組換え)点滴静注製剤注3)併用投与の有効性及び安全性を評価した。その結果、主要評価項目の奏効率は、83.3%[95%信頼区間:58.6〜96.4%][完全奏効4例(22.2%)、最良部分奏効7例(38.9%)、部分奏効4例(22.2%)]であった19)。
安全性評価症例において、18例中16例(88.9%)に副作用(臨床検査値異常を含む)が認められた。主な副作用は、好中球減少症14例(77.8%)、発疹6例(33.3%)、白血球減少症5例(27.8%)、血小板減少症4例(22.2%)、便秘2例(11.1%)、発熱2例(11.1%)であった19)。[5.2、7.1参照]
安全性評価症例において、18例中16例(88.9%)に副作用(臨床検査値異常を含む)が認められた。主な副作用は、好中球減少症14例(77.8%)、発疹6例(33.3%)、白血球減少症5例(27.8%)、血小板減少症4例(22.2%)、便秘2例(11.1%)、発熱2例(11.1%)であった19)。[5.2、7.1参照]
注1)本剤の用法・用量は28日を1サイクルとし、1日1回4mgを1〜21日目に経口投与する。なお、本国際共同試験では、本剤を投与される全ての患者に対して、本剤の投与開始時から抗血栓薬又は抗凝固薬を投与する規定であった。
注2)デキサメタゾンの用法・用量は28日を1サイクルとし、1日1回40mg(75歳を超える患者には20mg)を1、8、15、22日目に経口投与する。
注3)ダラツムマブ(遺伝子組換え)点滴静注製剤の用法・用量は28日を1サイクルとし、1回16mg/kgを、1週間間隔(1〜8週目)、2週間間隔(9〜24週目)及び4週間間隔(25週目以降)で静脈内投与する。
17.1.4 海外第III相試験
レナリドミド及びプロテアソーム阻害剤を含む1レジメン以上の前治療歴を有する再発又は難治性の多発性骨髄腫患者304例を対象とした海外第III相試験(MMY3013試験)を実施し、本剤注1)及びデキサメタゾン注2)の併用療法(Pd療法)とPd療法にダラツムマブ(遺伝子組換え)点滴静注製剤注3)又はダラツムマブ(遺伝子組換え)・ボルヒアルロニダーゼ アルファ(遺伝子組換え)配合皮下注製剤注4)を上乗せしたDPd療法注5)との有効性及び安全性を評価した。その結果、DPd療法群では主要評価項目のPFSがPd療法群と比べて有意に延長した20)。
| DPd療法群 (151例) | Pd療法群 (153例) | |
| PFS | ||
| イベント発生者数(%) | 84(55.6) | 106(69.3) |
| 中央値a(ヵ月)[95%信頼区間]b | 12.4[8.34,19.32] | 6.9[5.52,9.26] |
| ハザード比c[95%信頼区間] | 0.63[0.47,0.85] | |
| p値(Log-rank検定) | 0.0018 | |
PFSのKaplan-Meier曲線
DPd療法群の安全性評価症例において、149例中131例(87.9%)に副作用(臨床検査値異常を含む)が認められた。主な副作用は、好中球減少症97例(65.1%)、血小板減少症34例(22.8%)、白血球減少症33例(22.2%)、貧血23例(15.4%)、疲労23例(15.4%)、無力症23例(15.4%)、肺炎18例(12.1%)、リンパ球減少症15例(10.1%)であった20)。[5.2、7.1参照]
注1)本剤の用法・用量は28日を1サイクルとし、1日1回4mgを1〜21日目に経口投与する。
注2)デキサメタゾンの用法・用量は28日を1サイクルとし、40mg(75歳以上の患者には20mg)を1週間隔で静脈内又は経口投与する。
注3)ダラツムマブ(遺伝子組換え)点滴静注製剤の用法・用量は28日を1サイクルとし、1回16mg/kgを、1週間間隔(1〜8週目)、2週間間隔(9〜24週目)及び4週間間隔(25週目以降)で静脈内投与する。
注4)ダラツムマブ(遺伝子組換え)・ボルヒアルロニダーゼ アルファ(遺伝子組換え)配合皮下注製剤の用法・用量は28日間を1サイクルとし、ダラツムマブとして1回1,800mg(ボルヒアルロニダーゼ アルファとして30,000単位を含む)を、1週間間隔(1〜8週目)、2週間間隔(9〜24週目)及び4週間間隔(25週目以降)で皮下投与する。
注5)本試験開始時点ではダラツムマブ(遺伝子組換え)点滴静注製剤の投与が規定されていたが、試験実施中に新規に投与開始する患者はダラツムマブ(遺伝子組換え)・ボルヒアルロニダーゼ アルファ(遺伝子組換え)配合皮下注製剤を投与するよう変更された。この変更前にダラツムマブ(遺伝子組換え)点滴静注製剤の投与を開始していた患者は9週目以降にダラツムマブ(遺伝子組換え)・ボルヒアルロニダーゼ アルファ(遺伝子組換え)配合皮下注製剤の投与への切替えが許容されていた。ダラツムマブ(遺伝子組換え)点滴静注製剤の投与例はDPd療法群の151例中7例であり、そのうち4例は投与期間中にダラツムマブ(遺伝子組換え)・ボルヒアルロニダーゼ アルファ(遺伝子組換え)配合皮下注製剤の投与に切り替えた。
<ボルテゾミブ及びデキサメタゾン併用>
17.1.5 国際共同第III相試験
レナリドミドを含む1〜3レジメンの治療歴注1)を有し、かつ直近の治療中又は治療終了後に病勢進行した再発又は難治性の多発性骨髄腫患者559名(日本人患者17名を含む)を対象とした国際共同第III相試験(MM-007試験)を実施し、ボルテゾミブ注2)及びデキサメタゾン注3)併用投与(Bd療法)とBd療法に本剤注4)を上乗せしたP+Bd療法との有効性及び安全性を評価した。その結果、P+Bd療法では、主要評価項目のPFSがBd療法群と比べて有意に延長した5)。
| P+Bd療法群 (281例) | Bd療法群 (278例) | |
| PFS | ||
| イベント発生者数(%) | 154(54.8) | 162(58.3) |
| 中央値a(ヵ月)[95%信頼区間]b | 11.2[9.66,13.73] | 7.1[5.88,8.48] |
| ハザード比c[95%信頼区間] | 0.61[0.49,0.77] | |
| p値(Log-rank検定) | <0.0001 | |
PFSのKaplan-Meier曲線
本剤投与群の安全性評価症例において、278例中(日本人12例含む)229例(82.4%)に副作用(臨床検査値異常を含む)が認められた。主な副作用は、好中球減少107例(38.5%)、血小板減少78例(28.1%)、疲労61例(21.9%)、便秘50例(18.0%)、下痢40例(14.4%)、貧血37例(13.3%)、末梢性感覚ニューロパチー37例(13.3%)であった5)。[5.2、7.1参照]
注1)ボルテゾミブによる前治療歴を有する場合は、当該治療中又は最終投与後60日以内に疾患進行がない患者を対象とした。
注2)ボルテゾミブの用法・用量は21日を1サイクルとし、1.3mg/m2をサイクル1〜8の1、4、8、11日目、サイクル9以降には各サイクルの1及び8日目に静脈内又は皮下投与する。
注3)デキサメタゾンの用法・用量は21日を1サイクルとし、20mg(75歳を超える患者には10mg)をサイクル1〜8の1、2、4、5、8、9、11、12日目、サイクル9以降には各サイクルの1、2、8、9日目に経口投与する。
注4)本剤の用法・用量は21日を1サイクルとし、4mgを1日1回、1〜14日目に経口投与する。なお、本国際共同試験では、本剤を投与される全ての患者に対して、本剤の投与開始時から抗血栓薬又は抗凝固薬を投与する規定であった。
18. 薬効薬理
18.1 作用機序
ポマリドミドはサイトカイン産生調節作用、造血器腫瘍細胞に対する増殖抑制作用、血管新生阻害作用等を有すると考えられているが、詳細な作用機序は解明されていない21)。
18.2 In vitro試験
18.2.1 ポマリドミドはヒト多発性骨髄腫由来H929、RPMI-8226、OPM-2及びLP-1細胞株、並びにレナリドミド耐性の細胞株(H929-1051、H929-1052、H929-1053及びH929-1054)の細胞増殖を抑制した21)22)。
18.2.2 ポマリドミドはヒト末梢血単核球に対し、リポポリサッカライド(LPS)刺激による炎症性サイトカイン(TNF-α、IL-1β、IL-6、IL-12等)産生を阻害し、抗炎症性サイトカイン(IL-10)の産生を促進した。また、ポマリドミドはヒト末梢血におけるTh1サイトカイン(IL-2、IFN-γ等)産生を促進した21)。
18.2.3 ポマリドミドはヒト臍帯静脈内皮細胞(HUVEC)を用いた検討により、血管内皮細胞の遊走又は管腔の形成を抑制した21)。
18.3 In vivo試験
ポマリドミドはヒト多発性骨髄腫由来H929及びH929-1051細胞株を移植したマウスにおいて、腫瘍増殖抑制作用を示した21)。
19. 有効成分に関する理化学的知見
19.1. ポマリドミド
20. 取扱い上の注意
20.1 薬剤管理は適正管理手順を厳守し、徹底すること1)。
20.2 開封後、直射日光及び高温・高湿を避けて保存すること。
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 本剤の製造販売・管理・使用等にあたっては、「レナリドミド・ポマリドミド適正管理手順」を適正に遵守すること。また、本手順の変更については、あらかじめ、厚生労働省の了解を受けなければならないこと。
21.3 本剤の投与が、緊急時に十分対応できる医療施設において、十分な知識・経験を有する医師のもとで、本剤の投与が適切と判断される症例のみを対象に、あらかじめ患者又はその家族に有効性及び危険性が文書をもって説明され、文書による同意を得てから初めて投与されるよう、厳格かつ適正な措置を講じること。
21.4 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
<ポマリストカプセル1mg>
7カプセル[7カプセル(PTP)×1]
<ポマリストカプセル2mg>
7カプセル[7カプセル(PTP)×1]
<ポマリストカプセル3mg>
7カプセル[7カプセル(PTP)×1]
<ポマリストカプセル4mg>
7カプセル[7カプセル(PTP)×1]
23. 主要文献
- RevMate(レナリドミド・ポマリドミド適正管理手順)
- 社内資料:毒性試験の概要文(承認年月日:2015年3月26日、CTD2.6.6.6)
- 社内資料:薬物動態試験の概要文(承認年月日:2015年3月26日、CTD2.6.4.4)
- San Miguel JF,et al., The Lancet Oncology., 14, 1055-1066, (2013)
- Paul G Richardson,et al., The Lancet Oncology., 20 (6), 781-794, (2019)
- 社内資料:CC-4047-MM-004試験(承認年月日:2015年3月26日、CTD2.7.6.13)
- 社内資料:CC-4047-CP-011試験
- 社内資料:臨床薬理試験(承認年月日:2015年3月26日、CTD2.7.2.3)
- 社内資料:CC-4047-CP-006試験(承認年月日:2015年3月26日、CTD2.7.6.4)
- Hoffmann M,et al., Cancer Chemotherapy and Pharmacology., 71, 489-501, (2013) »PubMed
- 社内資料:CC-4047-CP-004試験(承認年月日:2015年3月26日、CTD2.7.6.5)
- Yan Li,et al., Journal of clinical pharmacology., 9, 133-145, (2017)
- 社内資料:CC-4047-CP-009試験
- Yan Li,et al., Journal of clinical pharmacology., 58, 1295-1304, (2018)
- 社内資料:CC-4047-CP-008試験(承認年月日:2015年3月26日、CTD2.7.6.6)
- 社内資料:CC-4047-MM-002試験(承認年月日:2015年3月26日、CTD2.7.6.14)
- 社内資料:CC-4047-MM-011試験(承認年月日:2015年3月26日、CTD2.7.6.12)
- 社内資料:CC-4047-MM-003試験(承認年月日:2015年3月26日、CTD2.7.6.11)
- 社内資料:CC-4047-MM-014試験コホートC
- Meletios A Dimopoulos,et al., The Lancet Oncology., 22 (6), 801-812, (2021)
- 社内資料:薬理試験の概要文(承認年月日:2015年3月26日、CTD2.6.2)
- Lopez-Girona A,et al., Leukemia., 26, 2326-2335, (2012) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
ブリストル・マイヤーズスクイブ株式会社
メディカル情報グループ
東京都千代田区大手町1-2-1
電話:0120-093-507
製品情報問い合わせ先
ブリストル・マイヤーズスクイブ株式会社
メディカル情報グループ
東京都千代田区大手町1-2-1
電話:0120-093-507
26. 製造販売業者等
26.1 製造販売元(輸入)
ブリストル・マイヤーズスクイブ株式会社
東京都千代田区大手町1-2-1