医薬品情報
| 総称名 | ピレンゼピン塩酸塩 |
|---|---|
| 一般名 | ピレンゼピン塩酸塩水和物 |
| 欧文一般名 | Pirenzepine Hydrochloride Hydrate |
| 製剤名 | ピレンゼピン塩酸塩錠 |
| 薬効分類名 | 胃炎・消化性潰瘍治療剤 |
| 薬効分類番号 | 2329 |
| ATCコード | A02BX03 |
| KEGG DRUG |
D05276
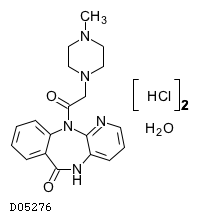
ピレンゼピン塩酸塩水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年9月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ピレンゼピン塩酸塩錠25mg「サワイ」 (後発品) | PIRENZEPINE HYDROCHLORIDE Tablets[SAWAI] | 沢井製薬 | 2329005F1286 | 6.1円/錠 |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常成人には1回1錠(ピレンゼピン塩酸塩無水物として25mg)を、1日3〜4回経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
8. 重要な基本的注意
眼の調節障害等を起こすことがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に注意させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 前立腺肥大のある患者
排尿困難を起こすことがある。
9.1.2 緑内障の患者
眼圧を上昇させることがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物で乳汁への移行が認められている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下している。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 無顆粒球症(頻度不明)
11.1.2 アナフィラキシー(頻度不明)
発疹、蕁麻疹等があらわれることがある。
注)使用成績調査を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | |
| 消化器 | 口渇、便秘、下痢、悪心・嘔吐 | 歯肉痛、膨満感 |
| 過敏症 | 発疹 | |
| 泌尿器 | 排尿困難、残尿感 | |
| 肝臓 | AST、ALTの上昇 | |
| 循環器 | 心悸亢進 | |
| その他 | 頭重感、たちくらみ、脱力感、嗄声、眼のちらつき、眼の乾燥感に伴う流涙、眼の調節障害 |
13. 過量投与
13.1 症状
抗コリン作用によるとみられる口渇、せん妄、頻脈、イレウス、尿閉等があらわれることがある。
13.2 処置
通常早期には、活性炭の投与、胃洗浄等を行う。また、必要に応じ、副交感神経興奮薬の投与および尿閉の場合の導尿等、適切な支持療法を行うこと。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性3例にピレンゼピン塩酸塩無水物25mgを経口投与した場合、2〜4時間で最高血中濃度約32ng/mLに達する。血中濃度の半減期は約13時間である1)。
16.1.2 生物学的同等性試験
ピレンゼピン塩酸塩錠25mg「サワイ」とガストロゼピン錠25mgを健康成人男子にそれぞれ1錠(ピレンゼピン塩酸塩無水物として25mg)空腹時単回経口投与(クロスオーバー法)し、血漿中ピレンゼピン濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された2)。
| Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | AUC0-48hr(ng・hr/mL) | |
| ピレンゼピン塩酸塩錠25mg「サワイ」 | 26.1±8.1 | 5.2±1.0 | 12.0±3.9 | 431.7±139.1 |
| ガストロゼピン錠25mg | 26.8±9.6 | 4.3±1.6 | 11.9±3.2 | 404.2±130.3 |
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 吸収率
健康成人男性5例にピレンゼピン塩酸塩無水物25mgを経口投与した場合、服用量の約26%が吸収された3)(外国人データ)。
16.2.2 食事の影響
健康成人男性20例にピレンゼピン塩酸塩無水物50mgを単回経口投与(空腹時又は食後)した場合、食事により血中濃度−時間曲線下面積(AUC)が30%低下した4)(外国人データ)。
16.3 分布
16.4 代謝
健康成人にピレンゼピン塩酸塩無水物25mgを経口投与した場合、ほとんど代謝を受けず、血漿、尿及び糞中では大部分が未変化体である3)(外国人データ)。
16.5 排泄
尿中への排泄率は約10%であり、24時間で大部分が排泄され、連続投与しても蓄積性は認められない1)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内二重盲検比較試験
(1)
胃潰瘍を対象とした二重盲検比較試験において、ピレンゼピン塩酸塩錠75mg/日を8週または12週間投与により、本剤の有用性が認められた8)。
| 有効例数/効果判定例数 | 有効率(有効以上) |
| 104/120 | 86.7% |
副作用発現率は6.7%(8/120例)で、副作用は口渇2.5%(3例)、便秘2.5%(3例)、発疹1.7%(2例)、残尿感0.8%(1例)であった。
(2)
十二指腸潰瘍を対象とした二重盲検比較試験において、ピレンゼピン塩酸塩錠100mg/日を8週間投与により、本剤の有用性が認められた9)。
| 有効例数/効果判定例数 | 有効率(有効以上) |
| 55/65 | 84.6% |
副作用発現率は3.1%(2/65例)で、副作用は口渇1.5%(1例)、便秘1.5%(1例)であった。
(3)
胃炎を対象とした二重盲検比較試験において、ピレンゼピン塩酸塩錠75mg/日を2週間投与により、本剤の有用性が認められた10)。
| 有効例数/効果判定例数 | 有効率(有効以上) |
| 87/141 | 61.7% |
副作用発現率は4.2%(6/142例)で、副作用は口渇3.5%(5例)、便秘0.7%(1例)、嗄声0.7%(1例)、脱力感0.7%(1例)、頭重感0.7%(1例)であった。
18. 薬効薬理
18.1 作用機序
ムスカリン受容体遮断薬で、アトロピンと同様の副交感神経興奮による反応を抑制することにより様々な作用を現す11)。
18.2 胃液分泌抑制作用に対する選択性
18.3 胃液分泌抑制作用
18.4 抗ガストリン作用
肉エキス投与による血中ガストリン値の上昇を抑制する(イヌ)14)。
18.5 防御因子増強作用
18.5.2 ストレス負荷時、レセルピン投与時の胃粘液産生減少を抑制する(ラット)20)。
18.6 各種実験潰瘍に対する効果
18.7 実験的急性胃炎に対する効果
18.8 実験的慢性胃炎に対する効果
タウロコール酸投与時の慢性(萎縮性)胃炎の発症に対して抑制効果を示す(ラット)27)。
18.9 臨床薬理
19. 有効成分に関する理化学的知見
19.1. ピレンゼピン塩酸塩水和物
20. 取扱い上の注意
開封後は遮光して保存すること。
22. 包装
PTP
100錠(10錠×10)
23. 主要文献
- 大橋一郎他, 臨床薬理, 11, 153-159, (1980) »DOI
- 社内資料:生物学的同等性試験
- Hammer,R.et al., Therapiewoche, 27, 1575-1593, (1977)
- Matzek,K.M.et al., Int.J.Pharm., 28, 151-155, (1986)
- 朝倉誠他, 薬理と治療, 14, 1277-1284, (1986)
- Hammer,R.et al., Therapiewoche, 27, 1567-1574, (1977)
- Kobayashi,S.et al., Arzneimittelforschung, 31, 679-690, (1981) »PubMed
- 三好秋馬他, 内科宝函, 27, 33-48, (1980)
- 増田正典他, 薬理と治療, 8, 2307-2325, (1980)
- 三好秋馬他, Therapeutic Research, 2, 883-905, (1985)
- 第十八改正日本薬局方解説書, C-4481-4484, (2021), (廣川書店)
- Jennewein,H.M., Die Behandlung des Ulcus pepticum mit Pirenzepin, 41-48, (1979)
- Hammer,R.et al., Nature, 283, 90-92, (1980) »PubMed
- 松尾裕他, 基礎と臨床, 11, 897-909, (1977)
- Kitagawa,H.et al., Arzneimittelforschung, 28, 2122-2127, (1978) »PubMed
- Leitold,M.et al., Therapiewoche, 27, 1517-1531, (1977)
- Matsuo,Y.et al., Symposium Advances in Gastroenterology with the Selective Antimuscarinic Compound-Pirenzepine Stockholm 17th June 1982 ed by G Dotevall Excerpta Medica Amsterdam-Oxford-Princeton, 37-46, (1982)
- 岩崎仁他, 診療と新薬, 20, 973-980, (1983)
- Oda,M.et al., Proceedings of the First Symposium on the Regulation and Disturbances of Gastrointestinal Function Tokyo September 18 1982 ed by Y Kasuya Excerpta Medica Amsterdam-Oxford-Princeton, 145-173, (1983)
- 小林礼子他, 臨牀と研究, 61, 149-153, (1984)
- 岡部進他, 応用薬理, 15, 1235-1240, (1978)
- 岡部進他, 基礎と臨床, 14, 1880-1883, (1980)
- Leitold,M.et al., Therapiewoche, 27, 1532-1548, (1977)
- Inatomi,N.et al., Jpn.J.Pharmacol., 29, 486-488, (1979) »PubMed
- Takeda,F.et al., Jpn.J.Pharmacol., 38, 337-346, (1985) »PubMed
- 神尾弘他, 薬理と治療, 13, 3325-3331, (1985)
- 岸本真也他, 薬理と治療, 13, 2791-2795, (1985)
- 須山哲次他, 基礎と臨床, 14, 792-800, (1980)
- 竜田正晴他, 臨牀と研究, 57, 3103-3111, (1980)
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30