医薬品情報
| 総称名 | イフェクサー |
|---|---|
| 一般名 | ベンラファキシン塩酸塩 |
| 欧文一般名 | Venlafaxine Hydrochloride |
| 製剤名 | ベンラファキシン塩酸塩徐放性カプセル |
| 薬効分類名 | セロトニン・ノルアドレナリン再取り込み阻害剤 |
| 薬効分類番号 | 1179 |
| ATCコード | N06AX16 |
| KEGG DRUG |
D00821
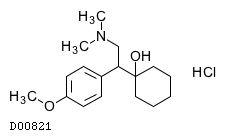
ベンラファキシン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年7月 改訂(第7版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| イフェクサーSRカプセル37.5mg | EFFEXOR SR CAPSULES | ヴィアトリス製薬 | 1179055N1021 | 101.9円/カプセル | 劇薬, 処方箋医薬品注) |
| イフェクサーSRカプセル75mg | EFFEXOR SR CAPSULES | ヴィアトリス製薬 | 1179055N2028 | 167.6円/カプセル | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
5.1 抗うつ剤の投与により、24歳以下の患者で、自殺念慮、自殺企図のリスクが増加するとの報告がある。また、本剤の投与により、特に18歳未満の大うつ病性障害患者では、プラセボと比較して自殺念慮、自殺企図のリスクが高くなる可能性が示唆されているため、本剤の投与にあたっては、リスクとベネフィットを考慮すること。[8.1-8.4、9.1.1、9.1.2、9.7.3、15.1.1参照]
5.2 本剤を18歳未満の大うつ病性障害患者に投与する際には適応を慎重に検討すること。[9.7.2参照]
6. 用法及び用量
通常、成人にはベンラファキシンとして1日37.5mgを初期用量とし、1週後より1日75mgを1日1回食後に経口投与する。なお、年齢、症状に応じ1日225mgを超えない範囲で適宜増減するが、増量は1週間以上の間隔をあけて1日用量として75mgずつ行うこと。
7. 用法及び用量に関連する注意
7.1 本剤の投与量は、必要最小限となるよう、患者ごとに慎重に観察しながら調節すること。増量により不眠症状、血圧上昇等のノルアドレナリン作用があらわれるおそれがある。[15.1.3参照]
8. 重要な基本的注意
8.1 うつ症状を呈する患者は希死念慮があり、自殺企図のおそれがあるので、このような患者は投与開始早期並びに投与量を変更する際には患者の状態及び病態の変化を注意深く観察すること。[5.1、8.2-8.4、9.1.1、9.1.2、9.7.3、15.1.1参照]
8.2 不安、焦燥、興奮、パニック発作、不眠、易刺激性、敵意、攻撃性、衝動性、アカシジア/精神運動不穏、軽躁、躁病等があらわれることが報告されている。また、因果関係は明らかではないが、これらの症状・行動を来した症例において、基礎疾患の悪化又は自殺念慮、自殺企図、他害行為が報告されている。患者の状態及び病態の変化を注意深く観察するとともに、これらの症状の増悪が観察された場合には、服薬量を増量せず、徐々に減量し、中止するなど適切な処置を行うこと。[5.1、8.1、8.3、8.4、9.1.1-9.1.4、9.7.3、15.1.1参照]
8.3 自殺目的での過量服用を防ぐため、自殺傾向が認められる患者に処方する場合には、1回分の処方日数を最小限にとどめること。[5.1、8.1、8.2、8.4、9.1.1、9.1.2、9.7.3、15.1.1参照]
8.4 家族等に自殺念慮や自殺企図、興奮、攻撃性、易刺激性等の行動の変化及び基礎疾患の悪化があらわれるリスク等について十分説明を行い、医師と緊密に連絡を取り合うように指導すること。[5.1、8.1-8.3、9.1.1-9.1.4、9.7.3、15.1.1参照]
8.5 心拍数増加、血圧上昇、高血圧クリーゼがあらわれることがあるので、本剤投与中は、適宜血圧・脈拍数等を測定し、異常が認められた場合には、減量、休薬又は中止するなど適切な処置を行うこと。[9.1.7、11.1.11参照]
8.6 眠気、めまい等が起こることがあるので、自動車の運転等危険を伴う機械を操作する際には十分注意させること。また、患者に、これらの症状を自覚した場合は自動車の運転等危険を伴う機械の操作に従事しないよう、指導すること。
8.7 投与中止(突然の中止)又は減量により、攻撃性、軽躁、不安、激越、神経過敏、錯乱、睡眠障害、疲労、傾眠、錯感覚、めまい、痙攣、頭痛、感冒様症状、耳鳴、協調運動障害、振戦、発汗、口内乾燥、食欲減退、下痢、悪心、嘔吐、視覚障害等があらわれることが報告されている。投与を中止する場合には、突然の中止を避け、患者の状態を観察しながら徐々に減量すること。
8.8 血清コレステロールの上昇が報告されているので、本剤を長期に投与する場合はコレステロール値の測定を考慮し、異常が認められた場合には、適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 双極性障害患者
9.1.2 自殺念慮又は自殺企図の既往のある患者、自殺念慮のある患者
9.1.3 脳の器質的障害又は統合失調症の素因のある患者
9.1.4 衝動性が高い併存障害を有する患者
9.1.5 てんかん等の痙攣性疾患又はこれらの既往歴のある患者
痙攣発作を起こすことがある。[11.1.5参照]
9.1.6 緑内障又は眼内圧亢進のある患者
症状が増悪することがある。
9.1.7 高血圧又は心疾患のある患者
9.1.8 QT延長又はその既往歴のある患者、著明な徐脈や低カリウム血症等がある患者
9.1.9 出血の危険性を高める薬剤を併用している患者、出血傾向又は出血性素因のある患者
皮膚や粘膜の出血、消化管出血等が報告されており、出血傾向が増強することがある。[10.2参照]
9.1.10 前立腺肥大等排尿困難のある患者
ノルアドレナリン再取り込み阻害作用により症状が悪化することがある。
9.2 腎機能障害患者
本剤のクリアランスが低下し、血中濃度が上昇するおそれがある。
9.2.1 重度の腎機能障害(糸球体ろ過量15mL/min未満)のある患者又は透析中の患者
投与しないこと。また、本剤は透析ではほとんど除去されない。[2.4参照]
9.2.2 軽度から中等度の腎機能障害のある患者[16.6.1参照]
9.3 肝機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.5.1 妊娠末期に本剤あるいは他のSSRI、SNRIが投与された女性が出産した新生児において、入院期間の延長、呼吸補助、経管栄養を必要とする、離脱症状と同様の症状が出産直後にあらわれたとの報告がある。
9.5.2 妊娠ラットにベンラファキシン30mg/kg/日(AUCに基づく曝露量比較で臨床曝露量の約0.4倍)を経口投与したとき、胎児の生存率低下及び体重抑制が認められた1)。
9.5.3 妊娠ラットに活性代謝物であるO-脱メチルベンラファキシン100mg/kg/日(AUCに基づく曝露量比較で臨床曝露量の約1.7倍)を経口投与したとき、受胎能の低下が認められた1)。
9.5.4 妊娠ウサギにベンラファキシンを経口投与した実験で、胎児への移行が認められた2)。
9.6 授乳婦
9.7 小児等
9.7.1 小児等を対象とした国内臨床試験は実施していない。
9.8 高齢者
肝機能、腎機能の低下を考慮し、用量等に注意して投与すること。一般的に高齢者では生理機能が低下していることが多い。また、高齢者において低ナトリウム血症及び抗利尿ホルモン不適合分泌症候群(SIADH)の危険性が高くなることがある。[11.1.3参照]
10. 相互作用
相互作用序文
本剤は、主として肝代謝酵素CYP2D6及び一部CYP3A4で代謝される。
薬物代謝酵素用語
CYP2D6
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
| モノアミン酸化酵素(MAO)阻害剤 セレギリン塩酸塩(エフピー) ラサギリンメシル酸塩(アジレクト) サフィナミドメシル酸塩(エクフィナ) [2.2参照] | 本剤又は他の抗うつ剤で、併用により発汗、不穏、全身痙攣、異常高熱、昏睡等の症状があらわれることがある。なお、MAO阻害剤の投与を受けた患者に本剤を投与する場合は14日間以上、本剤投与後にMAO阻害剤を投与する場合は7日間以上の間隔をおくこと。 | 主にMAO阻害剤による神経外アミン総量の増加及び抗うつ剤によるモノアミン作動性神経終末におけるアミン再取り込み阻害によると考えられる。 |
10.2 併用注意
| アルコール(飲酒) | 本剤投与中は、飲酒を避けることが望ましい。 | 相互に中枢神経抑制作用を増強させる可能性がある。 |
| メチルチオニニウム塩化物水和物(メチレンブルー) [11.1.1参照] | セロトニン症候群があらわれるおそれがある。 | 左記薬剤のMAO阻害作用によりセロトニン作用が増強されると考えられる。 |
| セロトニン作用薬 炭酸リチウム、セロトニン・ノルアドレナリン再取り込み阻害剤(SNRI)及び選択的セロトニン再取り込み阻害剤(SSRI)、トラマドール塩酸塩含有製剤、メサドン塩酸塩、ペンタゾシン含有製剤、ペチジン塩酸塩含有製剤、タペンタドール塩酸塩、デキストロメトルファン臭化水素酸塩水和物含有製剤、フェンタニル含有製剤、トリプタン系薬剤、L-トリプトファン含有製剤、リネゾリド等 [11.1.1参照] | 相互にセロトニン作用を増強することにより、セロトニン症候群等があらわれるおそれがあるので、本剤及びこれらの薬剤の用量を減量するなど注意して投与すること。 | 本剤はセロトニン再取り込み阻害作用を有するため、併用により、相互にセロトニン作用が増強することがある。 |
| セイヨウオトギリソウ(セント・ジョーンズ・ワート)含有食品等 [11.1.1参照] | 相互にセロトニン作用を増強することにより、セロトニン症候群等があらわれるおそれがあるので、本剤及びこれらの薬剤の用量を減量するなど注意して投与すること。 | 本剤はセロトニン再取り込み阻害作用を有するため、併用により、相互にセロトニン作用が増強することがある。 |
| セイヨウオトギリソウ(セント・ジョーンズ・ワート)含有食品等 [11.1.1参照] | 本剤及びO-脱メチル体の血中濃度が低下するおそれがあるので注意して投与すること。 | セイヨウオトギリソウが本剤の代謝酵素(CYP3A4)を誘導すると考えられる。 |
| アドレナリン、ノルアドレナリン | これらの薬剤(特に注射剤)との併用により、心血管作用(血圧上昇等)が増強することがあるので、本剤及びこれらの薬剤の用量を減量するなど注意して投与すること。 | 本剤はノルアドレナリン再取り込み阻害作用を有するため、併用により、アドレナリン作用が増強することがある。 |
| 出血傾向が増強する薬剤 アスピリン等の非ステロイド系抗炎症剤、ワルファリン等の抗凝固剤 [9.1.9参照] | 出血傾向が増強するおそれがあるので、注意して投与すること。 | SNRIの投与により血小板凝集能が阻害され、これらの薬剤との併用により出血傾向が増強することがある。 |
| ハロペリドール [16.7.1参照] | ハロペリドールの血中濃度が上昇するおそれがあるので、注意して投与すること。 | 機序不明 |
| イミプラミン塩酸塩 [16.7.3参照] | イミプラミンの活性代謝物の血中濃度が上昇するおそれがあるので、注意して投与すること。 | 機序不明 |
| シメチジン [16.7.5参照] | 本剤の血中濃度が上昇するおそれがあるので、注意して投与すること。 | シメチジンの薬物代謝酵素(CYP3A4、CYP2D6)阻害作用により、本剤の代謝が阻害され、血中濃度が上昇すると考えられる。 |
| CYP3A4阻害剤 ケトコナゾール、エリスロマイシン、リトナビル等 [16.7.4参照] | 本剤及びO-脱メチル体の血中濃度が上昇するおそれがあるので注意して投与すること。 | CYP3A4阻害剤であるケトコナゾール(経口剤)の併用による本剤の副代謝経路の阻害が報告されている。 |
| メトプロロール酒石酸塩 [16.7.6参照] | メトプロロールの血中濃度が上昇するおそれがあるので注意して投与すること。 | 機序不明 |
| メトプロロール酒石酸塩 [16.7.6参照] | メトプロロールの降圧作用が減弱するおそれがあるので注意して投与すること。 | 本剤のノルアドレナリン再取り込み阻害作用によると考えられる。 |
| インジナビル硫酸塩エタノール付加物 [16.7.8参照] | インジナビルの血中濃度が低下するおそれがあるので注意して投与すること。 | 機序不明 |
| リスペリドン [16.7.7参照] | リスペリドンの血中濃度が上昇するおそれがあるので注意して投与すること。 | 本剤の薬物代謝酵素(CYP2D6)の阻害作用により、リスペリドンの代謝が阻害され、血中濃度が上昇すると考えられる。 |
| QT延長を起こすことが知られている薬剤 [9.1.8、11.1.4参照] | QT延長を起こすおそれがある。 | 併用によりQT延長作用が相加的に増加するおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 セロトニン症候群(0.2%)
不安、焦燥、興奮、錯乱、発汗、下痢、発熱、高血圧、固縮、頻脈、ミオクローヌス、自律神経失調等があらわれることがあるので、異常が認められた場合には、投与を中止し、体冷却、水分補給等の全身管理とともに適切な処置を行うこと。[10.2参照]
11.1.2 悪性症候群(頻度不明)
無動緘黙、強度の筋強剛、嚥下困難、頻脈、血圧の変動、発汗等が発現し、それに引き続き発熱がみられる場合がある。抗精神病剤との併用時にあらわれることが多いため、特に注意すること。異常が認められた場合には、抗精神病剤及び本剤の投与を中止し、体冷却、水分補給等の全身管理とともに適切な処置を行うこと。本症発現時には、白血球の増加や血清CKの上昇がみられることが多く、また、ミオグロビン尿を伴う腎機能の低下がみられることがある。
11.1.3 抗利尿ホルモン不適合分泌症候群(SIADH)(頻度不明)
低ナトリウム血症、低浸透圧血症、尿中ナトリウム排泄量の増加、高張尿、痙攣、意識障害等を伴う抗利尿ホルモン不適合分泌症候群(SIADH)があらわれることがあるので、これらの症状があらわれた場合には、直ちに投与を中止し、水分摂取の制限等適切な処置を行うこと。[9.8参照]
11.1.5 痙攣(0.2%)[9.1.5参照]
11.1.6 アナフィラキシー(頻度不明)
アナフィラキシー(呼吸困難、喘鳴、血管浮腫等)があらわれることがある。
11.1.7 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)、多形紅斑(頻度不明)
異常が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.8 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等があらわれた場合には、投与を中止し、適切な処置を行うこと。また、横紋筋融解症による急性腎障害の発症に注意すること。
11.1.9 無顆粒球症(頻度不明)、再生不良性貧血(頻度不明)、汎血球減少症(頻度不明)、好中球数減少(0.2%)、血小板数減少(0.2%)
必要に応じて血液検査を行うこと。
11.1.10 間質性肺疾患(頻度不明)
11.1.11 高血圧クリーゼ(頻度不明)
11.1.12 尿閉(0.2%)
導尿を実施するなど適切な処置を行うこと。
11.2 その他の副作用
| 5%以上 | 1〜5% | 1%未満 | 頻度不明 | |
| 過敏症 | 発疹、そう痒症 | じん麻疹 | 血管浮腫、光線過敏性反応 | |
| 精神神経系 | 傾眠(26.9%)、浮動性めまい(24.4%)、頭痛(19.3%)、不眠症(16.0%) | 易刺激性、異常感覚(錯感覚、感覚鈍麻等)、筋緊張亢進(筋骨格硬直、筋痙縮等)、振戦 | 躁病、激越、落ち着きのなさ、幻覚、せん妄、異常な夢(悪夢等)、無感情、失神、味覚異常、リビドー減退、アカシジア、ジスキネジー、ミオクローヌス | 錯乱状態、神経過敏、鎮静、離人症、錐体外路障害(ジストニーを含む)、協調運動障害、平衡障害 |
| 消化器 | 悪心(33.5%)、腹部不快感(腹痛、膨満、便秘等)(27.2%)、口内乾燥(24.3%)、嘔吐、下痢 | 食欲減退 | 膵炎、歯ぎしり | |
| 感覚器 | 調節障害 | 耳鳴、視覚障害 | 散瞳、閉塞隅角緑内障 | |
| 循環器 | 動悸(13.2%) | 血圧上昇、頻脈 | 血圧低下、起立性低血圧 | |
| 血液 | 異常出血(斑状出血、粘膜出血、胃腸出血等) | 出血時間延長 | ||
| 肝臓 | 肝機能検査値異常(ALT・AST・γ-GTP・LDH・Al-P・血中ビリルビンの上昇等)(10.0%) | 肝炎 | ||
| 泌尿器・生殖器 | 排尿困難 | 頻尿 | 月経障害、射精障害、勃起不全 | 尿失禁、オルガズム障害、無オルガズム症 |
| 代謝・内分泌 | 血中コレステロール増加 | 低ナトリウム血症 | 血中プロラクチン増加 | |
| その他 | 体重減少、発汗(寝汗等)、無力症(疲労、倦怠感等) | ほてり、体重増加 | あくび、悪寒、呼吸困難、脱毛症、骨折 |
13. 過量投与
市販後において、本剤の過量投与、又は他剤やアルコールを併用した本剤の過量投与が報告されている。
13.1 症状
主な症状として、頻脈、意識レベルの変化、散瞳、発作、嘔吐であり、心電図の変化(QT延長、脚ブロック、QRSの延長)、心室性頻脈、徐脈、低血圧、横紋筋融解症、回転性めまい、肝臓壊死、セロトニン症候群及び死亡も報告されている。
13.2 処置
特異的な解毒剤は知られていない。必要に応じて活性炭投与等の適切な処置を行うこと。催吐は薦められない。本剤は分布容積が大きいので、強制利尿、透析、血液灌流及び交換輸血はあまり効果的でない。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.2 服用時の注意
カプセルの内容物を砕いたり、すりつぶしたりせず、そのまま噛まずに服用するよう指導すること。砕いたり、すりつぶしたりして服用すると、本剤の徐放性が失われ、血中濃度が上昇するおそれがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 海外で実施した大うつ病性障害等の精神疾患を有する患者を対象とした、本剤を含む複数の抗うつ剤の短期プラセボ対照臨床試験の検討結果において、24歳以下の患者では、自殺念慮や自殺企図の発現のリスクが抗うつ剤投与群でプラセボ群と比較して高かった。
なお、25歳以上の患者における自殺念慮や自殺企図の発現のリスクの上昇は認められず、65歳以上においてはそのリスクが減少した。[5.1、8.1-8.4、9.1.1、9.1.2、9.7.3参照]
なお、25歳以上の患者における自殺念慮や自殺企図の発現のリスクの上昇は認められず、65歳以上においてはそのリスクが減少した。[5.1、8.1-8.4、9.1.1、9.1.2、9.7.3参照]
15.1.2 主に50歳以上を対象に実施した海外の疫学調査において、選択的セロトニン再取り込み阻害剤及び三環系抗うつ剤を含む抗うつ剤を投与した患者で、骨折のリスクが上昇したとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性に本剤を空腹時単回経口投与したとき、ベンラファキシン未変化体の血漿中濃度は投与6時間後に最高値に達した。本剤の主代謝物であり薬理活性を有するO-脱メチルベンラファキシン(ODV)の血漿中濃度は投与8〜10時間後に最高値に達した。未変化体の最高血漿中濃度(Cmax)及び血漿中濃度−時間曲線下面積(AUC0-∞)は用量比例性を示さなかった10)。
| 投与量(mg) | 測定物質 | Cmax(ng/mL) | t1/2(h) | AUC0-∞(ng・h/mL) |
| 37.5 | 未変化体 | 12±7 | 9.3±3.3 | 206±178 |
| ODVa) | 54±6 | 11.8±3.2 | 1316±311 | |
| 75 | 未変化体 | 33±15 | 7.9±2.3 | 505±257 |
| ODVa) | 98±19 | 12.3±2.1 | 2462±391 | |
| 150 | 未変化体 | 89±65 | 9.7±2.5 | 1830±1753 |
| ODVa) | 176±42 | 11.1±2.7 | 4598±995 | |
| 225 | 未変化体 | 101±20 | 7.6±1.6 | 1471±238 |
| ODVa) | 322±22 | 11.7±1.1 | 8254±547 |
16.1.2 反復投与
健康成人男性に本剤を1日1回7日間反復経口投与したとき、未変化体及びODVのいずれも反復投与開始3日目には定常状態に到達した11)。
| 投与量(mg) | 測定物質 | Cmax(ng/mL) | AUC0-24h(ng・h/mL) | ||
| 1日目 | 7日目 | 1日目 | 7日目 | ||
| 75 | 未変化体 | 38±20 | 46±24 | 485±321 | 630±403 |
| ODVb) | 104±20 | 149±26 | 1732±272 | 2697±430 | |
| 150 | 未変化体 | 108±58 | 143±90 | 1521±1021 | 2186±1680 |
| ODVb) | 196±64 | 276±87 | 3316±1056 | 5237±1728 | |
16.2 吸収
16.2.1 食事の影響
健康成人男性6例に本剤75mgを空腹時及び食後に単回経口投与し、食事の影響を検討した結果、未変化体及びODVのCmax及びAUCに空腹時投与時と食後投与時の差は認められなかった12)。
16.3 分布
16.5 排泄
健康成人男性9例に14C標識ベンラファキシン50mg(非徐放化製剤)を単回経口投与したとき、投与後48時間で総放射能の87%が尿中に排泄され、その内訳は未変化体(4.7%)、ODV(29.4%)、ODVのグルクロン酸抱合体(26.4%)、その他の代謝物(26.5%)であった14)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能障害患者にベンラファキシン(非徐放化製剤)50mgを単回経口投与したとき、未変化体及びODVのAUC0-∞は腎機能の低下に伴い増大する傾向がみられた15)(外国人データ)。[9.2.2参照]
| 対象 | 例数 | 測定物質 | AUC0-∞(ng・h/mL) | CL/Fc)(L/h/kg) | CLr(mL/h/kg) |
| 健康成人 | 18 | 未変化体 | 494±483 | 2.1±1.4 | 73±37 |
| ODV | 2044±880 | 0.36±0.15 | 96±36 | ||
| 軽度腎障害 | 6 | 未変化体 | 458±244 | 2.1±1.8 | 36±12 |
| ODV | 2821±886 | 0.26±0.07 | 65±26 | ||
| 中等度腎障害 | 5 | 未変化体 | 844±839 | 1.3±0.6 | 37±16 |
| ODV | 2047±1045 | 0.46±0.25 | 46±17 |
16.6.2 肝機能障害患者
Child-PughA又はBの肝機能障害患者にベンラファキシン(非徐放化製剤)を単回経口投与したとき、肝機能がより低い集団で未変化体のAUC0-∞は高い値を示したが、ODVのAUC0-∞には一定の傾向はみられなかった16)(外国人データ)。[7.2、7.3、9.3.2参照]
| 対象 | 例数 | 投与量(mg) | 測定物質 | AUC0-∞(ng・h/mL) | CL/Fd)(L/h/kg) |
| 健康成人 | 20 | 75 | 未変化体 | 769±763 | 2.25±1.75 |
| ODV | 2861±1039 | 0.46±0.53 | |||
| Child-PughA | 8 | 37.5 | 未変化体 | 1823±1265e) | 0.90±0.83 |
| ODV | 4231±2289e) | 0.28±0.09 | |||
| Child-PughB | 11 | 37.5 | 未変化体 | 2407±1874e) | 0.62±0.55 |
| ODV | 2651±977e) | 0.94±2.10 |
16.6.3 CYP2D6遺伝子多型別の薬物動態
CYP2D6の遺伝子型より高代謝型(EM)と低代謝型(PM)に分類された健康成人にそれぞれ本剤75mgを空腹時単回経口投与したとき、未変化体とODVの血漿中濃度はCYP2D6表現型の影響を受けることが示唆された17)(外国人データ)。
| CYP2D6表現型 | 例数 | 測定物質 | Cmax(ng/mL) | t1/2(h) | AUC0-∞(ng・h/mL) |
| EM | 7 | 未変化体 | 40±14 | 10.9±2.4 | 591±246 |
| ODV | 104±27 | 13.6±3.2 | 3078±838 | ||
| PM | 6 | 未変化体 | 99±11 | 12.7±1.8 | 2548±451 |
| ODV | 23±12 | 14.4±3.6 | 844±329 |
16.7 薬物相互作用
16.7.1 ハロペリドール
16.7.2 アルプラゾラム
健康成人16例にベンラファキシン(非徐放化製剤)75mgの1日2回反復経口投与下において、アルプラゾラム2mgを併用単回経口投与し薬物動態を検討した。併用によりベンラファキシンの薬物動態にほとんど影響はみられなかったが、アルプラゾラムのAUCは約30%減少した19)(外国人データ)。
16.7.3 イミプラミン
16.7.4 ケトコナゾール(経口剤は国内未発売)
16.7.5 シメチジン
16.7.6 メトプロロール
16.7.7 リスペリドン
16.7.8 インジナビル
16.7.9 リチウム
健康成人12例にベンラファキシン(非徐放化製剤)50mgを1日3回7日間経口投与後、リチウム600mgを併用単回経口投与し薬物動態を検討した。併用により、リチウムの薬物動態には、ほとんど影響はみられなかった27)(外国人データ)。
16.7.10 カルバマゼピン
健康成人16例にカルバマゼピン200mgを1日2回単独反復経口投与あるいはベンラファキシン(非徐放化製剤)50mgを1日3回併用反復経口投与し薬物動態を検討した。ベンラファキシンとカルバマゼピンの薬物動態にほとんど影響はみられなかった28)(外国人データ)。
16.7.11 ジアゼパム
健康成人男性18例にベンラファキシン(非徐放化製剤)50mgを1日3回反復経口投与後、ジアゼパム10mgを併用単回経口投与し薬物動態を検討した。併用により、ベンラファキシンとジアゼパムの薬物動態にほとんど影響はみられなかった29)(外国人データ)。
16.7.12 トルブタミド
健康成人12例にベンラファキシン(非徐放化製剤)37.5mg又は75mgを1日2回反復経口投与後、トルブタミド500mgを併用単回経口投与し薬物動態を検討した。併用により、ベンラファキシン及びトルブタミドの薬物動態にほとんど影響はみられなかった30)(外国人データ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
承認時における臨床試験成績の概要は以下のとおりであった。
17.1.1 国内第III相試験(プラセボ対照試験)
うつ病・うつ状態の患者を対象として、本剤(75mg又は75〜225mg)又はプラセボを8週間投与した結果、主要評価項目であるハミルトンうつ病評価尺度(HAM-D17)合計点の最終評価時におけるベースラインからの平均変化量は下表のとおりであり、本剤(75mg)のプラセボに対する優越性が示された9)。
| 投与群 | 例数 | HAM-D17合計点の平均値(標準偏差) | プラセボ群との対比較a) | |||
| ベースライン | 最終評価時 | ベースラインからの変化量 | 群間差[95%信頼区間] | p値 | ||
| プラセボ群 | 184 | 22.4(4.10) | 13.2(6.73) | −9.2(6.78) | − | − |
| 75mg/日群 | 174 | 22.6(4.05) | 11.8(7.20) | −10.8(7.26) | 1.50[0.14,2.87] | 0.031 |
| 75〜225mg/日群 | 177 | 22.3(4.00) | 12.0(6.69) | −10.3(6.55) | 1.12[−0.24,2.48] | 0.106 |
有害事象発現頻度はプラセボ群で67.2%(123/183例)、75mg/日群で75.3%(131/174例)、75〜225mg/日群で81.7%(147/180例)であった。主な有害事象は、悪心(13.1%、22.4%、29.4%)、鼻咽頭炎(22.4%、20.1%、17.8%)、傾眠(8.2%、12.1%、17.2%)、頭痛(7.7%、9.2%、10.0%)、口渇(7.7%、6.3%、10.0%)であった。
17.1.2 長期継続投与試験
国内第III相試験(プラセボ対照試験)を完了した患者(50例)を対象として、本剤(75〜225mg)を最大44週間投与した結果、治療を継続できた患者では長期間にわたり抗うつ効果が維持された31)。
| 評価時期 | 例数 | HAM-D17合計点 | ベースラインからの変化量 |
| ベースライン | 50 | 12.0(6.10) | − |
| 8週 | 48 | 8.4(4.59) | −3.88(4.61) |
| 24週 | 44 | 6.8(5.46) | −5.68(5.08) |
| 44週 | 40 | 5.7(6.00) | −7.08(5.98) |
有害事象は49/50例に認められ、主な事象は、鼻咽頭炎、頭痛、浮動性めまい、傾眠、便秘、悪心及び血圧上昇であった。
17.1.3 長期継続投与試験
国内第III相試験(ミルナシプラン対照比較試験)を完了した患者(247例)を対象として、本剤(75〜150mg)を最大52週間投与した結果、治療を継続できた患者では長期間にわたり抗うつ効果が維持された31)。
| 評価時期 | 例数 | HAM-D17合計点 | ベースラインからの変化量 |
| ベースライン | 247 | 10.0(6.09) | − |
| 8週 | 238 | 7.4(5.79) | −2.60(5.56) |
| 26週 | 201 | 6.7(5.65) | −3.44(5.64) |
| 52週 | 167 | 5.0(4.98) | −5.40(5.54) |
有害事象発現頻度は98.4%(243/247例)であった。主な事象は、鼻咽頭炎(66.0%)、悪心(48.6%)、傾眠(48.2%)、浮動性めまい(40.9%)、不眠症(40.9%)、頭痛(38.9%)であった。
18. 薬効薬理
18.1 作用機序
18.1.1 本薬及び活性代謝物であるO-脱メチルベンラファキシン(ODV)はin vitroにおいてラット脳シナプトソーム分画におけるセロトニン及びノルアドレナリンの取り込み阻害作用を示し、ドパミンの取り込みに対し弱い阻害作用を示した32)。in vivoにおいてもセロトニン及びノルアドレナリンの取り込み阻害作用を示した33)。
18.1.2 ラット前頭葉皮質における細胞外セロトニン及びノルアドレナリンの濃度を共に増加させたが、セロトニンの増加は一過性かつ軽度であった33)。
18.2 抗うつ作用
19. 有効成分に関する理化学的知見
19.1. ベンラファキシン塩酸塩
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<イフェクサーSRカプセル37.5mg>
70カプセル[14カプセル(PTP)×5]
100カプセル[10カプセル(PTP)×10]
500カプセル[10カプセル(PTP)×50]
100カプセル[瓶]
<イフェクサーSRカプセル75mg>
100カプセル[10カプセル(PTP)×10]
500カプセル[10カプセル(PTP)×50]
100カプセル[瓶]
23. 主要文献
- 社内資料:毒性試験(2015年9月28日承認、CTD2.4.5.3)
- 社内資料:胎児移行性(ウサギ)(GTR-17290)(2015年9月28日承認、CTD2.6.4.4.4)
- 社内資料:乳汁中排泄(ラット)(GTR-17952)(2015年9月28日承認、CTD2.6.4.6.3)
- Ilett KF,et al., Br J Clin Pharmacol., 53 (1), 17-22, (2002) »PubMed »DOI
- Emslie GJ,et al., J Am Acad Child Adolesc Psychiatry., 46 (4), 479-488, (2007) »PubMed »DOI
- Hammad TA,et al., Arch Gen Psychiatry., 63 (3), 332-339, (2006) »PubMed »DOI
- Harvey AT,et al., Arch Gen Psychiatry., 57 (5), 503-509, (2000) »PubMed »DOI
- Debonnel G,et al., Int J Neuropsychopharmacol., 10 (1), 51-61, (2007) »PubMed »DOI
- 社内資料:国内第3相試験(B2411263試験)(2015年9月28日承認、CTD2.7.6.35)
- 社内資料:健康成人における単回投与時の薬物動態(156-JA試験)(2015年9月28日承認、CTD2.7.6.8)
- 社内資料:健康成人における反復投与時の薬物動態(153-JA試験)(2015年9月28日承認、CTD2.7.6.9)
- 社内資料:薬物動態における食事の影響(156-JA試験)(2015年9月28日承認、CTD2.7.1.2.4)
- 社内資料:タンパク結合率(in vitro)(2015年9月28日承認、CTD2.7.2.2.1.1)
- Howell SR,et al., Xenobiotica., 23 (4), 349-359, (1993) »PubMed »DOI
- 社内資料:腎機能障害患者における薬物動態(2015年9月28日承認、CTD2.7.2.3.5)
- 社内資料:肝機能障害患者における薬物動態(2015年9月28日承認、CTD2.7.2.3.6)
- Preskorn S,et al., J Clin Psychopharmacol., 29 (1), 39-43, (2009) »PubMed »DOI
- 社内資料:ハロペリドールとの薬物相互作用(95-059-MA試験)(2015年9月28日承認、CTD2.7.2.1.2.5.10)
- Amchin J,et al., Psychopharmacol Bull., 34 (2), 211-219, (1998) »PubMed
- 社内資料:イミプラミンとの薬物相互作用(129-US試験)(2015年9月28日承認、CTD2.7.2.1.2.5.7)
- Lindh JD,et al., Eur J Clin Pharmacol., 59 (5-6), 401-406, (2003) »PubMed »DOI
- Troy SM,et al., J Clin Pharmacol., 38 (5), 467-474, (1998) »PubMed »DOI
- 社内資料:メトプロロールとの薬物相互作用(132-SW試験)(2015年9月28日承認、CTD2.7.2.1.2.5.6)
- Amchin J,et al., J Clin Pharmacol., 39 (3), 297-309, (1999) »PubMed
- Levin GM,et al., Psychopharmacol Bull., 35 (2), 62-71, (2001) »PubMed
- Jann MW,et al., Eur J Clin Pharmacol., 68 (5), 715-721, (2012) »PubMed »DOI
- Troy SM,et al., J Clin Pharmacol., 36 (2), 175-181, (1996) »PubMed »DOI
- 社内資料:カルバマゼピンとの薬物相互作用(133-UK試験)(2015年9月28日承認、CTD2.7.2.2.5.2)
- Troy SM,et al., J Clin Pharmacol., 35 (4), 410-419, (1995) »PubMed »DOI
- 社内資料:トルブタミドとの薬物相互作用(118-US試験)(2015年9月28日承認、CTD2.7.2.2.5.11)
- 社内資料:長期投与試験(B2411264試験、818-JA試験)(2015年9月28日承認、CTD2.7.6.44)
- 社内資料:ラット脳シナプトソームにおけるモノアミン取り込み阻害作用(2015年9月28日承認、CTD2.6.2.2.1.2)
- 社内資料:ラット大脳前頭皮質における細胞外5-HTおよびNA濃度増加作用(RPT-43824)(2015年9月28日承認、CTD2.6.2.2.2.1)
- 社内資料:尾懸垂試験における無動時間短縮作用(マウス)(RPT-43898)(2015年9月28日承認、CTD2.6.2.2.2.2)
- 社内資料:強制水泳試験における無動時間短縮作用(マウス)(GTR-21946)(2015年9月28日承認、CTD2.6.2.2.2.3)
- 社内資料:学習性無力モデルにおける回避学習改善効果(ラット)(GTR-21948)(2015年9月28日承認、CTD2.6.2.2.2.4)
- 社内資料:居住者・侵入者モデルにおける攻撃行動に対する作用(ラット)(2015年9月28日承認、CTD2.6.2.2.2.5)
24. 文献請求先及び問い合わせ先
文献請求先
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
製品情報問い合わせ先
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
26. 製造販売業者等
26.1 製造販売元
ヴィアトリス製薬合同会社
東京都港区麻布台一丁目3番1号