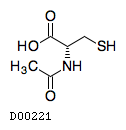
医薬品情報
| 総称名 | アセチルシステイン |
|---|---|
| 一般名 | アセチルシステイン |
| 欧文一般名 | Acetylcysteine |
| 製剤名 | アセチルシステイン液 |
| 薬効分類名 | アセトアミノフェン中毒解毒剤 |
| 薬効分類番号 | 3929 |
| ATCコード | V03AB23 |
| KEGG DRUG |
D00221
アセチルシステイン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年3月 改訂(第1版)

|
4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アセチルシステイン内用液17.6%「あゆみ」 | ACETYLCYSTEINE Oral Solution 17.6%[AYUMI] | あゆみ製薬 | 3929006S1049 | 91.5円/mL |
4. 効能または効果
アセトアミノフェン過量摂取時の解毒
6. 用法及び用量
通常、本剤又は本剤を希釈した液を、初回にアセチルシステインとして140mg/kg、次いでその4時間後から70mg/kgを4時間毎に17回、計18回経口投与する。経口投与が困難な場合は、胃管又は十二指腸管により投与する。投与後1時間以内に嘔吐した場合は、再度同量を投与する。
7. 用法及び用量に関連する注意
7.1 アセトアミノフェン摂取後なるべく早期に投与を開始すること。8時間以内が望ましいが、24時間以内であれば効果が認められることが報告されている。
7.2 本剤投与の要否は、以下の全てを参考に決定すること。
7.2.1 アセトアミノフェンの血漿中濃度
本電子添文末尾に記載したノモグラムにおいて、アセトアミノフェンの血漿中濃度がアセチルシステイン投与推奨ラインより上である場合に投与する。摂取後4時間までは血漿中濃度がピークとなっていないため、参考にならない。
7.2.2 アセトアミノフェンの摂取量
血漿中濃度が迅速に測定できない場合でも、アセトアミノフェンとして7.5g又は150mg/kg以上の摂取が疑われる場合には投与する。
7.2.3 配合剤による中毒、薬剤の常用者、あるいは基礎疾患のある患者の場合
以下の(1)〜(3)に示す患者には、摂取量が上記7.2.1、7.2.2の目安以下であっても本剤の投与を考慮すべきである。
(1)以下の配合剤による中毒の場合、相互作用によってアセトアミノフェンの毒性が強く発現するとの報告がある。
・エテンザミド
・無水カフェイン
・ブロムワレリル尿素
(2)以下の併用薬を服用中である場合、肝薬物代謝酵素の誘導によってアセトアミノフェンの毒性が強く発現するとの報告がある。
・カルバマゼピン
・イソニアジド
・フェノバルビタール
・フェニトイン
・リファンピシン
(3)アセトアミノフェンやアルコールの常用者、肝疾患のある患者、絶食状態や低栄養状態が続いている患者の場合、低用量でもグルタチオンの枯渇が生じるおそれがある。
7.3 「患者の体重と本剤投与量の対比表」(本電子添文末尾に記載)を参考に投与すること。
7.4 本剤は、アセトアミノフェンの単回過剰摂取によって発症した急性の中毒には有効であるが、治療量以上を複数回投与して生じた中毒で、特に初回の過量摂取から24〜48時間以上経過している場合、有効性は期待できないことが多い。
8. 重要な基本的注意
8.1 必要に応じて、本剤投与の前に、催吐、胃洗浄、活性炭投与等を考慮すること。なお、患者が意識障害の場合あるいは咽頭反射が抑制されている場合は、これらの処置の前に気道の確保と誤嚥防止を目的として、気管内チューブ(カフ付きが望ましい)を挿管する等の処置を行うこと。
8.2 活性炭を投与した場合は、1時間以上経過してから本剤を投与すること。活性炭を反復投与する場合は、本剤と2時間毎に交互に投与すること。活性炭はin vitroで本剤を吸着することが確認されていることから、本剤の効力を減弱させる可能性がある。
8.3 本剤を希釈して投与すると嘔吐の悪化傾向を最小限に抑えることができる。なお、希釈はソフトドリンクで行う方が望ましい。
8.4 本剤を通常の使用量より多く投与すると、嘔吐を促進し、そのため期待する薬効が得られないことがある。
8.5 本剤の使用後も、肝機能、腎機能、血糖、電解質等の臨床検査を必要に応じて行い、経過に注意すること。
8.6 本剤投与にも関わらず肝障害が重症化する場合は、血液ろ過透析等、劇症肝不全に準じた強力な肝補助療法が必要となる。必要に応じて、早めに治療可能な施設に移送すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
胃出血の危険性がある患者(食道静脈瘤、消化性潰瘍などの患者)
本剤の投与により嘔気、嘔吐が発現することがあるため、アセトアミノフェンによる肝毒性が発現する危険性が、上部胃腸管系出血の危険性を上回ると判断される場合にのみ投与すること。
9.3 肝機能障害患者
肝機能障害患者では、健康成人と比較して本剤の血中濃度が高くなることが報告されている。
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.5.2 アセトアミノフェン中毒で、アセチルシステイン投与期間に胎児を出産した妊婦4例についてアセチルシステインの胎盤通過性が検討されており、アセチルシステインは生存胎児の臍帯血中及び死亡胎児の心臓血液中に存在し、ヒト胎盤を通過することが分かっている。母親は回復し、胎児においてアセチルシステインに関する毒性は認めなかったとの報告がある1)。
9.5.3 妊娠ラットにアセチルシステインを経口投与して胎児への移行を調べた結果、胎児中の総アセチルシステイン濃度は母体血漿及び胎盤中の濃度より低く、アセチルシステインの胎児移行は胎盤である程度阻止されていると推測されるとの報告がある2)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
成人と同様に、「患者の体重と本剤投与量の対比表」(本電子添文末尾に記載)を参考に投与すること。[17.3.1参照]
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
舌の腫脹、紅斑、血管浮腫等の異常が認められた場合には、必要に応じ投与を中止し、適切な処置を行うこと。
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 過敏症 | 発疹(ときには発熱を伴う)、蕁麻疹等のアレルギー症状 | |
| 消化器 | 嘔気、嘔吐 | |
| その他 | スルフヘモグロビン血症 |
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 経口用にのみ使用すること。
14.1.2 開栓後の残液及び希釈後の液は保存して服用させないこと(廃棄すること)。
16. 薬物動態
16.1 血中濃度
16.1.1 経口投与における血漿中濃度(外国人データ)
健康成人6名(男性2名,女性4名)にアセチルシステイン(AC)400mgを空腹時に単回経口投与注1)した時の血漿中AC濃度は、投与後速やかに上昇し、投与後30分に還元型AC及び総ACともに最高濃度(Cmax)3.47μmol/L及び9.95μmol/Lを示した。その後の消失半減期は総ACでは6.25時間であった。吸収率は還元型ACで4.0%、総ACでは9.1%であった3)4)。
図1 AC400mg単回経口投与時の血漿中濃度推移(健康成人)
また、用量の増加注1)(200、600、1200mg)に伴い、還元型ACのCmaxは増加し、最高濃度到達時間は遅延した。AC600mgを1日2回、5日間反復経口投与注1)したときの血漿中AC濃度推移は、単回経口投与時と同程度であった。
図2 AC単回経口投与時の血漿中濃度推移(健康成人)
図3 AC600mg反復経口投与時の血漿中濃度推移(健康成人)
注1)本剤の承認された用法及び用量については、6.用法及び用量の項を参照すること。
16.2 吸収
16.2.1 生物学的利用率(外国人データ)
健康成人10名(男性5名,女性5名)に対し、アセチルシステインを200mg、600mg、1200mgの用量で単回投与及び600mgを1日2回、5日間反復投与したときの血中薬物動態は下表のとおりであった4)。
| 投与量 | ||||
| 200mg | 600mg | 1200mg | 600mg反復 | |
| バイオアベイラビリティ(%) | 7.6±2.2 | 8.3±2.5 | 11.6±2.8 | 8.3±2.3 |
16.3 分布
16.3.1 分布容積(外国人データ)
慢性肝障害患者(アルコール性、原発性胆汁性、二次胆管狭窄)9名(男性7名、女性2名)及び健康成人6名(男性4名、女性2名)にアセチルシステイン600mgを単回静脈内投与した。分布容積は慢性肝障害患者が25.5±8.4L、健康成人が17.4±2.8Lであった5)。
16.4 代謝
ラットに35S-アセチルシステインを200mg/kg単回経口投与したとき、肝臓において投与後2時間後にシステイン及びシスチンが認められた6)。
16.5 排泄
ラットに35S-アセチルシステインを200mg/kg単回経口投与したとき、投与後24時間の尿中排泄率は約56%であった6)。
16.6 特定の背景を有する患者
肝機能障害患者
慢性肝障害患者(アルコール性、原発性胆汁性、二次性胆管狭窄)9名(男性7名、女性2名)及び健康成人6名(男性4名、女性2名)にアセチルシステイン600mgを単回静脈内投与注2)した時、血漿中アセチルシステイン濃度は肝障害患者の方が高濃度で推移し、消失半減期は健康成人で2.6時間であったのに対し、肝障害患者では4.9時間と有意に遅延した。この他、肝障害患者では、AUCが有意に高く、全身クリアランスは有意に低かった(外国人データ)5)。
| 被験者(例数) | T1/2(hr) | AUC(mg・hr/L) | Vdss(L) | Clrtot(L/hr) |
| 健康成人(n=6) | 2.6±0.3 | 93.9±9.6 | 17.4±2.8 | 6.5±0.8 |
| 肝障害患者(n=9) | 4.9±1.7 | 152.3±50.4 | 25.5±8.4 | 4.5±1.9 |
注2)本剤の承認された用法及び用量については、6.用法及び用量の項を参照すること。
17. 臨床成績
17.2 製造販売後調査等
17.2.1 使用成績調査
使用成績調査での96例(男性20例、女性76例)において13例(13.5%)に副作用が認められた。
主な副作用は、嘔気4件(4.2%)、嘔吐3件(3.1%)であった7)。
主な副作用は、嘔気4件(4.2%)、嘔吐3件(3.1%)であった7)。
17.3 その他
17.3.1 アセトアミノフェン過量服用に対する市販後臨床使用効果(外国人データ)
アセトアミノフェン過量摂取後24時間以内で、[1]血漿中アセトアミノフェン濃度が、アセチルシステイン投与推奨ライン注1)よりも上の患者、あるいは[2]血漿中アセトアミノフェン濃度が測定されていない場合、推定アセトアミノフェン摂取量が成人で7.5g以上、小児で140mg/kg以上の患者2540例(女子69.2%、10〜30歳が78.3%)に対し、アセチルシステインを初回に140mg/kg、その4時間後から70mg/kgを4時間毎に17回、経口あるいは経胃・経十二指腸投与注2)した結果の概要は以下のとおりであった8)。[9.7参照]
・アセトアミノフェンの初期の血中濃度がprobable-riskライン注1)よりも上の患者1462例において、アセチルシステインの投与を開始するまでの時間毎の重症肝障害(AST又はALTが1000IU以上)発現率は下表のとおりであった。
| アセチルシステインの投与を開始するまでの時間(hr) | 重症肝障害発現率(%) | |
| probable-risk群注3) | high-risk群注3) | |
| 0-10 | 6.1(32/527) | 8.3(17/206) |
| 10-24 | 26.4(247/935) | 34.4(199/578) |
| 16-24 | − | 41.0(116/283) |
・死亡率は0.43%(11/2540)であった。内訳はアセチルシステイン投与推奨ラインよりも上の群では0.54%(11/2023)、probable-risk群では0.68%(10/1462)、high-risk群では1.28%(10/784)、また、このhigh-risk群の中でさらにアセトアミノフェン摂取後16時間以降に治療が開始された群では3.18%(9/283)であった。
注1)本電子添文末尾のノモグラム参照
注2)投与後1時間以内に嘔吐した場合は、同量を再投与した。
注3)アセトアミノフェンの初期の血中濃度が、probable-riskラインよりも上の群を「probable-risk群」、同様にhigh-riskラインよりも上の群を「high-risk群」とした。probable-risk群はhigh-risk群の患者を含む。
18. 薬効薬理
18.1 作用機序
アセトアミノフェンは、経口投与後速やかに消化管から吸収され、尿中における代謝物は、その大部分がグルクロン酸抱合体(49〜54%)と硫酸抱合体(28〜33%)であり、2〜3%は代謝されずアセトアミノフェンとして存在する。また、およそ15%はチトクロームP450代謝経路に入り、代謝産物としてN-アセチル-p-ベンゾキノンイミン(NAPQI)及び3-ヒドロキシアセトアミノフェンを生じる。アセトアミノフェン中毒における肝障害、腎障害は、NAPQIが引き起こすとされている。NAPQIはグルタチオン抱合反応によって代謝され、メルカプツール酸として尿中に排泄されるが、アセトアミノフェンの大量服用によってNAPQIが過剰産生されると、グルタチオンが枯渇するとされている。アセチルシステインはグルタチオンの前駆物質として働き、解毒作用を示すと考えられている9)10)。
19. 有効成分に関する理化学的知見
19.1. アセチルシステイン
22. 包装
20mL×10本[バイアル]
23. 主要文献
- Horowitz,Rivka S.et al., Clin Toxicol, 35 (5), 447-451, (1997) »PubMed
- 安斎則夫 他, 応用薬理, 26 (2), 249-260, (1983)
- Olsson,B.et al., Eur J Clin Pharmacol, 34, 77-82, (1988) »PubMed
- Borgstrom,L.et al., Biopharm Drug Dispos, 11 (2), 131-136, (1990) »PubMed
- Jones,A.L.et al., Aliment Pharmacol Ther, 11, 787-791, (1997) »PubMed
- Sheffner,A.L.et al., Biochem Pharmacol, 15, 1523-1535, (1966) »PubMed
- 末信敏秀 他, 中毒研究, 19 (4), 383-394, (2006)
- Smilkstein,M.J.et al., New Engl J Med, 24, 1557-1562, (1988)
- 大谷美奈子, 日医雑誌, 115 (5), 677-679, (1996)
- Manyike,P.et al., Clin Pharmacol Ther, 67, 275-282, (2000) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
あゆみ製薬株式会社
〒104-0061
東京都中央区銀座四丁目12番15号
電話:0120-137-413
製品情報問い合わせ先
あゆみ製薬株式会社
〒104-0061
東京都中央区銀座四丁目12番15号
電話:0120-137-413
26. 製造販売業者等
26.1 製造販売元
あゆみ製薬株式会社
東京都中央区銀座四丁目12番15号
その他の説明
その他の説明
●ノモグラム8)
※本ノモグラムの使用にあたっては、「7.用法及び用量に関連する注意」欄をよく読むこと。
●患者の体重と本剤投与量の対比表
1.体重20kg以上の患者の場合
下表を参考に、本剤をそのまま、あるいはソフトドリンク(又は水)で希釈して投与する。(希釈後の液は、アセチルシステイン濃度として約5%となる)
| 患者体重(kg) | 初回投与 | 継続投与 | ||
| 本剤の量(mL) | 希釈液の量(mL) | 本剤の量(mL) | 希釈液の量(mL) | |
| 1kgあたり | 0.8 | 2.0 | 0.4 | 1.0 |
| 105-109 | 88 | 220 | 44 | 110 |
| 100-104 | 84 | 210 | 42 | 105 |
| 95-99 | 80 | 200 | 40 | 100 |
| 90-94 | 76 | 190 | 38 | 95 |
| 85-89 | 72 | 180 | 36 | 90 |
| 80-84 | 68 | 170 | 34 | 85 |
| 75-79 | 64 | 160 | 32 | 80 |
| 70-74 | 60 | 150 | 30 | 75 |
| 65-69 | 56 | 140 | 28 | 70 |
| 60-64 | 52 | 130 | 26 | 65 |
| 55-59 | 48 | 120 | 24 | 60 |
| 50-54 | 44 | 110 | 22 | 55 |
| 45-49 | 40 | 100 | 20 | 50 |
| 40-44 | 36 | 90 | 18 | 45 |
| 35-39 | 32 | 80 | 16 | 40 |
| 30-34 | 28 | 70 | 14 | 35 |
| 25-29 | 24 | 60 | 12 | 30 |
| 20-24 | 20 | 50 | 10 | 25 |
2.体重20kg未満の患者の場合
下表より本剤の投与量を算出し、そのまま、あるいはソフトドリンク(又は水)で希釈して投与する。(希釈後の液は、アセチルシステイン濃度として約5%となる)
| 患者体重(kg) | 初回投与 | 継続投与 | ||
| 本剤の量(mL) | 希釈液の量(mL) | 本剤の量(mL) | 希釈液の量(mL) | |
| 1kgあたり | 0.8 | 2.0 | 0.4 | 1.0 |