医薬品情報
| 総称名 | フィナステリド |
|---|---|
| 一般名 | フィナステリド |
| 欧文一般名 | Finasteride |
| 製剤名 | フィナステリド錠 |
| 薬効分類名 | 5α-還元酵素II型阻害薬 男性型脱毛症用薬 |
| 薬効分類番号 | 2499 |
| ATCコード | D11AX10 |
| KEGG DRUG |
D00321
フィナステリド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年8月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| フィナステリド錠0.2mg「クラシエ」 | Finasteride Tablets 0.2mg「Kracie」 | 大興製薬 | 249900XF1064 | 劇薬, 処方箋医薬品注) | |
| フィナステリド錠1mg「クラシエ」 | Finasteride Tablets 1mg「Kracie」 | 大興製薬 | 249900XF2060 | 劇薬, 処方箋医薬品注) |
2. 禁忌
4. 効能または効果
男性における男性型脱毛症の進行遅延
5. 効能または効果に関連する注意
5.1 男性における男性型脱毛症のみの適応である。他の脱毛症に対する適応はない。
5.2 20歳未満での安全性及び有効性は確立されていない。
5.3 女性に対する適応はない。海外で実施した閉経後女性の男性型脱毛症を対象とした12ヵ月間のプラセボ対照二重盲検比較試験(n=137)において、フィナステリドの有効性は認められなかった1)。
6. 用法及び用量
男性成人には、通常、フィナステリドとして0.2mgを1日1回経口投与する。なお、必要に応じて適宜増量できるが、1日1mgを上限とする。
7. 用法及び用量に関連する注意
3ヵ月の連日投与により効果が発現する場合もあるが、効果が確認できるまで通常6ヵ月の連日投与が必要である。また、効果を持続させるためには継続的に服用すること。なお、増量による効果の増強は、確認されていない。
本剤を6ヵ月以上投与しても男性型脱毛症の進行遅延がみられない場合には投薬を中止すること。また、6ヵ月以上投与する場合であっても定期的に効果を確認し、継続投与の必要性について検討すること。
本剤を6ヵ月以上投与しても男性型脱毛症の進行遅延がみられない場合には投薬を中止すること。また、6ヵ月以上投与する場合であっても定期的に効果を確認し、継続投与の必要性について検討すること。
8. 重要な基本的注意
8.1 本剤の使用に際しては、患者に次の事項を説明すること。[2.2、9.5、9.6、14.1参照]
・本剤を妊婦に投与すると、本剤の薬理作用(DHT低下作用)により、男子胎児の生殖器官等の正常発育に影響を及ぼすおそれがある。
・本剤を分割・粉砕しないこと。
本剤が粉砕・破損した場合、妊婦又は妊娠している可能性のある女性及び授乳中の女性は取扱わないこと。本剤はコーティングされているので、割れたり砕けたりしない限り、通常の取扱いにおいて有効成分に接触することはない。
本剤が粉砕・破損した場合、妊婦又は妊娠している可能性のある女性及び授乳中の女性は取扱わないこと。本剤はコーティングされているので、割れたり砕けたりしない限り、通常の取扱いにおいて有効成分に接触することはない。
8.2 本剤との因果関係は明らかではないが、自殺念慮、自殺企図、自殺既遂が報告されている。患者の状態を十分に観察するとともに、自殺念慮又は自殺企図があらわれた場合には本剤の服用を中止し、速やかに医師等に連絡するよう患者に指導すること。[9.1.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 うつ病、うつ状態又はその既往歴、自殺念慮又は自殺企図の既往歴を有する患者
本剤との因果関係は明らかではないが、自殺念慮、自殺企図、自殺既遂が報告されている。[8.2参照]
9.3 肝機能障害患者
本剤は主に肝臓で代謝される。肝機能障害患者を対象とした臨床試験は実施していない。
9.5 妊婦
9.6 授乳婦
9.7 小児等
小児等に対する適応はない。小児等を対象とした臨床試験は実施していない。
9.8 高齢者
前立腺肥大症患者を対象にした臨床試験(フィナステリド5mg)では、高齢者と非高齢者において副作用の発現割合に明らかな差は認められていない。しかし、一般に高齢者では生理機能が低下しているので注意すること。
高齢者における有効性は確立していない。
高齢者における有効性は確立していない。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肝機能障害(頻度不明)
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 過敏症 | そう痒症、じん麻疹、発疹、血管浮腫(口唇、舌、咽喉及び顔面腫脹を含む) | ||
| 生殖器 | リビドー減退注1) | 勃起機能不全注1)、射精障害注1)、精液量減少 | 睾丸痛、血精液症、男性不妊症・精液の質低下(精子濃度減少、無精子症、精子運動性低下、精子形態異常等)注2) |
| 肝臓 | AST上昇、ALT上昇、γ-GTP上昇 | ||
| その他 | 乳房圧痛、乳房肥大、抑うつ症状、めまい |
12. 臨床検査結果に及ぼす影響
国内で実施した24歳から50歳の男性型脱毛症患者において、血清前立腺特異抗原(PSA)の濃度が約40%低下した。海外臨床試験において、高年齢層の前立腺肥大症患者へのフィナステリド投与により血清PSA濃度が約50%低下した2)。したがって、本剤投与中の男性型脱毛症患者に対し前立腺癌診断の目的で血清PSA濃度を測定する場合は、2倍した値を目安として評価すること。
14. 適用上の注意
14.1 調剤及び服用時の注意
14.2 薬剤交付時の注意
14.2.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することがある。
14.2.2 本剤は、食事の有無にかかわらず投与できる。[16.2.1参照]
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 市販後において、本剤を投与された患者で男性乳癌が報告されている。フィナステリド長期投与と男性乳癌の発現との因果関係は不明である。
(参考)
海外で実施された、3,047例(平均年齢:63歳)の前立腺肥大症患者を対象としたプラセボ及び比較対照薬との4〜6年間の臨床試験において、フィナステリド5mg投与群(本剤承認用量の5〜25倍用量)で4例の乳癌の報告があったが、フィナステリド非投与群ではみられなかった3)。一方、別の3,040例(平均年齢:64歳)の前立腺肥大症患者を対象としたプラセボとの4年間の海外臨床試験では、プラセボ投与群において2例の乳癌の報告があったが、フィナステリド5mg投与群ではみられなかった4)。また、18,882例(平均年齢:63歳)の健康男性を対象としたプラセボとの7年間の海外臨床試験では、フィナステリド5mg投与群及びプラセボ投与群で各1例ずつ乳癌の報告があった5)。なお、海外の市販後において、フィナステリド1日5mgを投与された患者で男性乳癌が報告されている。
15.1.2 海外で実施された、18,882例(平均年齢:63歳)の健康男性を対象としたフィナステリド5mg(本剤承認用量の5〜25倍用量)又はプラセボを7年間投与する臨床試験5)において、Modified Gleason Score* 8〜10の高悪性度前立腺癌の発現率が、プラセボ投与群(1.1%)と比較して、フィナステリド5mg投与群(1.8%)で高かった(相対リスク1.70[95%信頼区間:1.23-2.34])との報告がある6)。
*組織学的悪性度の指標
15.1.3 海外臨床試験において、本剤投与により前立腺容積が減少したとの報告がある。
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人にフィナステリド0.2mg及び1mgを単回経口投与した時、血漿中濃度は投与後1.2及び1.4時間に最高血漿中濃度(Cmax)に達し、以後3及び4時間の半減期(t1/2)で消失した(表1)8)。
| 投与量(mg) | AUC0-24(ng・hr/mL)† | Cmax(ng/mL)† | Tmax(hr)†† | t1/2(hr)§ |
| 0.2 (n=12) | 2.19±3.70 | 0.56±0.42 | 1.17±0.39 | 2.76±0.43 |
| 1 (n=11) | 49.29±12.40 | 9.89±2.56 | 1.36±0.92 | 4.15±0.26 |
16.1.2 反復投与
健康成人にフィナステリド0.2mg及び1mgを1日1回17日間反復経口投与した時、いずれの投与量においても血漿中濃度は投与2〜3日目に定常状態に達した。投与17日目における0.2mg及び1mgの血漿中濃度は、投与後1.2及び1.5時間にCmaxに達し、以後4時間のt1/2で消失した。また、0.2mg及び1mg投与の定常状態における血漿中濃度はほぼ用量に比例した(表2)9)。
| 投与量(mg) | AUC0-24(ng・hr/mL)† | Cmax(ng/mL)† | Tmax(hr)†† | t1/2(hr)§ |
| 0.2 (n=12) | 10.39±3.84 | 1.96±0.42 | 1.17±0.58 | 4.11±0.38 |
| 1 (n=11) | 60.49±17.02 | 10.84±2.05 | 1.45±0.93 | 4.13±0.23 |
16.1.3 生物学的同等性試験
フィナステリド錠1mg「クラシエ」とプロペシア錠1mgを、クロスオーバー法によりそれぞれ1錠(フィナステリドとして1mg)健康成人男子に絶食単回経口投与して血漿中フィナステリド濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された10)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0-24(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | t1/2(hr) | |
| フィナステリド錠1mg「クラシエ」 | 44.66±9.79 | 7.90±1.52 | 1.75±0.93 | 4.28±1.17 |
| プロペシア錠1mg | 46.88±11.96 | 7.70±2.24 | 1.98±1.02 | 4.50±0.94 |
図1 血漿中フィナステリド濃度推移
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 食事の影響
16.2.2 生物学的利用率
健康成人にフィナステリド5mg注)を点滴静脈内投与時の血漿クリアランスは約165mL/min、分布容積は約76Lであり、また、AUCの比較により算出した5mg注)経口投与時の生物学的利用率は約80%であった12)(外国人データ)。
16.3 分布
16.4 代謝
16.4.1 ヒト肝ミクロソームを用いたin vitro試験により、主要代謝物は側鎖の酸化により生成するω-水酸化体及びω-カルボン酸体であり、その酸化にはチトクロームP450(CYP)分子種のCYP3A4が関与することが示された15)。CYP2C19は代謝に関与していなかった16)。
16.4.2 ヒト肝ミクロソームを用いたin vitro試験により、フィナステリドはCYP1A2、2A6、2C9、2D6及び3A4を阻害しなかったが、CYP2C19に対するIC50値は0.97μM(フィナステリド1mg経口投与時のCmaxの30倍以上)であった17)。
16.5 排泄
16.5.1 国内試験成績
健康成人にフィナステリド100mg注)を単回経口投与後1日間の尿中への排泄率は、投与量の0.04%であった18)。
16.5.2 海外試験成績(参考)
健康成人に14C標識フィナステリド38mg注)を単回経口投与後7日間の尿中及び糞中放射能排泄率は、それぞれ39%及び57%であった19)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者における体内動態
重度の腎機能障害患者(クレアチニンクリアランスCLcr<30mL/min)と健康成人(CLcr≧90mL/min)における14C標識フィナステリド10mg注)単回経口投与時の血漿中薬物動態パラメータを比較したところ、両群間で差異は認められなかった(腎機能障害患者における反復投与試験は実施していない)20)(外国人データ)。
16.6.2 高齢者における体内動態
健康な高齢者(65〜71歳)と非高齢者(20〜60歳)におけるフィナステリド5mg注)単回経口投与時の血漿中薬物動態パラメータを比較したところ、両群間で差異は認められなかった21)。
16.7 薬物相互作用
16.7.1 オメプラゾールとの併用
健康成人(CYP2C19のExtensive Metabolizer)にフィナステリド1mgを1日1回3日間反復経口投与し、投与3日目は同時にオメプラゾール20mgを単回経口投与した際、オメプラゾールの血漿中薬物動態における薬物相互作用は認められなかった22)。
16.7.2 他剤との併用
フィナステリド5mg注)あるいは10mg注)とアンチピリン、プロプラノロール、ジゴキシン、グリベンクラミド、ワルファリン並びにテオフィリンとの併用時に、各併用薬の血漿中薬物動態における薬物相互作用は認められなかった23)(外国人データ)。
16.8 その他
フィナステリド錠0.2mg「クラシエ」は「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン(平成24年2月29日薬食審査発0229第10号)」に基づき、フィナステリド錠1mg「クラシエ」を標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた10)。
注)本剤の承認用法及び用量は、男性成人には、通常、フィナステリドとして0.2mgを1日1回経口投与する。なお、必要に応じて適宜増量できるが、1日1mgを上限とする。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II/III相二重盲検比較試験
24歳から50歳の男性型脱毛症患者(Modified Norwood-Hamilton分類24)25)IIvertex、IIIvertex、IV及びV:図1)414例を対象とした48週間のプラセボ対照二重盲検比較試験において、頭頂部毛髪の変化を写真により7段階で評価した結果、フィナステリド錠投与群(0.2mg/日及び1mg/日)はプラセボ群と比較して統計的に有意な改善を示したが、実薬群間では統計的な有意差は認められなかった(図2)。投与前と比べ48週で改善と判定されたのは、0.2mg投与群で54.2%(71/131例)、1mg投与群で58.3%(77/132例)、プラセボ群で5.9%(8/135例)であった。
副作用(臨床検査値異常変動を含む)の発現割合は0.2mg投与群で1.5%(2/137例)、1mg投与群で6.5%(9/139例)、プラセボ群で2.2%(3/138例)であった。性機能に関する副作用は0.2mg投与群で1.5%(2/137例)、1mg投与群で2.9%(4/139例)、プラセボ群で2.2%(3/138例)に認められた26)。フィナステリド錠投与群(0.2mg及び1mg)に認められた主な症状はリビドー減退1.1%(3/276例)、勃起機能不全0.7%(2/276例)であった27)。
副作用(臨床検査値異常変動を含む)の発現割合は0.2mg投与群で1.5%(2/137例)、1mg投与群で6.5%(9/139例)、プラセボ群で2.2%(3/138例)であった。性機能に関する副作用は0.2mg投与群で1.5%(2/137例)、1mg投与群で2.9%(4/139例)、プラセボ群で2.2%(3/138例)に認められた26)。フィナステリド錠投与群(0.2mg及び1mg)に認められた主な症状はリビドー減退1.1%(3/276例)、勃起機能不全0.7%(2/276例)であった27)。
図1 国内第II/III相二重盲検比較試験で対象となった頭頂部脱毛タイプ(Modified Norwood-Hamilton分類IIvertex、IIIvertex、IV及びV)
図2 頭頂部写真評価の推移(平均値±標準誤差)
17.1.2 国内長期投与試験
国内第II/III相二重盲検比較試験(48週間)終了後に、移行可能であった374例全例にフィナステリド錠1mgを投与する長期投与試験(48週間、通算96週)において有効性(頭頂部写真評価)は維持することが示された。
国内長期投与試験期間中における副作用(臨床検査値異常変動を含む)の発現割合は1.1%(4/374例)であり、前相を含め96週間にわたり1mgが投与された症例の長期投与試験期間中における副作用の発現割合は1.6%(2/124例)であった28)。
国内長期投与試験期間中における副作用(臨床検査値異常変動を含む)の発現割合は1.1%(4/374例)であり、前相を含め96週間にわたり1mgが投与された症例の長期投与試験期間中における副作用の発現割合は1.6%(2/124例)であった28)。
18. 薬効薬理
18.1 作用機序
フィナステリドは、5α-還元酵素II型を選択的に抑制することによりテストステロンからジヒドロテストステロンへの変換を阻害し、発毛作用を示すものと考えられる29)。
18.2 5α-還元酵素阻害作用
フィナステリドは、in vitroにおいてヒト遺伝子組換え5α-還元酵素II型を阻害し、緩徐に酵素との安定な複合体を形成する30)。
18.3 発毛作用
フィナステリドは、男性型脱毛症モデル動物であるベニガオザルにおいて、ジヒドロテストステロンの低下を伴った発毛作用を示した31)。
18.4 ステロイドホルモン受容体に対する作用
フィナステリドは、in vitroにおいて、ハムスター又はラット由来のステロイドホルモン受容体に対する親和性を示さず、ヒト又はラット由来の5α-還元酵素以外のステロイドホルモン生合成酵素に対する阻害作用も極めて弱かった32)。
18.5 ホルモン様作用
フィナステリドは、マウス、ラット又はウサギにおいて、エストロゲン様作用、抗エストロゲン作用、ゴナドトロピン分泌抑制作用、アンドロゲン様作用、プロゲスチン様作用及び抗プロゲスチン作用を示さなかった33)。
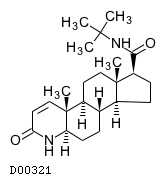
19. 有効成分に関する理化学的知見
19.1. フィナステリド
22. 包装
<フィナステリド錠0.2mg「クラシエ」>
28錠[14錠(PTP)×2]
<フィナステリド錠1mg「クラシエ」>
28錠[14錠(PTP)×2]
140錠[14錠(PTP)×10]
23. 主要文献
- Price VH,et al., J Am Acad Dermatol., 43, 768-776, (2000) »PubMed
- Guess HA,et al., J Urol., 155, 3-9, (1996) »PubMed
- McConnell JD,et al., N Engl J Med., 349, 2387-2398, (2003) »PubMed
- McConnell JD,et al., N Engl J Med., 338, 557-563, (1998) »PubMed
- Thompson IM,et al., N Engl J Med., 349, 215-224, (2003) »PubMed
- Theoret MR,et al., N Engl J Med., 365, 97-99, (2011) »PubMed
- Prahalada S,et al., Teratology., 55, 119-131, (1997) »PubMed
- フィナステリド単回投与における血中濃度(プロペシア錠:2005年10月11日承認、申請資料概要ヘ3.(5).1))
- フィナステリド反復投与における血中濃度(プロペシア錠:2005年10月11日承認、申請資料概要ヘ3.(5).1))
- 社内資料:生物学的同等性に関する資料
- フィナステリドの食事の影響(プロペシア錠:2005年10月11日承認、申請資料概要ヘ3.(5).2))
- Steiner JF., Clin Pharmacokinet., 30, 16-27, (1996) »PubMed
- フィナステリドの血漿蛋白結合(プロペシア錠:2005年10月11日承認、申請資料概要ヘ2.(2).4))
- フィナステリドの精液移行(プロペシア錠:2005年10月11日承認、申請資料概要ヘ3.(3).3))
- Huskey SW,et al., Drug Metab Dispos., 23, 1126-1135, (1995) »PubMed
- フィナステリドの代謝(プロペシア錠:2005年10月11日承認、申請資料概要ヘ2.(3).5))
- フィナステリドの代謝(プロペシア錠:2005年10月11日承認、申請資料概要ヘ2.(3).6))
- Ohtawa M,et al., Eur J Drug Metab Pharmacokinet., 16, 15-21, (1991) »PubMed
- Carlin JR,et al., Drug Metab Dispos., 20, 148-155, (1992) »PubMed
- フィナステリドの腎機能障害患者における体内動態(プロペシア錠:2005年10月11日承認、申請資料概要ヘ3.(3).1))
- 石井康行 他, 薬物動態, 10, 197-204, (1995) »DOI
- Yasumori T,et al., Eur J Clin Pharmacol., 62, 939-946, (2006) »PubMed
- フィナステリドと他剤との相互作用(プロペシア錠:2005年10月11日承認、申請資料概要ヘ3.(3).2))
- Norwood OT., South Med J., 68, 1359-1365, (1975) »PubMed
- Takashima I,et al., Hair Research Status and Future Aspects,edited by Orfanos,C.E.et al., 287-293, (1981)
- Kawashima M,et al., Eur J Dermatol., 14, 247-254, (2004) »PubMed
- 第II/III相二重盲検比較試験(プロペシア錠:2005年10月11日承認、申請資料概要ト1.(2))
- 国内長期投与試験(プロペシア錠:2005年10月11日承認、審査報告書)
- 効力を裏付ける試験(プロペシア錠:2005年10月11日承認、申請資料概要ホ.1)
- Herbert GB,et al., J Am Chem Soc., 118, 2359-2365, (1996)
- Rhodes L,et al., J Clin Endocrinol Metab., 79, 991-996, (1994) »PubMed
- フィナステリドのステロイドホルモン受容体に対する親和性(プロペシア錠:2005年10月11日承認、申請資料概要ホ1.(1).3))
- フィナステリドのホルモン様作用(プロペシア錠:2005年10月11日承認、申請資料概要ホ1.(1).3))
24. 文献請求先及び問い合わせ先
文献請求先
クラシエ薬品株式会社
医薬学術統括部
〒108-8080
東京都港区海岸3-20-20
電話:03-5446-3352
FAX:03-5446-3371
文献請求先
製品情報問い合わせ先
クラシエ薬品株式会社
お客様相談センター <受付時間>10:00〜17:00(土、日、祝日、弊社休業日を除く)
〒108-8080
東京都港区海岸3-20-20
電話:03-5446-3334
FAX:03-5446-3374
製品情報お問合せ先
25. 保険給付上の注意
本剤は保険給付の対象とならない(薬価基準未収載)。
26. 製造販売業者等
26.1 製造販売元
大興製薬株式会社
〒350-1155
埼玉県川越市下赤坂560番地1
26.2 発売元
クラシエ薬品株式会社
〒108-8080
東京都港区海岸3-20-20