医薬品情報
| 総称名 | ボノピオン |
|---|---|
| 一般名 | ボノプラザンフマル酸塩 アモキシシリン水和物 メトロニダゾール |
| 欧文一般名 | Vonoprazan Fumarate Amoxicillin Hydrate Metronidazole |
| 製剤名 | ボノプラザンフマル酸塩錠、日本薬局方アモキシシリンカプセル、日本薬局方メトロニダゾール錠 |
| 薬効分類番号 | 6199 |
| ATCコード | A02BD15 |
| KEGG DRUG |
D10774
ボノプラザン・アモキシシリン・メトロニダゾール
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年11月 改訂(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ボノピオンパック | VONOPION Pack | 武田薬品工業 | 6199105X1028 | 430.6円/シート | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
5.1 進行期胃MALTリンパ腫に対するヘリコバクター・ピロリ除菌治療の有効性は確立していない。
5.2 免疫性血小板減少症に対しては、ガイドライン等を参照し、ヘリコバクター・ピロリ除菌治療が適切と判断される症例にのみ除菌治療を行うこと。
5.3 早期胃癌に対する内視鏡的治療後胃以外には、ヘリコバクター・ピロリ除菌治療による胃癌の発症抑制に対する有効性は確立していない。
5.4 ヘリコバクター・ピロリ感染胃炎に用いる際には、ヘリコバクター・ピロリが陽性であること及び内視鏡検査によりヘリコバクター・ピロリ感染胃炎であることを確認すること。
6. 用法及び用量
プロトンポンプインヒビター、アモキシシリン水和物及びクラリスロマイシンの3剤投与によるヘリコバクター・ピロリの除菌治療が不成功の場合
通常、成人にはボノプラザンとして1回20mg、アモキシシリン水和物として1回750mg(力価)及びメトロニダゾールとして1回250mgの3剤を同時に1日2回、7日間経口投与する。
8. 重要な基本的注意
8.1 本製品に包装されている個々の製剤を単独、もしくは本製品の効能又は効果以外の目的に使用しないこと。また、用法及び用量のとおり、同時に服用すること。
<アモキシシリン水和物>
8.2 ショック、アナフィラキシー、アレルギー反応に伴う急性冠症候群、薬剤により誘発される胃腸炎症候群の発生を確実に予知できる方法はないが、事前に当該事象の既往歴等について十分な問診を行うこと。なお、抗生物質によるアレルギー歴は必ず確認すること。[9.1.1、11.1.5-11.1.7参照]
8.3 急性腎障害等の重篤な腎障害があらわれることがあるので、定期的に検査を行うなど、観察を十分に行うこと。[11.1.9参照]
8.4 顆粒球減少、血小板減少があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。[11.1.10参照]
<メトロニダゾール>
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
<アモキシシリン水和物>
9.1.1 ペニシリン系又はセフェム系抗生物質に対し過敏症の既往歴のある患者(ただし、アモキシシリン水和物に対し過敏症の既往歴のある患者には投与しないこと)[8.2参照]
9.1.2 本人又は両親、兄弟に気管支喘息、発疹、じん麻疹等のアレルギー症状を起こしやすい体質を有する患者
9.1.3 経口摂取の不良な患者又は非経口栄養の患者、全身状態の悪い患者
観察を十分に行うこと。ビタミンK欠乏症状があらわれることがある。
<メトロニダゾール>
9.2 腎機能障害患者
ボノプラザンの排泄が遅延することにより血中濃度が上昇することがある。[16.6.1参照]
9.2.1 高度の腎機能障害患者
投与しないこと。アモキシシリン水和物の血中濃度が上昇することがあり、本製品では各製剤の投与量を調節できない。[2.4参照]
9.2.2 血液透析患者
メトロニダゾールの注射剤において、メトロニダゾール500mgの単回点滴静注直後の血液透析により、投与量の約45%が除去されたとの報告がある1)。
9.3 肝機能障害患者
ボノプラザンの代謝、排泄が遅延することにより血中濃度が上昇することがある。また、メトロニダゾールの血中濃度が上昇し、作用が増強するおそれがある。[16.6.2参照]
9.5 妊婦
9.5.1 妊娠3ヵ月以内の女性
9.5.2 妊娠3ヵ月を過ぎた女性
治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[16.3.1参照]
<ボノプラザンフマル酸塩>
9.5.3 動物試験(ラット)において、40mg/日でのヒトにおけるボノプラザンの曝露量(AUC)の約28倍を超える曝露量で、胎児体重及び胎盤重量の低値、外表異常(肛門狭窄及び尾の異常)、並びに内臓異常(膜性部心室中隔欠損及び鎖骨下動脈起始異常)が認められている。
9.6 授乳婦
授乳しないことが望ましい。
<ボノプラザンフマル酸塩>
9.6.1 健康授乳婦にボノプラザン20mgを1日1回又は1日2回4日間経口投与したとき、それぞれ投与量の0.012%又は0.023%が母乳中に移行した2)。
<アモキシシリン水和物>
9.6.2 外国人データで母乳中へ移行することが報告されている3)。
<メトロニダゾール>
9.6.3 母乳中へ移行することが報告されている。[16.3.2参照]
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に肝機能、腎機能等の生理機能が低下している。アモキシシリン水和物による副作用が発現しやすい。また、アモキシシリン水和物によるビタミンK欠乏による出血傾向があらわれることがある。
10. 相互作用
相互作用序文
<ボノプラザンフマル酸塩>
主として肝薬物代謝酵素CYP3A4で代謝され、一部CYP2B6、CYP2C19及びCYP2D6で代謝される。また、ボノプラザンは弱いCYP3A4阻害作用を有する。
ボノプラザンの胃酸分泌抑制作用により、併用薬剤の吸収を促進又は抑制する可能性がある。
ボノプラザンの胃酸分泌抑制作用により、併用薬剤の吸収を促進又は抑制する可能性がある。
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2B6
薬物代謝酵素用語
CYP2C19
薬物代謝酵素用語
CYP2D6
10.1 併用禁忌
10.2 併用注意
| CYP3A4阻害剤 クラリスロマイシン等 | ボノプラザンの血中濃度が上昇する可能性がある。 | クラリスロマイシンとの併用によりボノプラザンの血中濃度が上昇したとの報告がある。 |
| ジゴキシン メチルジゴキシン | 左記薬剤の作用を増強する可能性がある。 | ボノプラザンの胃酸分泌抑制作用によりジゴキシンの加水分解が抑制され、ジゴキシンの血中濃度が上昇する可能性がある。 |
| イトラコナゾール チロシンキナーゼ阻害剤 ゲフィチニブ ニロチニブ エルロチニブ ネルフィナビルメシル酸塩 | 左記薬剤の作用を減弱する可能性がある。 | ボノプラザンの胃酸分泌抑制作用により左記薬剤の血中濃度が低下する可能性がある。 |
| CYP3A4で代謝される薬剤 ミダゾラム等 [16.7.1参照] | 左記薬剤の作用を増強する可能性がある。 | ボノプラザンのCYP3A4に対する弱い阻害作用により、左記薬剤の代謝が阻害される。 |
| 強い又は中程度のCYP3A4誘導剤 リファンピシン エファビレンツ等 [16.7.2参照] | ボノプラザンの血中濃度が低下する可能性がある。 | 左記薬剤のCYP3A4に対する誘導作用により、ボノプラザンの代謝が促進される可能性がある。 |
| ワルファリンカリウム | ワルファリンカリウムの作用が増強されるおそれがある。 | 腸内細菌によるビタミンKの産生を抑制することがある。 |
| 経口避妊薬 | 経口避妊薬の効果が減弱するおそれがある。 | 腸内細菌叢を変化させ、経口避妊薬の腸肝循環による再吸収を抑制すると考えられている。 |
| プロベネシド | アモキシシリン水和物の血中濃度を増加させる。 | アモキシシリン水和物の尿細管分泌を阻害し、尿中排泄を低下させると考えられている。 |
| メトトレキサート | メトトレキサートの副作用を増強させるおそれがある。 | メトトレキサートの尿細管分泌を阻害し、尿中排泄を低下させると考えられている。 |
| アルコール | 腹部の疝痛、嘔吐、潮紅があらわれることがあるので、投与期間中は飲酒を避けること。 | メトロニダゾールはアルコールの代謝過程においてアルデヒド脱水素酵素を阻害し、血中アセトアルデヒド濃度を上昇させる。 |
| リトナビル含有製剤(内用液) | ジスルフィラム−アルコール反応を起こすおそれがある。 | リトナビル含有製剤(内用液)はエタノールを含有するのでメトロニダゾールにより血中アセトアルデヒド濃度を上昇させる。 |
| ジスルフィラム | 精神症状(錯乱等)が出現することがある。 | 機序は不明である。 |
| ワルファリン | ワルファリンの抗凝血作用を増強し、出血等があらわれることがある。 | メトロニダゾールはワルファリンの代謝を阻害し、その血中濃度を上昇させる。 |
| リチウム | リチウムの血中濃度が上昇し、リチウム中毒があらわれることがある。 | 機序は不明である。 |
| ブスルファン | ブスルファンの作用が増強されることがある。 | メトロニダゾールはブスルファンの血中濃度を上昇させることがある。 |
| 5-フルオロウラシル | 5-フルオロウラシルの作用が増強される可能性がある。 | メトロニダゾールは5-フルオロウラシルの血中濃度を上昇させることがある。 |
| シクロスポリン | シクロスポリンの作用が増強される可能性がある。 | メトロニダゾールはシクロスポリンの血中濃度を上昇させることがある。 |
| フェノバルビタール | メトロニダゾールの作用が減弱する可能性がある。 | フェノバルビタールはメトロニダゾールの代謝酵素を誘導し、その血中濃度を低下させることがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
<ボノプラザンフマル酸塩>
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
11.1.2 汎血球減少、無顆粒球症、白血球減少、血小板減少(いずれも頻度不明)
11.1.3 肝機能障害(頻度不明)
11.1.4 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、多形紅斑(いずれも頻度不明)
<アモキシシリン水和物>
11.1.5 ショック、アナフィラキシー(いずれも0.1%未満注1))
不快感、口内異常感、眩暈、便意、耳鳴、発汗、喘鳴、呼吸困難、血管浮腫、全身の潮紅・じん麻疹等の異常が認められた場合には投与を中止し、適切な処置を行うこと。[8.2参照]
11.1.6 アレルギー反応に伴う急性冠症候群(頻度不明)[8.2参照]
11.1.7 薬剤により誘発される胃腸炎症候群(頻度不明)
投与から数時間以内の反復性嘔吐を主症状とし、下痢、嗜眠、顔面蒼白、低血圧、腹痛、好中球増加等を伴う、食物蛋白誘発性胃腸炎に類似したアレルギー性の胃腸炎(Drug-induced enterocolitis syndrome)があらわれることがある。主に小児で報告されている。[8.2参照]
11.1.8 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも0.1%未満注1))、多形紅斑、急性汎発性発疹性膿疱症、紅皮症(剥脱性皮膚炎)(いずれも頻度不明)
発熱、頭痛、関節痛、皮膚や粘膜の紅斑・水疱、膿疱、皮膚の緊張感・灼熱感・疼痛等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.9 急性腎障害等の重篤な腎障害(0.1%未満注1))[8.3参照]
11.1.10 顆粒球減少(0.1%未満注1))、血小板減少(頻度不明)[8.4参照]
11.1.11 偽膜性大腸炎等の血便を伴う重篤な大腸炎(0.1%未満注1))
腹痛、頻回の下痢があらわれた場合には直ちに投与を中止するなど適切な処置を行うこと。
11.1.12 肝機能障害、黄疸(いずれも0.1%未満注1))
AST、ALTの上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.1.13 間質性肺炎、好酸球性肺炎(いずれも頻度不明)
咳嗽、呼吸困難、発熱等が認められた場合には、速やかに胸部X線、胸部CT等の検査を実施すること。間質性肺炎、好酸球性肺炎が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.14 無菌性髄膜炎(頻度不明)
項部硬直、発熱、頭痛、悪心・嘔吐あるいは意識混濁等を伴う無菌性髄膜炎があらわれることがある。
注1)発現頻度はアモキシシリン水和物の承認時までの臨床試験又は製造販売後調査の結果に基づく。
<メトロニダゾール>
11.1.15 末梢神経障害(頻度不明)
四肢のしびれ、異常感等が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.16 中枢神経障害(頻度不明)
11.1.17 無菌性髄膜炎(頻度不明)
項部硬直、発熱、頭痛、悪心・嘔吐あるいは意識混濁等を伴う無菌性髄膜炎があらわれることがある。
11.1.18 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
11.1.19 急性膵炎(頻度不明)
腹痛、背部痛、悪心・嘔吐、血清アミラーゼ値の上昇等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.21 出血性大腸炎(頻度不明)
腹痛、血便、頻回の下痢があらわれた場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.23 QT延長、心室頻拍(Torsade de pointesを含む)(いずれも頻度不明)
11.2 その他の副作用
| 0.1〜5%未満 | |
| 消化器 | 下痢、腹部不快感、腹部膨満感 |
| 肝臓 | AST、ALTの上昇 |
| 0.1〜5%未満 | |
| 消化器 | 便秘、下痢、腹部膨満感、悪心 |
| 過敏症 | 発疹 |
| 肝臓 | AST、ALT、AL-P、LDH、γ-GTPの上昇 |
| その他 | 浮腫、好酸球増多 |
| 0.1〜5%未満注2) | 0.1%未満注2) | 頻度不明注2) | |
| 過敏症 | 発熱、発疹、じん麻疹 | そう痒 | |
| 血液 | 好酸球増多、貧血 | ||
| 肝臓 | AST、ALTの上昇 | ||
| 消化器 | 下痢、悪心、食欲不振 | 黒毛舌 | |
| 皮膚 | 線状IgA水疱症 | ||
| 菌交代症 | 口内炎、大腸炎(カンジダ、非感受性のクレブシエラ等による) | ||
| ビタミン欠乏症 | ビタミンK欠乏症状(低プロトロンビン血症、出血傾向等)、ビタミンB群欠乏症状(舌炎、口内炎、食欲不振、神経炎等) | ||
| その他 | 梅毒患者の場合:ヤーリッシュ・ヘルクスハイマー反応(発熱、全身倦怠感、頭痛等の発現、病変部の悪化) |
| 頻度不明 | |
| 過敏症 | 発疹 |
| 消化器 | 舌苔、食欲不振、悪心、胃不快感、下痢、腹痛、味覚異常 |
| 肝臓 | AST上昇、ALT上昇、総ビリルビン上昇、AL-P上昇、LDH上昇、γ-GTP上昇 |
| 生殖器 | Candida albicansの出現 |
| その他 | 暗赤色尿、発熱 |
| 頻度不明 | |
| 過敏症 | 発疹、そう痒感 |
| 血液 | 好塩基球増多 |
| 消化器 | 下痢、胸やけ、悪心、上腹部痛、味覚異常、口腔アフタ、舌炎、鼓腸、黒色便 |
| 精神神経系 | うつ病、頭痛、浮動性めまい、不安定感 |
| その他 | 眼精疲労、疲労、しびれ感 |
12. 臨床検査結果に及ぼす影響
12.1 ヘリコバクター・ピロリの除菌判定上の注意
アモキシシリン水和物及びメトロニダゾールの服用中や投与終了直後では、13C-尿素呼気試験の判定結果が偽陰性になる可能性があるため、13C-尿素呼気試験による除菌判定を行う場合には、これらの薬剤の投与終了後4週以降の時点で実施することが望ましい。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
<ボノプラザンフマル酸塩>
15.1.1 ボノプラザンの投与が胃癌による症状を隠蔽することがあるので、悪性でないことを確認のうえ投与すること。
15.1.2 海外における複数の観察研究で、プロトンポンプインヒビターによる治療において骨粗鬆症に伴う股関節骨折、手関節骨折、脊椎骨折のリスク増加が報告されている。特に、高用量及び長期間(1年以上)の治療を受けた患者で、骨折のリスクが増加した。
15.1.3 海外における主に入院患者を対象とした複数の観察研究で、プロトンポンプインヒビターを投与した患者においてクロストリジウム・ディフィシルによる胃腸感染のリスク増加が報告されている。
15.2 非臨床試験に基づく情報
<ボノプラザンフマル酸塩>
15.2.1 マウス及びラット2年間経口投与がん原性試験において、20mg/日でのヒトにおけるボノプラザンの曝露量(AUC)と等倍程度の曝露量で胃の神経内分泌腫瘍が、約300倍で胃の腺腫(マウス)が、また、約13倍以上(マウス)及び約58倍以上(ラット)で肝臓腫瘍が認められている。
<アモキシシリン水和物>
15.2.2 ラットにアモキシシリン水和物(2,000mg/kg/日)、ランソプラゾール(15mg/kg/日以上)を4週間併用経口投与した試験で、アモキシシリン水和物を単独あるいは併用投与した動物に結晶尿が認められているが、結晶はアモキシシリン水和物が排尿後に析出したものであり、体内で析出したものではないことが確認されている。
<メトロニダゾール>
16. 薬物動態
16.1 血中濃度
16.1.1 ボノプラザン、アモキシシリン水和物及びメトロニダゾール併用時
健康成人男子を対象にボノプラザン20mg、アモキシシリン水和物750mg(力価)及びメトロニダゾール250mgを1日2回朝食後及び夕食後に7日間投与(投与最終日は朝食後1回)した時、投与7日目の薬物動態学的パラメータは下表のとおりである7)。
| Cmax(ng/mL) | Tmax(h) | AUC0-12(ng・h/mL) | T1/2(h) |
| 34.9±13.9 | 3.0(1.0,4.0) | 250.1±83.0 | 7.3±0.9 |
| Cmax(μg/mL) | Tmax(h) | AUC0-12(μg・h/mL) | T1/2(h) |
| 10.4±2.4 | 3.0(3.0,6.0) | 40.8±6.8 | 1.3±0.2 |
| Cmax(μg/mL) | Tmax(h) | AUC0-12(μg・h/mL) | T1/2(h) |
| 8.9±1.8 | 3.0(1.0,6.0) | 75.5±19.6 | 10.8±2.8 |
16.3 分布
16.3.1 メトロニダゾールの胎児への移行
16.3.2 メトロニダゾールの母乳中への移行
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
(1)ボノプラザン単独投与時
腎機能正常者(eGFR:90mL/min/1.73m2以上)、軽度(eGFR:60〜89mL/min/1.73m2)、中等度(eGFR:30〜59mL/min/1.73m2)及び高度腎機能障害者(eGFR:15〜29mL/min/1.73m2)、並びに末期腎不全(ESRD)(eGFR:15mL/min/1.73m2未満)患者を対象にボノプラザンの薬物動態に及ぼす腎機能障害の影響を検討した臨床試験において、ボノプラザンのAUC(0-inf)及びCmaxは、軽度、中等度及び高度腎機能障害者では腎機能正常者と比較してそれぞれ1.3〜2.4倍及び1.2〜1.8倍高く、腎機能の低下に伴い増加し、また、ESRD患者におけるAUC(0-inf)及びCmaxは、腎機能正常者と比較してそれぞれ1.3倍及び1.2倍高かった10)(外国人によるデータ)。[9.2参照]
16.6.2 肝機能障害患者
16.7 薬物相互作用
16.7.1 ボノプラザン、ミダゾラム併用時の薬物動態
16.7.2 生理学的薬物速度論モデルによるシミュレーション(リファンピシン、エファビレンツ)
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 胃潰瘍又は十二指腸潰瘍におけるヘリコバクター・ピロリ感染
(1)国内第III相試験(二重盲検比較試験)
ボノプラザン又はランソプラゾールと、アモキシシリン水和物及びクラリスロマイシンの3剤投与によるヘリコバクター・ピロリの除菌が不成功であった50例を対象とした臨床試験において、ボノプラザン20mg、アモキシシリン水和物及びメトロニダゾールの3剤を1日2回7日間経口投与した場合の除菌率は下表のとおりである14)。
| 各薬剤の1回投与量 | 除菌注1)率 |
| ボノプラザン20mg アモキシシリン水和物750mg(力価) メトロニダゾール250mg | 98.0%(49/50例) |
副作用発現頻度は、16.0%(8/50例)であった。主な副作用は、下痢、鼓腸、アラニンアミノトランスフェラーゼ増加及びアスパラギン酸アミノトランスフェラーゼ増加が各4.0%(2/50例)であった。
18. 薬効薬理
18.1 作用機序
アモキシシリン水和物は細菌の細胞壁合成を阻害することにより効果を発揮する15)。
ボノプラザンは酸による活性化を必要とせず、可逆的でカリウムイオンに競合的な様式でH+,K+-ATPaseを阻害する。ボノプラザンは塩基性が強く胃壁細胞の酸生成部位に長時間残存して胃酸生成を抑制する。ボノプラザンは抗ヘリコバクター・ピロリ活性及びヘリコバクター・ピロリウレアーゼ阻害活性は示さない16)。
メトロニダゾールはヘリコバクター・ピロリ菌体内のニトロ還元酵素系の反応によって還元を受け、ニトロソ化合物(R-NO)に変化する。このR-NOがヘリコバクター・ピロリに対する殺菌作用を示す。また、反応の途中で生成したヒドロキシラジカルがDNAを切断し、DNAらせん構造の不安定化を招く17)18)19)。
アモキシシリン水和物及びメトロニダゾールとの3剤療法におけるボノプラザンの役割は胃内pHを上昇させることにより、アモキシシリン水和物及びメトロニダゾールの抗菌活性を高めることにあると考えられる。
18.2 薬理作用
18.2.1 抗菌作用
アモキシシリン水和物はヘリコバクター・ピロリに対し殺菌的な抗菌作用を示す。
19. 有効成分に関する理化学的知見
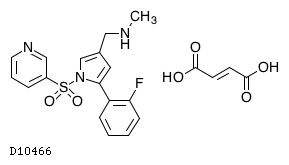
19.1. ボノプラザンフマル酸塩
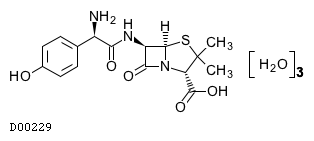
19.2. アモキシシリン水和物
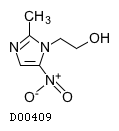
19.3. メトロニダゾール
20. 取扱い上の注意
アルミ袋を開封後も湿気を避けて保存すること。本品は高防湿性の内袋により品質保持をはかっている。
22. 包装
PTP入り 7シート(1シート×7、乾燥剤入り)
23. 主要文献
- Somogyi A,et al., Eur J Clin Pharmacol., 25, 683-687, (1983) »PubMed
- ボノプラザンの薬物動態試験成績[1](社内資料)
- Kafetzis D.K,et al., Acta Peadiatr Scand., 70, 285, (1981) »PubMed
- Rustia M,et al., J Natl Cancer Inst., 48, 721-729, (1972) »PubMed
- Roe FJC,et al., Surgery., 93, 158-164, (1983)
- Rustia M,et al., J Natl Cancer Inst., 63, 863-868, (1979) »PubMed
- ボノプラザンの薬物動態試験成績[13](タケキャブ錠2014年12月26日承認:CTD 2.7.6.12)
- Gray MS., J Obstet Gynaecol Br Commonw., 68, 723-729, (1961)
- Gray MS., Br J Vener Dis., 37, 278-279, (1961) »PubMed
- ボノプラザンの薬物動態試験成績[10](タケキャブ錠2014年12月26日承認:CTD 2.7.6.10)
- ボノプラザンの薬物動態試験成績[11](タケキャブ錠2014年12月26日承認:CTD 2.7.6.9)
- ボノプラザンの薬物動態試験成績[15](社内資料)
- ボノプラザンの薬物動態試験成績[16](社内資料)
- ボノプラザンの臨床試験成績[10](タケキャブ錠2014年12月26日承認:CTD 2.7.6.19)
- 上田泰,他編, 感染症学−基礎と臨床, 204, (1982), (メジカルビュー社)
- ボノプラザンの薬理試験成績(タケキャブ錠2014年12月26日承認:CTD 2.6.2.6)
- Osato MS., Curr Pharm Des., 6, 1545-1555, (2000) »PubMed
- 山本達男,他, 日本臨牀, 63 (S-11), 376-381, (2005)
- Upcroft P,et al., Clin Microbiol Rev., 14, 150-164, (2001) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
武田薬品工業株式会社
くすり相談室
〒103-8668
東京都中央区日本橋本町二丁目1番1号
電話:フリーダイヤル 0120-566-587 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
製品情報問い合わせ先
武田薬品工業株式会社
くすり相談室
〒103-8668
東京都中央区日本橋本町二丁目1番1号
電話:フリーダイヤル 0120-566-587 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
26. 製造販売業者等
26.1 製造販売元
武田薬品工業株式会社
〒540-8645
大阪市中央区道修町四丁目1番1号
26.2 提携
大塚製薬株式会社
〒101-8535
東京都千代田区神田司町2-9