医薬品情報
| 総称名 | セイブル |
|---|---|
| 一般名 | ミグリトール |
| 欧文一般名 | Miglitol |
| 製剤名 | ミグリトール口腔内崩壊錠 |
| 薬効分類名 | 糖尿病食後過血糖改善剤 |
| 薬効分類番号 | 3969 |
| ATCコード | A10BF02 |
| KEGG DRUG |
D00625
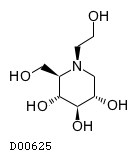
ミグリトール
|
| KEGG DGROUP |
DG01663
α-グルコシダーゼ阻害薬
DG02044
血糖降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2020年8月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| セイブルOD錠25mg | SEIBULE OD Tablets | 三和化学研究所 | 3969009F6025 | 11.2円/錠 | 処方箋医薬品注) |
| セイブルOD錠50mg | SEIBULE OD Tablets | 三和化学研究所 | 3969009F4022 | 19.5円/錠 | 処方箋医薬品注) |
| セイブルOD錠75mg | SEIBULE OD Tablets | 三和化学研究所 | 3969009F5029 | 25.9円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 重症ケトーシス、糖尿病性昏睡又は前昏睡の患者[輸液及びインスリンによる速やかな高血糖の是正が必須となるので本剤の投与は適さない。]
2.2 重症感染症、手術前後、重篤な外傷のある患者[インスリン注射による血糖管理が望まれるので本剤の投与は適さない。]
2.3 本剤の成分に対する過敏症の既往歴のある患者
2.4 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
糖尿病の食後過血糖の改善(ただし、食事療法・運動療法を行っている患者で十分な効果が得られない場合、又は食事療法・運動療法に加えてスルホニルウレア剤、ビグアナイド系薬剤若しくはインスリン製剤を使用している患者で十分な効果が得られない場合に限る)
5. 効能または効果に関連する注意
5.1 糖尿病治療の基本である食事療法・運動療法のみを行っている患者では、投与の際の食後血糖1又は2時間値は200mg/dL以上を示す場合に限る。
5.2 食事療法、運動療法に加えて経口血糖降下剤又はインスリン製剤を使用している患者では、投与の際の空腹時血糖値は140mg/dL以上を目安とする。
6. 用法及び用量
通常、成人にはミグリトールとして1回50mgを1日3回毎食直前に経口投与する。なお、効果不十分な場合には、経過を十分に観察しながら1回量を75mgまで増量することができる。
7. 用法及び用量に関連する注意
高齢者には低用量(例えば1回量25mg)から投与を開始するなど慎重に投与すること。[9.8参照]
8. 重要な基本的注意
8.1 本剤投与中は、血糖を定期的に検査するとともに、経過を十分に観察し、常に投与継続の必要性について注意を払うこと。本剤を2〜3カ月投与しても食後血糖に対する効果が不十分な場合(静脈血漿で食後血糖2時間値が200mg/dL以下にコントロールできないなど)には、より適切と考えられる治療への変更を考慮すること。なお、食後血糖の十分なコントロール(静脈血漿で食後血糖2時間値が160mg/dL以下)が得られ、食事療法・運動療法又はこれらに加えて経口血糖降下剤若しくはインスリンを使用するのみで十分と判断される場合には、本剤の投与を中止して経過観察を行うこと。
8.2 本剤の使用にあたっては、患者に対し低血糖症状及びその対処方法について十分説明すること。[11.1.1参照]
8.3 低血糖症状を起こすことがあるので、高所作業、自動車の運転等に従事している患者に投与するときには注意すること。[11.1.1参照]
8.4 本剤の投与により、「腹部膨満」、「鼓腸」、「下痢」等の消化器系副作用が発現することがある。これらの症状が発現するおそれがある場合には、少量から投与を開始し、症状を観察しながら増量することが望ましい。これらは、一般に時間の経過とともに消失することが多いが、症状に応じて減量あるいは消化管内ガス駆除剤の併用を考慮し、高度で耐えられない場合は投与を中止すること。[11.1.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 開腹手術の既往又は腸閉塞の既往のある患者
腸内ガス等の増加により腸閉塞が発現するおそれがある。[11.1.2参照]
9.1.2 消化・吸収障害を伴った慢性腸疾患の患者
本剤の作用により病態が悪化するおそれがある。
9.1.3 ロエムヘルド症候群、重度のヘルニア、大腸の狭窄・潰瘍等の患者
腸内ガス等の増加により症状が悪化するおそれがある。
9.2 腎機能障害患者
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
代謝状態が不安定であり、血糖管理状態が大きく変化するおそれがある。
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。乳中へ移行することが報告されている4)(外国人データ)。
9.7 小児等
国内で実施された小児を対象とした製造販売後臨床試験において、56例中、副作用が報告されたのは37例(66.1%)であった。主な副作用は低血糖18例(32.1%)、下痢14例(25.0%)、腹部膨満7例(12.5%)、腹痛7例(12.5%)であった。
9.8 高齢者
副作用の発現に留意し、経過を十分に観察しながら慎重に投与すること。一般に生理機能が低下している。[7.参照]
10. 相互作用
10.2 併用注意
| 糖尿病用薬 スルホニルウレア系薬剤 ビグアナイド系薬剤 インスリン製剤 チアゾリジン系薬剤 速効型インスリン分泌促進薬 DPP-4阻害剤 GLP-1受容体作動薬 SGLT2阻害剤 [11.1.1参照] | 低血糖症状を発現するおそれがあるので、低用量から投与を開始するなど慎重に投与すること。 | 左記糖尿病用薬の血糖降下作用に本剤の糖質吸収遅延作用が加わる。 |
| 糖尿病用薬及びその血糖降下作用を増強する薬剤を併用している場合 糖尿病用薬の血糖降下作用を増強する薬剤 β-遮断剤 サリチル酸剤 モノアミン酸化酵素阻害剤 フィブラート系の高脂血症治療剤 ワルファリン 等 | 左記の併用に加え更に本剤を併用する場合には、糖尿病用薬の使用上の注意に記載の相互作用に留意するとともに、本剤の糖質吸収遅延作用が加わることによる影響に十分注意すること。 | 左記薬剤により他の糖尿病用薬の血糖降下作用が増強されるところに、本剤の糖質吸収遅延作用が加わる。 |
| 糖尿病用薬及びその血糖降下作用を減弱する薬剤を併用している場合 糖尿病用薬の血糖降下作用を減弱する薬剤 アドレナリン 副腎皮質ホルモン 甲状腺ホルモン 等 | 左記の併用に加え更に本剤を併用する場合には、糖尿病用薬の使用上の注意に記載の相互作用に留意するとともに、本剤の糖質吸収遅延作用が加わることによる影響に十分注意すること。 | 左記薬剤により他の糖尿病用薬の血糖降下作用が減弱されるところに、本剤の糖質吸収遅延作用が加わる。 |
| プロプラノロール ラニチジン | これらの薬剤の生物学的利用率が低下することがある。 | 発現機序は不明である。 |
| ジゴキシン | ジゴキシンの血漿中濃度が低下することがある。ジゴキシンの血漿中濃度が低下した場合には、ジゴキシンの投与量を調節するなど適切な処置を行う。 | 発現機序は不明である。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 低血糖
11.1.2 腸閉塞
11.1.3 肝機能障害、黄疸
AST、ALTの上昇等を伴う肝機能障害(頻度不明)、黄疸(頻度不明)があらわれることがある。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 消化器 | 腹部膨満、鼓腸、下痢 | 便秘、腸雑音異常、腹痛、嘔気、嘔吐、食欲不振、口渇、消化不良、胃不快感、おくび、胃炎、排便障害、痔核 | 口内炎、味覚異常、腸管のう胞様気腫症 |
| 過敏症 | 発疹、紅斑、蕁麻疹、そう痒 | ||
| 肝臓 | ALT上昇、AST上昇、γ-GTP上昇、LDH上昇、Al-P上昇 | ||
| 精神神経系 | めまい、頭痛 | しびれ、眠気 | |
| 血液 | 白血球数減少 | ||
| 代謝 | 血中アミラーゼ増加、血中カリウム増加、血中尿酸増加 | ||
| その他 | 頻尿、咳嗽 | 倦怠感、浮腫 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は舌の上にのせて唾液を浸潤させると崩壊するため水なしで服用可能である。また、水で服用することもできる。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性(6例又は12例)に空腹時にミグリトール25、50、100mg注)を単回経口投与した時、血漿中ミグリトールの薬物動態学的パラメータは以下のとおりであり、用量とCmaxは比例関係を示さなかった5)6)。
| \ | Tmax(h) | Cmax(μg/mL) | T1/2(h) |
| 25mg(n=6) | 1.83±0.26 | 0.875±0.167 | 1.97±0.26 |
| 50mg(n=6) | 2.42±0.66 | 1.156±0.351 | 2.20±0.53 |
| \ | Tmax(h) | Cmax(μg/mL) | T1/2(h) |
| 50mg(n=12) | 2.58±0.67 | 1.313±0.424 | 1.97±0.34 |
| 100mg(n=12) | 2.58±0.51 | 1.960±0.464 | 2.03±0.26 |
また、健康成人男性(6例)に空腹時又は食直前にミグリトール100mg注)を単回経口投与した時、食直前投与の血漿中ミグリトールは空腹時投与と同じ半減期(約2時間)で消失したが、Cmax及びAUCは低下した7)。
16.1.2 反復投与
16.4 代謝
16.5 排泄
健康成人男性(6例又は12例)に空腹時にミグリトール25、50、100mg注)を単回経口投与した時、尿中排泄率は用量増加に伴い低下した5)6)。
| \ | 尿中排泄率(% of Dose) |
| 25mg(n=6) | 86.2±5.3 |
| 50mg(n=6) | 70.7±10.8 |
| \ | 尿中排泄率(% of Dose) |
| 50mg(n=12) | 76.8±22.7 |
| 100mg(n=12) | 51.6±9.6 |
また、健康成人男性(6例)に空腹時又は食直前にミグリトール100mg注)を単回経口投与した時、尿中排泄率は空腹時が約50%、食直前が約30%であった7)。
健康成人男性(12例)にミグリトール50又は100mg注)を1日3回8日間(8日目は朝1回)反復経口投与した時、ミグリトールの累積排泄率は3〜4日以降ほぼ一定であった8)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能障害患者にミグリトール25mg注)を1日3回7日間反復経口投与した時、腎機能低下に伴いT1/2が延長した。また、クレアチニンクリアランスが30mL/min未満の患者では反復投与によりCmaxが増加した1)(外国人データ)。[9.2.1参照]
| パラメータ | 投与日 | クレアチニンクリアランス(mL/min) | ||
| ≧60(n=7) | ≧30 to<60(n=6) | <30(n=6) | ||
| Cmax(μg/mL) | 1 | 1.02(1.19) | 1.18(1.28) | 1.33(1.38) |
| 7 | 1.25(1.26) | 1.37(1.32) | 3.05(1.32) | |
| T1/2(h) | 1 | 3.5(1.54) | 5.5(1.47) | 11.5(1.55) |
| 7 | 3.2(1.37) | 5.4(1.25) | 12.5(1.60) | |
また、血液透析患者(3例)にミグリトール50mgを1日3回7日間反復経口投与した時、投与2、5及び7日目の透析前後で血漿中濃度が7.37〜28.4μg/mLから1.62〜4.50μg/mLに低下した(除去率:平均80.0〜81.8%)13)(外国人データ)。
16.7 薬物相互作用
16.7.1 グリベンクラミド
健康成人男性(6例)に対し、グリベンクラミド5mg1日1回及びミグリトール100mg(漸増)注)あるいはプラセボ1日3回をクロスオーバー法にて7日間併用投与した時、グリベンクラミドのAUC0-9h及びCmaxがプラセボと比較して、それぞれ25及び17%低下した14)(外国人データ)。
また、2型糖尿病患者(26例)に対し、グリベンクラミド3.5mg1日1回及びミグリトール100mg注)あるいはプラセボ1日3回を7日間併用投与した時、プラセボと比較してグリベンクラミドのAUC0-12hが12%低下し、Cmaxが10%増加した15)(外国人データ)。
16.7.2 メトホルミン
健康成人男性(12例)に対し、ミグリトール100mg注)あるいはプラセボ1日3回をクロスオーバー法にて7日間反復投与時に、メトホルミン1000mgを単回投与した時、メトホルミンのAUC0-9h及びCmaxがプラセボと比較して、それぞれ12及び13%低下した16)(外国人データ)。
16.7.3 ジゴキシン
健康成人男性(12例)に対し、ジゴキシン0.3mg1日1回反復投与時の定常状態においてミグリトール50及び100mg注)を1日3回7日間併用投与した時、単独使用時と比較しジゴキシンのCminは19及び28%低下し、尿中排泄量は19及び33%低下した17)(外国人データ)。
また、2型糖尿病患者(27例)に対し、ジゴキシン0.2mg1日1回反復投与時に、ミグリトール100mg注)あるいはプラセボ1日3回を14日間併用投与した時、プラセボと比較してジゴキシンのCminに影響を及ぼさなかった18)(外国人データ)。
| 項目 | ジゴキシン単独投与(n=10) | ミグリトール50mg併用時(n=10) | ミグリトール100mg併用時(n=10) |
| Cmin(ng/mL) | 0.813(1.25) | 0.662(1.41) | 0.586(1.35) |
| 尿中排泄量(μg/24h) | 251.2(1.16) | 202.6(1.30) | 169.5(1.26) |
| 腎クリアランス(mL/min/kg) | 2.965(1.29) | 2.938(1.36) | 2.775(1.39) |
16.7.4 プロプラノロール
健康成人男性(10例)に対し、プロプラノロール40mg1日3回反復投与時にミグリトール50及び100mg注)を1日3回7日間投与した時、単独使用時と比較しプロプラノロールのAUCは50及び100mgでそれぞれ30及び40%低下した。血糖値、心電図及び心拍出量には併用による影響が認められなかった19)(外国人データ)。
16.7.5 ラニチジン
健康成人男性(12例)に対し、ラニチジン150mgを1日2回反復投与時にミグリトール100mg注)1日3回をクロスオーバー法にて7日間投与した時、単独使用時と比較しラニチジンのAUC及びCmaxがそれぞれ40及び47%に低下した。一方、ミグリトールのAUC及びCmaxには影響が認められなかった20)(外国人データ)。
16.7.6 ピオグリタゾン及びその他薬剤
健康成人男性(16例)に対し、ピオグリタゾン30mgを1日1回8日間反復投与した後、さらにミグリトール50mg1日3回を併用して5日間反復投与した時、ピオグリタゾン単独投与時に対する併用時のピオグリタゾン未変化体及び活性代謝物を含めた活性化合物合計のAUCの比はそれぞれ0.975、0.992、Cmaxの比はそれぞれ0.955、0.977であり、ピオグリタゾンのAUC及びCmaxに影響は認められなかった21)。
16.8 その他
16.8.1 生物学的同等性試験
(1)セイブルOD錠50mg
セイブルOD錠50mgを水なしまたは水と共に、セイブル錠50mgを水と共にそれぞれ1錠を20名の健康成人男性にクロスオーバー法により絶食単回経口投与し、75gスクロース負荷後3時間までの血糖値推移をコントロール期(無投与時)と比較した。得られたパラメータ(ΔAUC、ΔCmax)について統計解析を行った結果、両剤の生物学的同等性が確認された26)。
| \ | ΔAUC0-3h(mg・h/dL) | ΔCmax(mg/dL) |
| セイブルOD錠50mg(水なしで服用) | 71.60±31.87 | 73.9±13.2 |
| セイブル錠50mg(水と共に服用) | 73.06±31.64 | 73.8±14.8 |
| \ | ΔAUC0-3h(mg・h/dL) | ΔCmax(mg/dL) |
| セイブルOD錠50mg(水と共に服用) | 66.09±27.94 | 68.8±15.7 |
| セイブル錠50mg(水と共に服用) | 66.62±32.62 | 63.7±19.9 |
ΔAUC0-3h:投薬前後における血糖値推移−時間曲線下面積(75gスクロース負荷後3時間)
ΔCmax:投薬前後における最大血糖値差
・水なし投与試験
・水あり投与試験
また、水なし投与試験、水あり投与試験のいずれにおいても、試験製剤及び標準製剤投与後の製剤ごとの血漿中ミグリトール濃度から算出した薬物動態パラメータ(AUC0-24h、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された。
(2)セイブルOD錠25mg、セイブルOD錠75mg
セイブルOD錠25mg及びセイブルOD錠75mgは、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン(平成24年2月29日薬食審査発0229第10号に基づき、セイブルOD錠50mgを標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた26)。
注)本剤の承認された用法及び用量は、通常、ミグリトールとして1回50mgを1日3回毎食直前、最大投与量は1回75mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(単剤療法)
2型糖尿病患者における二重盲検比較対照試験(有効性解析対象:プラセボ84例、セイブル錠158例)において、プラセボのHbA1c(JDS値)、食後血糖1及び2時間値がそれぞれ0.25%、0.8mg/dL及び3.3mg/dL上昇したのに対して、セイブル錠50mg1日3回12週間投与によりそれぞれ0.35%、73.0mg/dL及び27.8mg/dL低下した27)28)。
副作用発現頻度は、58.0%(101/174例)であった。主な副作用は、腹部膨満23.6%(41/174例)、鼓腸23.0%(40/174例)、下痢16.7%(29/174例)、軟便6.3%(11/174例)、腸雑音異常4.6%(8/174例)であった。
17.1.2 国内第III相試験(併用療法)
(1)スルホニルウレア剤(SU剤)併用試験
SU剤で治療中の2型糖尿病患者を対象にセイブル錠50mg1日3回12週間投与したプラセボ対照単盲検比較試験(有効性解析対象:プラセボ77例、セイブル錠152例)において、最終評価時におけるHbA1c(JDS値)は、プラセボでは0.2%上昇、セイブル錠では0.28%低下した。投与12週間後の食後血糖1及び2時間値は、プラセボでは有意な変化はなく、本剤では76.8mg/dL及び32.6mg/dL低下した。その後52週にわたって継続投与した長期試験(非盲検試験)においても、セイブル錠の効果は持続し、安定した血糖コントロールが得られた29)30)。
副作用発現頻度は、60.5%(92/152例)であった。主な副作用は、腹部膨満27.6%(42/152例)、鼓腸27.0%(41/152例)、下痢15.1%(23/152例)、便秘5.3%(8/152例)、軟便4.6%(7/152例)であった。
(2)ビグアナイド剤(BG剤)併用試験
BG剤で治療中の2型糖尿病患者を対象にセイブル錠50mg1日3回16週間投与したプラセボ対照二重盲検比較試験(有効性解析対象:プラセボ49例、セイブル錠固定用量47例、セイブル錠漸増52例)において、最終評価時のHbA1c(JDS値)は、プラセボでは0.11%上昇、セイブル錠ではそれぞれ0.40%及び0.37%低下した。投与16週後の食後血糖1時間値はプラセボで0.4mg/dL低下、セイブル錠ではそれぞれ84.4mg/dL及び76.3mg/dL低下した。食後血糖2時間値はプラセボで3.3mg/dL低下、セイブル錠ではそれぞれ29.1mg/dL及び25.0mg/dL低下した31)。
副作用発現頻度は、固定用量群が70.2%(33/47例)、漸増群が63.5%(33/52例)であった。固定用量群及び漸増群の主な副作用は、下痢48.9%(23/47例)及び38.5%(20/52例)、鼓腸31.9%(15/47例)及び23.1%(12/52例)、腹部膨満23.4%(11/47例)及び3.8%(2/52例)であった。
また、BG剤で治療中の2型糖尿病患者を対象に本剤25mg1日3回で開始し、8週以降は本剤50mg1日3回に増量し、24週以降は効果不十分な場合は本剤75mg1日3回に増量した52週間の長期投与試験(非盲検試験、有効性解析対象:106例)において、セイブル錠の効果は持続し、安定した血糖コントロールが得られた32)。
副作用発現頻度は、61.3%(65/106例)であった。主な副作用は、鼓腸32.1%(34/106例)、下痢26.4%(28/106例)、腹部膨満15.1%(16/106例)であった。
(3)インスリン製剤併用試験(2型糖尿病)
インスリン製剤で治療中の2型糖尿病患者を対象にセイブル錠50mg1日3回12週間投与したプラセボ対照二重盲検比較試験(有効性解析対象:プラセボ100例、セイブル錠107例)において、プラセボのHbA1c(JDS値)、食後血糖1及び2時間値がそれぞれ0.03%、3.8mg/dL及び5.7mg/dL上昇したのに対して、セイブル錠50mg1日3回12週間投与によりそれぞれ0.36%、77.0mg/dL及び43.7mg/dL低下した33)34)。
副作用発現頻度は、67.3%(72/107例)であった。主な副作用は、低血糖35.5%(38/107例)、鼓腸20.6%(22/107例)、腹部膨満14.0%(15/107例)、下痢11.2%(12/107例)であった。
(4)インスリン製剤併用試験(1型糖尿病)
18. 薬効薬理
18.1 作用機序
ミグリトールは、小腸粘膜上皮細胞の刷子縁膜において二糖類から単糖への分解を担う二糖類水解酵素(α-グルコシダーゼ)を阻害し、糖質の消化・吸収を遅延させることにより食後の過血糖を改善する。
18.2 二糖類水解酵素に対する阻害作用
18.2.1 ラット小腸由来スクラーゼとイソマルターゼに対してアカルボースよりそれぞれ約6倍及び120倍強く、同様にボグリボースに対し1/3.6倍及び同程度の強い阻害作用を示した37)(in vitro)。一方、ラット膵α-アミラーゼに対する阻害作用は認められず、ラクターゼ及びトレハラーゼ活性を阻害することが報告されている38)(in vitro)。
18.2.2 ラット小腸由来スクラーゼ、イソマルターゼ、マルターゼに対する阻害様式は競合型である37)(in vitro)。
18.3 血糖上昇抑制作用
18.3.1 正常ラットに経口投与した結果、スクロース、煮沸でんぷん及び生でんぷん負荷後の血糖上昇を抑制するが、グルコース負荷後の血糖上昇に対しては無効であった39)。
18.3.2 健康成人男性(6例)にミグリトール50mgを1日3回、毎食直前に8日間(8日目は朝食時1回投与のみ)経口投与したところ、毎食後の血糖上昇を抑制し、血清インスリンの上昇を抑制した8)。
18.3.3 非肥満2型糖尿病モデルのGKラットに糖質(スクロース)負荷試験を実施した結果、ミグリトールは正常ラットと同様な糖質負荷後の血糖上昇抑制作用を示した40)。
18.3.4 GKラットにミグリトールを8週間混餌投与した結果、食後血糖上昇抑制作用が継続し、HbA1cの改善が認められた40)。
18.3.5 成人2型糖尿病患者(40例)にクロスオーバー法にてプラセボ及びミグリトールを1回50mg投与し食事負荷をしたところ、食後早期(30分〜1時間)の血糖上昇を抑制するとともに、インスリン分泌を抑制した41)。
19. 有効成分に関する理化学的知見
19.1. ミグリトール
20. 取扱い上の注意
開封後も湿気を避けて保存すること。本剤はアルミ袋により品質保持をはかっている。
22. 包装
<セイブルOD錠25mg>
100錠(PTP10錠×10、乾燥剤入り)、500錠(PTP10錠×50、乾燥剤入り)
<セイブルOD錠50mg>
100錠(PTP10錠×10、乾燥剤入り)、210錠(PTP21錠×10、乾燥剤入り)、
500錠(PTP10錠×50、乾燥剤入り)、1050錠(PTP21錠×50、乾燥剤入り)
<セイブルOD錠75mg>
100錠(PTP10錠×10、乾燥剤入り)、210錠(PTP21錠×10、乾燥剤入り)、
500錠(PTP10錠×50、乾燥剤入り)、1050錠(PTP21錠×50、乾燥剤入り)
23. 主要文献
- 社内資料:保存期の腎機能低下患者における薬物動態(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(17))
- 社内資料:生殖発生毒性試験(ウサギ)(セイブル錠 承認年月日:2005年10月11日、CTD 2.6.6.6)
- 社内資料:生殖発生毒性試験(ラット)(セイブル錠 承認年月日:2005年10月11日、CTD 2.6.6.6)
- 社内資料:産褥期健康成人女性における薬物動態及び乳汁移行(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(12))
- 社内資料:健康成人における薬物動態の用量反応I(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(5))
- 社内資料:健康成人における薬物動態の用量反応II(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(6))
- 社内資料:健康成人における生物学的利用能に及ぼす食事の影響(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 I(1))
- 社内資料:健康成人における反復投与時の薬物動態(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(7))
- 社内資料:2型糖尿病における薬物動態(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(13))
- Ahr HJ,et al., Arzneim-Forsch., 47, 734-745, (1997) »PubMed
- 社内資料:肝薬物代謝酵素系に対する阻害作用(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(4))
- 社内資料:ラット肝薬物代謝酵素に対する影響−7日間経口投与試験−(セイブル錠 承認年月日:2005年10月11日、CTD 2.6.4.5)
- 社内資料:透析患者における薬物動態(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(16))
- 社内資料:グリベンクラミドとの薬物相互作用I(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(18))
- 社内資料:グリベンクラミドとの薬物相互作用II(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(19))
- 社内資料:メトホルミンとの薬物相互作用(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(20))
- Weber H,et al., Eur J Clin Pharmacol., 36 (Suppl.), 11, (1989)
- 社内資料:ジゴキシンとの薬物相互作用(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(22))
- 社内資料:プロプラノロールとの薬物相互作用(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(23))
- 社内資料:ラニチジンとの薬物相互作用(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(27))
- 社内資料:ピオグリタゾンとの薬物相互作用
- 社内資料:ニフェジピンとの薬物相互作用(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(24))
- Schall R,et al., Arzneim-Forsch., 46, 41-46, (1996) »PubMed
- Richardt D,et al., Clin Drug Invest., 13, 171-174, (1997)
- 社内資料:マーロックスとの薬物相互作用(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 II(28))
- 社内資料:生物学的同等性試験
- Kawamori R,et al., Diabetes Metab., 29, 4S263, (2003)
- 社内資料:食事・運動療法への追加療法(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 III(3))
- 田嶼尚子 他, 薬理と治療, 34, 79-90, (2006)
- 社内資料:スルホニルウレア剤併用試験(セイブル錠 承認年月日:2005年10月11日、CTD 2.7.6 III(5))
- 社内資料:ビグアナイド剤併用試験
- 社内資料:ビグアナイド剤併用長期試験
- Nemoto M,et al., Acta Diabetol., 48, 15-20, (2011) »PubMed
- 社内資料:インスリン併用試験<2型糖尿病>
- Kubo S,et al., J Diabetes Invest., 1, 60-65, (2010)
- 社内資料:インスリン併用試験<1型糖尿病>
- 社内資料:二糖類水解酵素に対する阻害作用(セイブル錠 承認年月日:2005年10月11日、CTD 2.6.2.2)
- Samulitis BK,et al., Drugs Exp Clin Res., 13, 517-524, (1987) »PubMed
- 塚本 桂 他, 薬理と治療, 29, 623-633, (2001)
- Goda T,et al., Br J Nutr., 98, 702-710, (2007) »PubMed
- Osonoi T,et al., Diabetes Metab., 29, 4S263-4S264, (2003)
24. 文献請求先及び問い合わせ先
文献請求先
株式会社三和化学研究所
コンタクトセンター
〒461-8631
名古屋市東区東外堀町35番地
電話:0120-19-8130
FAX:052-950-1305
製品情報問い合わせ先
株式会社三和化学研究所
コンタクトセンター
〒461-8631
名古屋市東区東外堀町35番地
電話:0120-19-8130
FAX:052-950-1305
26. 製造販売業者等
26.1 製造販売元
株式会社三和化学研究所
〒461-8631
名古屋市東区東外堀町35番地