医薬品情報
| 総称名 | ドプス |
|---|---|
| 一般名 | ドロキシドパ |
| 欧文一般名 | Droxidopa |
| 製剤名 | ドロキシドパ口腔内崩壊錠・ドロキシドパ細粒 |
| 薬効分類名 | ノルアドレナリン作動性神経機能改善剤 |
| 薬効分類番号 | 1169 |
| KEGG DRUG |
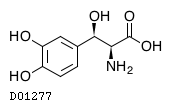
D01277
ドロキシドパ
|
| KEGG DGROUP |
DG01967
抗パーキンソン病薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年8月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ドプスOD錠100mg | DOPS OD Tablets | 住友ファーマ | 1169006F1027 | 32.7円/錠 | 処方箋医薬品注) |
| ドプスOD錠200mg | DOPS OD Tablets | 住友ファーマ | 1169006F2023 | 61.9円/錠 | 処方箋医薬品注) |
| ドプス細粒20% | DOPS Fine Granules | 住友ファーマ | 1169006C1039 | 72.8円/g | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
○パーキンソン病(Yahr重症度ステージIII)におけるすくみ足、たちくらみの改善
○下記疾患における起立性低血圧、失神、たちくらみの改善
○起立性低血圧を伴う血液透析患者における下記症状の改善
めまい・ふらつき・たちくらみ、倦怠感、脱力感
5. 効能または効果に関連する注意
<パーキンソン病の場合>
5.1 Yahr重症度分類でステージIIIと判定された患者への適用であること。
5.2 他剤の治療効果が不十分で、すくみ足又はたちくらみが認められる患者にのみ本剤の投与を考慮すること。
<血液透析患者の場合>
5.3 透析終了後の起立時に収縮期血圧が15mmHg以上低下する患者への適用であること。なお、本薬の作用機序は不明であり、治療後の血圧低下の減少度は個体内変動を超えるものではない。
6. 用法及び用量
<パーキンソン病の場合>
通常成人に対し、ドロキシドパとして1日量100mg、1日1回の経口投与より始め、隔日に100mgずつ増量、最適投与量を定め維持量とする(標準維持量は1日600mg、1日3回分割投与)。
なお、年齢、症状により適宜増減するが、1日900mgを超えないこととする。
なお、年齢、症状により適宜増減するが、1日900mgを超えないこととする。
<シャイドレーガー症候群、家族性アミロイドポリニューロパチーの場合>
通常成人に対し、ドロキシドパとして1日量200〜300mgを2〜3回に分けて経口投与より始め、数日から1週間毎に1日量100mgずつ増量、最適投与量を定め維持量とする(標準維持量は1日300〜600mg、1日3回分割投与)。
なお、年齢、症状により適宜増減するが、1日900mgを超えないこととする。
なお、年齢、症状により適宜増減するが、1日900mgを超えないこととする。
<血液透析患者の場合>
通常成人に対し、ドロキシドパとして1回量200〜400mgを透析開始30分から1時間前に経口投与する。
なお、年齢、症状により適宜減量する。1回量は400mgを超えないこととする。
なお、年齢、症状により適宜減量する。1回量は400mgを超えないこととする。
7. 用法及び用量に関連する注意
<血液透析患者の場合>
1ヵ月間投与しても効果が認められない場合には、投与を中止すること。
8. 重要な基本的注意
<効能共通>
8.1 本剤の投与は、少量から開始し観察を十分に行い慎重に維持量まで増量すること。ただし、その他の抗パーキンソン剤、昇圧剤の投与を中止する必要はない。
8.2 過度の昇圧反応を起こすことがあるので、過量投与にならないように注意すること。[13.1参照]
<パーキンソン病の場合>
8.3 効果が認められない場合には、漫然と投与しないよう注意すること。
<血液透析患者の場合>
8.4 用法(透析開始30分から1時間前に経口投与)及び用量を遵守し、透析後の追加など過剰投与(過度の昇圧反応が見られることがある)にならないように十分注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 コカイン中毒の患者
治療上やむを得ないと判断される場合を除き、投与しないこと。コカインは神経終末においてカテコールアミンの再取り込みを阻害するため、本剤の作用が増強するおそれがある。
9.1.2 心室性頻拍のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。症状が悪化するおそれがある。
9.1.3 高血圧の患者
高血圧を悪化させることがある。
9.1.4 動脈硬化症の患者
過度の昇圧反応が起こるおそれがある。
9.1.5 甲状腺機能亢進症の患者
頻脈等の症状が悪化するおそれがある。
9.1.6 心疾患のある患者
症状が悪化するおそれがある。
9.1.7 重篤な肺疾患、気管支喘息又は内分泌系疾患のある患者
これらの症状が悪化するおそれがある。
9.1.8 慢性開放隅角緑内障の患者
眼圧が上昇するおそれがある。
9.1.9 糖尿病を合併した血液透析患者
糖尿病の程度(末梢循環、血圧、血糖管理などの状態や、血管合併症の程度など)に十分留意すること。重度の糖尿病を合併した血液透析患者では末梢循環障害を生じるおそれがある。
9.2 腎機能障害患者
9.2.1 重篤な腎障害のある患者
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物実験で胎児の波状肋骨の増加が、また、他剤(dl-ノルアドレナリン)で子宮血管の収縮により胎児が仮死状態となることが報告されている。[2.5参照]
9.5.1 器官形成期投与試験
SD系ラットに60、200、600mg/kg/日連続経口投与した実験で、200mg/kg以上で胎児の体重低値及び波状肋骨の発現頻度の増加が認められたが、生後に修復する程度のものであった1)。
9.5.2 周産期・授乳期投与試験
SD系ラットに60、200、600mg/kg/日連続経口投与した実験で、600mg/kgで妊娠期間の短縮が認められた1)。
9.5.3 胎児への移行
妊娠20日目のラットに14C-ドロキシドパを10mg/kg1回経口投与した場合、投与後1時間目の胎児の脳、肝臓、腎臓及び血清中の14C放射活性は母体と同じか少し低いレベルであった2)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験で乳汁中への移行が、また、母獣への授乳期投与において児の発育抑制が報告されている。
9.6.1 周産期・授乳期投与試験
SD系ラットに60、200、600mg/kg/日連続経口投与した実験で、60mg/kg以上で出生児の生後発育の抑制が認められた1)。
9.6.2 乳汁中への移行
授乳中の母ラットに14C-ドロキシドパを10mg/kg1回経口投与した場合、乳汁中に14Cの移行が認められた2)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
過量投与にならないように注意すること。一般に生理機能が低下している。
10. 相互作用
10.1 併用禁忌
10.2 併用注意
| モノアミン酸化酵素阻害剤 | 本剤の作用が増強され、血圧の異常上昇をきたすことがある。 | ノルアドレナリンの代謝が抑制され、ノルアドレナリンの濃度が増加する。 |
| 三環系抗うつ剤 イミプラミン アミトリプチリン 等 | 本剤の作用が増強され、血圧の異常上昇をきたすことがある。 | 神経終末でのノルアドレナリンの再吸収が阻害され、ノルアドレナリンの濃度が増加する。 |
| 分娩促進剤 オキシトシン エルゴタミン 抗ヒスタミン剤 クロルフェニラミン等 | 本剤の作用が増強され、血圧の異常上昇をきたすことがある。 | 相加的に作用(末梢血管収縮作用)を増強させる。 |
| α1-受容体遮断作用のある薬剤 タムスロシン ドキサゾシン イフェンプロジル 等 | 本剤の作用が減弱される可能性がある。 | これらの薬剤はα1受容体遮断作用を有する。 |
| アメジニウム | 本剤の作用が増強され、血圧の異常上昇をきたすことがある。 | 神経終末でのノルアドレナリンの再吸収・代謝が阻害され、ノルアドレナリンの濃度が増加する。 |
| レセルピン誘導体 レセルピン等 | 本剤の作用が減弱される可能性がある。 | レセルピンは脳内ノルアドレナリン、ドパミンを減少させる。 |
| レボドパ アマンタジン 等 | これらの医薬品の作用を増強することがある。 | 動物実験でレボドパ、アマンタジンの作用を増強することが認められている。 |
| フェノチアジン系薬剤、ブチロフェノン系薬剤 | 本剤の作用が減弱することがある。 | これらの薬剤は抗ドパミン作用のほかに末梢のα受容体遮断作用を有する。 |
| 鉄剤 | 本剤の作用が減弱される可能性がある。 | 動物実験でキレートを形成し、本剤の吸収が減少するとの報告がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 悪性症候群(頻度不明)
高熱、意識障害、高度の筋硬直、不随意運動、血清CKの上昇等があらわれることがあるので、このような場合には、投与開始初期の場合は中止し、また、継続投与中の用量変更・中止時の場合は一旦もとの投与量に戻した後慎重に漸減し、体冷却、水分補給等の適切な処置を行うこと。
11.1.2 白血球減少、無顆粒球症、好中球減少、血小板減少(いずれも頻度不明)
11.2 その他の副作用
| 1%以上 | 0.3〜1%未満 | 0.3%未満 | 頻度不明 | |
| 精神神経系 | 幻覚、頭痛・頭重感(3.4%)、めまい | 妄想、神経過敏(いらいら感、焦燥感、興奮等)、不安、抑うつ、不眠、不随意運動、頭がぼーっとする | 精神症状の増悪、悪夢、感情失禁、パーキンソン症状の増悪、知覚異常、振戦、固縮、すくみ、言語障害の悪化、眠気 | 夜間せん妄、健忘 |
| 消化器 | 悪心、食欲不振、胃痛(胃部不快感等) | 嘔吐、口渇、腹痛、消化不良(胸やけ等)、便秘、下痢、流涎 | 腹部膨満感、舌のあれ | |
| 循環器 | 血圧上昇(2.2%)、動悸 | 胸痛(胸部不快感、胸部絞扼感等) | 不整脈、チアノーゼ、四肢冷感 | 狭心症 |
| 肝臓 | AST、ALTの上昇 | ALP、LDHの上昇 | ||
| 過敏症 | 発疹 | そう痒 | ||
| 眼 | 羞明 | |||
| 泌尿器 | 頻尿、尿失禁、尿閉 | |||
| その他 | 倦怠感、ほてり(顔面潮紅等) | 浮腫、眼瞼浮腫、脱力感、発熱、両手の痛み、肩こり | のぼせ、発汗、CK上昇 |
13. 過量投与
13.1 症状
過度の昇圧反応を起こすことがある。[8.2参照]
14. 適用上の注意
<OD錠>
14.1 薬剤調製時の注意
自動分包機を使用する場合は欠けることがあるため、カセットのセット位置等に注意すること。
14.2 薬剤交付時の注意
14.2.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.2.2 本剤は舌の上にのせて唾液を浸潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
<健康成人>
ドプスカプセル(販売中止)100mg又は300mgを1回経口投与した場合、未変化体の血漿中濃度は投与2時間後に最高値(それぞれ0.8μg/mL、2.2μg/mL)に達し、その後比較的速やかに減少し(半減期約1.5時間)、12時間後にはほとんど消失した。
| 投与量(mg) | 例数 | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) |
| 100 | 4 | 0.8 | 2 | 約1.5 |
| 300 | 5 | 2.2 | 2 | 約1.5 |
また、血漿中ノルアドレナリン濃度は未変化体の最高値到達時間より遅れ、投与4時間後に最高値(投与前値のそれぞれ約2倍、約3倍)に達した3)。
<パーキンソン病、シャイドレーガー症候群及び家族性アミロイドポリニューロパチー患者>
<血液透析患者>
血液透析患者5例にドプスカプセル1回300mgを透析開始1時間前に経口投与した場合、未変化体の血漿中濃度は投与6時間後に最高値(1.43μg/mL)を示し、投与36時間後に定量限界以下(0.05μg/mL)となった。また、血漿中ノルアドレナリン濃度は投与3時間以降、投与前値に対し有意な高値を認め、以後投与6〜36時間まで持続した6)。
16.1.2 反復投与
健康成人4例にドプスカプセル1回300mg、1日2回、5日間反復経口投与した場合、投与開始後1、3及び5日目の投与4時間後の血漿中未変化体濃度はいずれも約1μg/mLであった。また、それぞれの投与前及び5日目の24時間後には血漿中からほとんど消失しており、反復投与による影響は認められなかった3)。
16.1.3 生物学的同等性
OD錠と細粒は生物学的に同等であることが確認された7)。
| 剤形 | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | AUC0〜24hr(μg・hr/mL) |
| OD錠200mg (水で服用) | 1.9 | 2.5 | 1.9 | 8.5 |
| OD錠200mg (水なしで服用) | 1.9 | 2.6 | 2.0 | 8.1 |
| 細粒20% (水で服用) | 1.9 | 1.8 | 2.1 | 7.9 |
16.3 分布
マウス、ラット、イヌ及びアカゲザルに14C-ドロキシドパを10mg/kg1回経口投与した場合、投与後1時間目(マウスでは0.5時間目)の組織中14C放射活性は腎臓、肝臓で高く、脳、脊髄への移行も認められた。なおマウス及びラットでは膵臓でも高かった8)。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
<パーキンソン病(Yahr重症度ステージIII)>
17.1.1 国内臨床試験
<シャイドレーガー症候群>
17.1.2 国内臨床試験
プラセボを対照薬とした二重盲検比較試験において、起立性低血圧、失神、たちくらみを指標とした臨床改善度は、中等度改善以上40.9%(9/22)であった11)。また、上記二重盲検比較試験を含む臨床試験において、起立性低血圧、失神、たちくらみを指標とした臨床改善度は、中等度改善以上32.4%(22/68)であった。
<家族性アミロイドポリニューロパチー>
17.1.3 国内臨床試験
起立性低血圧、失神、たちくらみを指標とした臨床改善度は、中等度改善以上37.9%(11/29)であった12)。
<血液透析患者>
17.1.4 国内後期第II相試験
起立性低血圧症状を伴う透析患者152例を対象としたプラセボ対照二重盲検比較試験において、本剤200mg、400mg又はプラセボを透析開始約30分前(週3回)に4週間投与したとき、起立性低血圧を指標とした臨床改善度(中等度改善以上)は、プラセボ群12.8%(6/47)、本剤200mg群43.5%(20/46)、本剤400mg群60.4%(29/48)であった。本剤投与群の副作用発現頻度は200mg群で4.1%(2/49例)、400mg群で5.9%(3/51例)であり、両群いずれにも発現した副作用は、頭重感、血圧上昇2.0%(各群1例)であった13)。
17.1.5 国内第III相試験
起立性低血圧症状を伴う透析患者107例を対象としたプラセボ対照二重盲検比較試験において、本剤400mg又はプラセボを透析開始約30分前(週3回)に4週間投与したとき、起立性低血圧を指標とした臨床改善度(中等度改善以上)は、プラセボ群14.6%(6/41)、本剤400mg群53.3%(24/45)であった。本剤400mg投与群の副作用発現頻度は5.8%(3/52例)であり、2例以上発現した副作用は嘔気3.8%(2例)、倦怠感3.8%(2例)であった14)。
17.1.6 国内第III相試験(長期投与試験)
起立性低血圧症状を伴う透析患者76例を対象とした長期投与試験において、本剤200mg〜400mgを透析開始約30分前(週3回)に6ヵ月以上(最長1年間)投与したとき、起立性低血圧を指標とした最終臨床改善度(中等度改善以上)は、48.4%(31/64)であった。副作用発現頻度は12.2%(9/74例)であり、主な副作用は血圧上昇5.4%(4例)、頭痛2.7%(2例)等であった15)。
18. 薬効薬理
18.1 作用機序
本剤は生体内に広く存在する芳香族L-アミノ酸脱炭酸酵素により直接l-ノルアドレナリンに変換され、薬理作用を示す16)。
18.2 パーキンソン病におけるすくみ足、たちくらみの改善に関連する中枢作用
18.3 シャイドレーガー症候群及び家族性アミロイドポリニューロパチーにおける起立性低血圧等の改善に関連する末梢作用
18.3.1 6-ハイドロキシドパミンにより交感神経終末を破壊した動物において血圧を上昇させる25)(ラット)。
18.3.2 DSP-4によりノルアドレナリン作動性神経終末を選択的に破壊した動物及びヘキサメトニウムにより自律神経節を遮断した動物において、体位変換に伴う起立性低血圧を抑制する26)(ラット)。
18.3.3 シャイドレーガー症候群患者を対象とし微小神経電図法により検討した試験で、体位変換時の筋支配交感神経活動(発射頻度)増加作用が認められている27)。
18.4 起立性低血圧を伴う血液透析患者におけるめまい・ふらつき・たちくらみ、倦怠感、脱力感の改善に関連する作用
19. 有効成分に関する理化学的知見
19.1. ドロキシドパ
22. 包装
<ドプスOD錠100mg>
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
500錠[瓶、バラ]
<ドプスOD錠200mg>
100錠[10錠(PTP)×10]
<ドプス細粒20%>
100g[瓶、バラ]
23. 主要文献
- 広橋敦子ほか, 薬理と治療, 15 (Suppl.2), 283-299, (1987)
- 水野佳子ほか, 薬物動態, 2, 509-518, (1987) »DOI
- 鈴木友和ほか, 薬理と治療, 15 (Suppl.2), 381-400, (1987)
- 鈴木友和ほか, Eur.J.Clin.Pharmacol., 23, 463-468, (1982) »PubMed
- 鈴木友和ほか, Neurology., 34, 1446-1450, (1984) »PubMed
- 椿原美治ほか, 医学と薬学, 37, 401-410, (1997)
- 社内資料:OD錠と細粒の生物学的同等性試験
- 庄野文章ほか, 薬物動態, 2, 53-70, (1987) »DOI
- 楢林博太郎ほか, 臨床評価, 15, 423-457, (1987)
- 楢林博太郎ほか, 薬理と治療, 15 (Suppl.2), 411-443, (1987)
- 祖父江逸郎ほか, 医学のあゆみ, 141, 353-378, (1987)
- 鈴木友和ほか, 厚生省特定疾患「原発性アミロイドーシス調査研究班」61年度報告書, 223-226, (1987)
- 秋澤忠男ほか, 腎と透析, 42, 527-550, (1997)
- 越川昭三ほか, 透析会誌, 30, 941-959, (1997) »DOI
- 椿原美治ほか, 腎と透析, 43, 571-583, (1997)
- 加藤照文ほか, Biochem.Pharmacol., 36, 3051-3057, (1987) »PubMed
- 中村三孝ほか, 薬理と治療, 15 (Suppl.2), 367-373, (1987)
- 仙波純一ほか, Psychiatry Research., 15, 319-326, (1985) »PubMed
- 加藤照文ほか, Pharmacol.Biochem.Behav., 26, 407-411, (1987) »PubMed
- 笹 征史ほか, Brain Research., 420, 157-161, (1987) »PubMed
- 加藤照文ほか, Naunyn-Schmiedeberg's Arch.Pharmacol., 332, 243-246, (1986) »PubMed
- 勝山美智子ほか, Arch.Int.Pharmacodyn.Ther., 283, 61-70, (1986) »PubMed
- 直井 信ほか, J.Neural Transmission., 70, 51-61, (1987)
- 西野直樹ほか, J.Pharmacol.Exp.Therap., 242, 621-628, (1987) »PubMed
- 荒木宏昌ほか, J.Pharm.Pharmacol., 33, 772-777, (1981) »PubMed
- 佐藤 進ほか, Arzneim.-Forsch./Drug Res., 39, 1123-1129, (1989) »PubMed
- 加知輝彦ほか, Neurology., 38, 1091-1094, (1988) »PubMed
- 相野博司ほか, 基礎と臨床, 30, 3141-3150, (1996)
- 相野博司ほか, 基礎と臨床, 30, 3131-3139, (1996)
24. 文献請求先及び問い合わせ先
文献請求先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
製品情報問い合わせ先
住友ファーマ株式会社
くすり情報センター
〒541-0045
大阪市中央区道修町2-6-8
電話:0120-034-389
26. 製造販売業者等
26.1 製造販売元
住友ファーマ株式会社
大阪市中央区道修町2-6-8