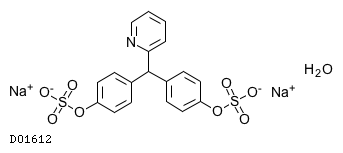
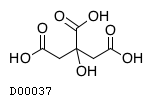
医薬品情報
| 総称名 | ピコプレップ |
|---|---|
| 一般名 | ピコスルファートナトリウム水和物 酸化マグネシウム 無水クエン酸 |
| 欧文一般名 | Sodium Picosulfate Hydrate Magnesium Oxide Anhydrous Citric Acid |
| 製剤名 | ピコスルファートナトリウム水和物・酸化マグネシウム・無水クエン酸配合剤 |
| 薬効分類名 | 経口腸管洗浄剤 |
| 薬効分類番号 | 7990 |
| ATCコード | A06AB58 |
| KEGG DRUG |
D10793
ピコスルファートナトリウム水和物・酸化マグネシウム・無水クエン酸
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年7月 改訂(再審査結果)(第3版)

|
1.警告 2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ピコプレップ配合内用剤 | PICOPREP Combination Powder | 日本ケミファ | 7990103A1029 | 987.8円/包 | 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対して過敏症の既往歴のある患者
2.2 胃腸管閉塞症又は腸閉塞の疑いのある患者[腸管内容物の増大や腸管蠕動運動の亢進により腸管内圧が上昇し、腸管粘膜の虚血、腸閉塞、腸管穿孔を引き起こすおそれがある。][1.参照]
2.3 腸管穿孔のある患者[腹膜炎その他重篤な合併症を起こすおそれがある。]
2.4 中毒性巨大結腸症のある患者[穿孔を引き起こし腹膜炎、腸管出血を起こすおそれがある。]
2.5 急性腹症が疑われる患者[腸管蠕動運動の亢進により、症状が悪化するおそれがある。]
2.6 重度の腎機能障害のある患者(クレアチニンクリアランスが30mL/分未満)[9.2.1参照]
4. 効能または効果
大腸内視鏡検査及び大腸手術時の前処置における腸管内容物の排除
6. 用法及び用量
通常、成人には、1回1包を約150mLの水に溶解し、検査又は手術前に2回経口投与する。1回目の服用後は、1回250mLの透明な飲料を数時間かけて最低5回、2回目の服用後は1回250mLの透明な飲料を検査又は手術の2時間前までに最低3回飲用する。
<検査又は手術の前日と当日に分けて2回投与する場合>
検査又は手術の前日は低残渣食、当日は透明な飲料のみとし、検査又は手術前日の夜及び検査又は手術当日の朝(検査又は手術の4〜9時間前)の2回経口投与する。
<検査又は手術の前日に2回投与する場合>
検査又は手術の前日は低残渣食、当日は透明な飲料のみとし、検査又は手術前日の夕及び1回目の服用から約6時間後の夜の2回経口投与する。
7. 用法及び用量に関連する注意
7.2 脱水を避けるため、口渇時には用法及び用量に定められた水分摂取に加え、透明な飲料を適宜追加して飲用するよう指導すること。
7.3 検査又は手術が午後に行われる場合は、前日と当日の2回に分けて投与すること。
8. 重要な基本的注意
8.1 高齢者及び腎機能障害や心機能障害等の電解質異常のリスクのある患者に本剤を投与した場合には低ナトリウム血症又は低カリウム血症等が起こるおそれがある。電解質異常のリスクのある患者に投与する場合には、本剤の投与前に血清電解質の検査を実施することが望ましい。[7.1、9.8.1、11.1.5参照]
8.2 まれに腸管穿孔、腸閉塞、虚血性大腸炎及び高マグネシウム血症等を起こすことがある。腸管穿孔、腸閉塞及び虚血性大腸炎は腸管内容物の増大、蠕動運動の亢進による腸管内圧の上昇により発症し、高マグネシウム血症は、腸閉塞により本剤が腸管内に貯留しマグネシウムの吸収が亢進することにより発症するので、投与に際しては次の点に留意すること。[1.、9.8.2、11.1.2-11.1.4参照]
8.2.1 患者の日常の排便状況を確認し、本剤投与前日あるいは投与前にも通常程度の排便があったことを確認した後投与すること。
8.2.2 本剤の投与により排便があった後も腹痛、嘔吐が継続する場合には、腹部の診察や画像検査(単純X線、超音波、CT等)を行い、腸管穿孔等がないか確認すること。
8.3 自宅で本剤を服用させる場合には、患者及びその家族に次の点について十分説明・指導すること。
8.3.1 日常の排便状況を確認させるとともに、本剤服用前日、あるいは服用前に通常程度の排便があったことを確認させ、排便がない場合は服用前に医師に相談すること。
8.3.2 副作用があらわれた場合に、対応が困難になる場合があるので、一人での服用は避けること。
8.3.3 悪心・嘔吐、腹痛等の消化器症状やアナフィラキシー、過敏症、発疹等のアレルギー症状等の本剤の副作用について事前に説明し、このような症状があらわれた場合には、服用を中止し、直ちに受診すること。また、服用後についても同様の症状があらわれた場合には直ちに受診すること。
8.3.4 電解質異常を起こすおそれがあるため水のみを摂取しないこと。[7.1参照]
8.4 薬剤の吸収に及ぼす影響
本剤による腸管洗浄が経口投与された薬剤の吸収を妨げる可能性があるので、投与時間等に注意すること。また、薬剤の吸収阻害が臨床上重大な問題となる薬剤を投与中の患者については、院内で十分観察しながら投与すること。
8.5 排便に伴う腸管内圧の変動により、めまい、ふらつき、一過性の血圧低下等が発現することがあるので、十分に観察しながら投与すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 うっ血性心不全、心機能障害のある患者
電解質の変動により、心機能を抑制するおそれがある。
9.1.2 高マグネシウム血症の患者
血中マグネシウム濃度が上昇するおそれがある。
9.1.3 腹部外科手術の既往歴のある患者
腸閉塞や腸管穿孔を起こすおそれがある。
9.1.4 腸管狭窄及び高度な便秘のある患者
腸管内容物の増大や腸管蠕動運動の亢進により、腸閉塞や腸管穿孔を起こすおそれがある。[1.参照]
9.1.5 腸管憩室のある患者
腸管穿孔を起こすおそれがある。[1.参照]
9.1.6 重度の活動性の炎症性腸疾患のある患者
症状が悪化するおそれがある。
9.1.7 誤嚥を起こすおそれのある患者
誤嚥を起こすおそれのある患者(高齢者、嚥下が困難な患者等)に投与する際には注意すること。誤嚥により、呼吸困難、肺炎を起こすことがある。
9.1.8 糖尿病用薬を投与中の患者
糖尿病用薬の投与は検査当日の食事摂取後より行うこと。食事制限により低血糖を起こすおそれがある。
9.2 腎機能障害患者
9.2.1 重度の腎機能障害のある患者(クレアチニンクリアランスが30mL/分未満)
投与しないこと。吸収されたマグネシウムの排泄が遅延し、血中マグネシウム濃度が上昇するおそれがある。また、多量の水分摂取は腎機能に負荷となり、症状が悪化するおそれがある。[2.6参照]
9.2.2 軽度又は中等度の腎機能障害のある患者
電解質異常を起こすおそれがある。
9.5 妊婦
妊婦又は妊娠の可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
10. 相互作用
10.2 併用注意
| テトラサイクリン系抗生物質/フルオロキノロン系抗菌剤、鉄剤、ジゴキシン、クロルプロマジン、ペニシラミン等 | これらの薬剤の効果が減弱するおそれがある。本剤投与の少なくとも2時間前又は投与後6時間以降に服用するなど、同時には服用しないこと。 | マグネシウムイオンがこれらの薬剤との間で難溶性キレートを形成することにより、もしくは本剤の投与により消化管内のpHが上昇することにより、各薬剤の吸収が阻害される。 |
| 利尿剤、副腎皮質ステロイド剤、強心配糖体を有する薬剤、リチウム | 低カリウム血症を引き起こすおそれがある。 | カリウムの排出が増加することによる。 |
| NSAID(非ステロイド性消炎鎮痛剤)又はSIADH(抗利尿ホルモン不適合分泌症候群)を誘発することが知られている薬剤 三環系抗うつ薬 選択的セロトニン再取り込み阻害薬 抗精神病薬 カルバマゼピン等 | 水分貯留や電解質異常を起こすおそれがあるため注意すること。 | 水分貯留及び/又は電解質バランス異常のリスクを増加させる。 |
| 酸性薬物 サリチル酸等 | 酸性薬物の効果が減弱するおそれがある。 | 本剤が尿pHを上昇させることにより、排泄を促進する。 |
| 塩基性薬物 メタンフェタミン等 | 塩基性薬物の効果が増強するおそれがある。 | 本剤が尿pHを上昇させることにより、排泄を阻害する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
顔面蒼白、血圧低下、嘔吐、嘔気持続、気分不良、眩暈、冷感、蕁麻疹、呼吸困難、顔面浮腫等があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.2 腸管穿孔、腸閉塞、鼠径ヘルニア嵌頓(いずれも頻度不明)
11.1.3 虚血性大腸炎(頻度不明)[8.2参照]
11.1.4 高マグネシウム血症(頻度不明)
呼吸抑制、意識障害、不整脈があらわれ、心停止に至る場合もあるので、観察を十分に行い、嘔気、嘔吐、筋力低下、傾眠、血圧低下、徐脈、皮膚潮紅等の症状が認められた場合には、電解質の測定を行うとともに、適切な処置を行うこと。[8.2参照]
11.1.5 低ナトリウム血症、低カリウム血症(いずれも頻度不明)
11.2 その他の副作用
| 1%以上 5%未満 | 1%未満 | 頻度不明 | |
| 免疫系障害 | 過敏症 | ||
| 代謝および栄養障害 | 血中マグネシウム増加 | 血中ビリルビン増加、血中リン減少、血中カリウム増加 | |
| 神経系障害 | 頭痛 | てんかん、大発作痙攣、痙攣、錯乱状態 | |
| 精神障害 | 睡眠障害 | ||
| 心臓障害 | 右脚ブロック | ||
| 胃腸障害 | 悪心、直腸炎 | 腹痛、便失禁、大腸炎 | 嘔吐、肛門周囲痛、アフタ性回腸潰瘍、下痢 |
| 肝臓障害 | AST上昇、ALT上昇、肝機能検査異常 | ||
| 腎臓障害 | 尿中血陽性、血中尿素減少、尿中蛋白陽性 | ||
| 血液障害 | APTT延長、リンパ球数減少、好中球数増加、血小板数増加、白血球数減少、白血球数増加 | ||
| 皮膚障害 | 発疹(紅斑性皮疹、斑状丘疹状皮疹、蕁麻疹、紫斑を含む) | ||
| その他 | 異常感、悪寒 |
13. 過量投与
激しい下痢、重篤な電解質異常が発現するおそれがある。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 1包を約150mLの水に入れ、2〜3分間かき混ぜて溶解した後、使用すること。ただし、溶解時に発熱するため、冷水に溶解することが望ましい。溶解液が熱くなった場合には、十分に冷ましてから服用すること。
14.1.2 本剤の溶解液に他成分を添加しないこと。
14.1.3 開封後は速やかに使用すること。また、未使用の粉末や溶解液は廃棄すること。
16. 薬物動態
16.1 血中濃度
16.1.1 外国人健康成人16例に本剤2包を、6時間を空けて分割投与した際の1回目投与後及び2回目投与後のピコスルファートのCmax(平均値±標準偏差)はそれぞれ2.3±1.4ng/mL、3.2±2.6ng/mLであり、Tmax(中央値(最小値,最大値))はそれぞれ2(0.5,4.0)時間、8(2.0,10.0)時間であった。また、同様に本剤1回目投与後及び2回目投与後のマグネシウムのCmaxはそれぞれ0.88±0.07mmol/L、0.95±0.08mmol/Lであり、Tmaxはそれぞれ4(1.0,4.0)時間、10(4.0,16.1)時間であった。ピコスルファートのt1/2(平均値±標準偏差)は7.4±3.2時間であった1)。
16.1.2 国内臨床試験において、本剤を検査の前日と当日に分けて2回投与した患者213例、検査の前日に2回投与した患者211例の血中マグネシウムの濃度の推移は以下のとおりであった2)。
| 血中マグネシウム濃度(mmol/L) | スクリーニング時 | 大腸内視鏡検査当日 | 試験終了時 |
| 前日及び当日投与群 (n=213) | 0.88±0.06 | 1.03±0.07 | 0.87±0.07 |
| 前日2回投与群 (n=211) | 0.89±0.07 | 1.03±0.08 | 0.86±0.07 |
16.2 吸収
外国人健康成人16例に本剤2包を、6時間を空けて分割投与したとき、ピコスルファートナトリウム水和物の活性代謝物であるビス-(p-ヒドロキシフェニル)-ピリジル-2-メタン(BHPM)の血漿中濃度は低く、16例中13例において検出限界以下であった1)。
16.5 排泄
外国人健康成人16例に本剤2包を、6時間空けて分割投与したとき、ピコスルファートは投与量の0.11%が未変化体として尿中に排泄された。吸収されたBHPMの多くはグルクロン酸抱合体として尿中に排泄された1)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
大腸内視鏡検査前処置に対する国内臨床試験の結果は次の通りであり、本剤の検査の前日と当日に分けて2回投与した群、及び検査の前日に2回投与した群の腸管洗浄効果は、ナトリウム・カリウム配合内用剤群に対して非劣性であることが検証された。副作用(臨床検査値異常を含む)は424例中39例(発現率9.2%)、58件報告された。その主なものは血中マグネシウム増加8件(1.9%)、悪心6件(1.4%)、直腸炎5件(1.2%)であった。なお、大腸手術前処置に対する臨床試験は実施していない2)。
| 有効率(例数) | |
| 本剤前日及び当日投与群 | 97.7%(209/214) |
| 本剤前日2回投与群 | 92.0%(195/212) |
| ナトリウム・カリウム配合内用剤当日投与群 | 95.3%(201/211) |
18. 薬効薬理
18.1 作用機序
19. 有効成分に関する理化学的知見
19.1. ピコスルファートナトリウム水和物
19.2. 酸化マグネシウム
| 一般的名称 | 酸化マグネシウム |
|---|---|
| 一般的名称(欧名) | Magnesium Oxide |
| 化学名 | Magnesium Oxide |
| 分子式 | MgO |
| 分子量 | 40.30 |
| 物理化学的性状 | 酸化マグネシウムは白色の粉末又は粒で、においはない。 本品は水、エタノール(95)又はジエチルエーテルにほとんど溶けない。 本品は希塩酸に溶ける。本品は空気中で湿気及び二酸化炭素を吸収する。 |
| KEGG DRUG |
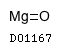
|
19.3. 無水クエン酸
22. 包装
16.1g×20包[アルミラミネート袋]
23. 主要文献
- 社内資料:米国第I相臨床試験(2016年7月4日承認、CTD2.7.6.1)
- 社内資料:国内第III相臨床試験(J-CLEAR)(2016年7月4日承認、CTD2.7.6.2)
- Forth W.et al., Naunyn-Schmiederberg's Arch.Pharmacol., 274, 46-53, (1972)
- Hillestad B.et al., Acta pharmacol.toxicol., 51, 388-394, (1982)
- Jauch R.et al., Arzneim.Forsch.-Drug Res., 25, 1796-1800, (1975)
- Pala G.et al., Arch.int.Pharmacodyn., 164, 356-369, (1966)
- Brunton Laurence L.et al., Goodman & Gilman's The Pharmacological Basis of Therapeutics,11th ed., 992, (2006)
24. 文献請求先及び問い合わせ先
文献請求先
日本ケミファ株式会社
安全管理部
〒101-0032
東京都千代田区岩本町2丁目2-3
電話:0120-47-9321
03-3863-1225
03-3863-1225
FAX:03-3861-9567
製品情報問い合わせ先
日本ケミファ株式会社
安全管理部
〒101-0032
東京都千代田区岩本町2丁目2-3
電話:0120-47-9321
03-3863-1225
03-3863-1225
FAX:03-3861-9567
26. 製造販売業者等
26.1 製造販売元(輸入)
日本ケミファ株式会社
東京都千代田区岩本町2丁目2-3