医薬品情報
| 総称名 | イニシンク |
|---|---|
| 一般名 | アログリプチン安息香酸塩 メトホルミン塩酸塩 |
| 欧文一般名 | Alogliptin Benzoate Metformin Hydrochloride |
| 製剤名 | アログリプチン安息香酸塩/メトホルミン塩酸塩配合錠 |
| 薬効分類名 | 選択的DPP-4阻害薬/ビグアナイド系薬配合剤 2型糖尿病治療剤 |
| 薬効分類番号 | 3969 |
| ATCコード | A10BD13 |
| KEGG DRUG |
D10253
アログリプチン安息香酸塩・メトホルミン塩酸塩
|
| KEGG DGROUP |
DG02044
血糖降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第5版)
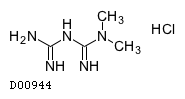
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| イニシンク配合錠 | INISYNC Combination Tablets | 帝人ファーマ | 3969105F1023 | 129.9円/錠 | 劇薬, 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
2.1 次に示す患者[メトホルミンにより乳酸アシドーシスを起こしやすい。][1.1、8.1、11.1.1参照]
・乳酸アシドーシスの既往のある患者
・重度の腎機能障害(eGFR 30mL/min/1.73m2未満)のある患者又は透析患者(腹膜透析を含む)[9.2.1参照]
・重度の肝機能障害のある患者[9.3.1参照]
・心血管系、肺機能に高度の障害(ショック、心不全、心筋梗塞、肺塞栓等)のある患者及びその他の低酸素血症を伴いやすい状態にある患者[嫌気的解糖の亢進により乳酸産生が増加する。]
・脱水症の患者又は脱水状態が懸念される患者(下痢、嘔吐等の胃腸障害のある患者、経口摂取が困難な患者等)
・過度のアルコール摂取者[肝臓における乳酸の代謝能が低下する。また、脱水状態を来すことがある。][10.1参照]
2.2 重症ケトーシス、糖尿病性昏睡又は前昏睡、1型糖尿病の患者[輸液、インスリンによる速やかな高血糖の是正が必須となるので本剤の投与は適さない。]
2.3 重症感染症、手術前後、重篤な外傷のある患者[インスリン注射による血糖管理が望まれるので本剤の投与は適さない。また、メトホルミンにより乳酸アシドーシスを起こしやすい。][1.1、8.1、11.1.1参照]
2.4 栄養不良状態、飢餓状態、衰弱状態、脳下垂体機能不全又は副腎機能不全の患者[低血糖を起こすおそれがある。][11.1.2参照]
2.5 妊婦又は妊娠している可能性のある女性[9.5参照]
2.6 本剤の各成分又はビグアナイド系薬剤に対し過敏症の既往歴のある患者
4. 効能または効果
2型糖尿病
ただし、アログリプチン安息香酸塩及びメトホルミン塩酸塩の併用による治療が適切と判断される場合に限る。
ただし、アログリプチン安息香酸塩及びメトホルミン塩酸塩の併用による治療が適切と判断される場合に限る。
5. 効能または効果に関連する注意
5.1 本剤を2型糖尿病治療の第一選択薬として用いないこと。
5.2 原則として、以下の場合に、本剤の使用を検討すること。
・既にアログリプチン安息香酸塩(アログリプチンとして1日25mg)及びメトホルミン塩酸塩(メトホルミン塩酸塩として1日500mg)を併用し状態が安定している場合
・アログリプチン安息香酸塩(アログリプチンとして1日25mg)単剤の治療により効果不十分な場合
・メトホルミン塩酸塩(メトホルミン塩酸塩として1日500mg)単剤の治療により効果不十分な場合
5.3 本剤投与中において、本剤の投与がアログリプチン安息香酸塩及びメトホルミン塩酸塩の各単剤の併用よりも適切であるか慎重に判断すること。
5.4 中等度の腎機能障害のある患者(eGFR 30mL/min/1.73m2以上60mL/min/1.73m2未満)では、アログリプチン安息香酸塩及びメトホルミン塩酸塩を腎機能の程度に応じて減量するなど慎重な投与が必要であるため、本剤を使用せず、各単剤の併用を検討すること。[8.1、9.2.2、11.1.1、16.6.1参照]
5.5 本剤の適用はあらかじめ糖尿病治療の基本である食事療法、運動療法を十分に行ったうえで効果が不十分な場合に限り考慮すること。
6. 用法及び用量
通常、成人には1日1回1錠(アログリプチン/メトホルミン塩酸塩として25mg/500mg)を食直前又は食後に経口投与する。
8. 重要な基本的注意
8.1 メトホルミンによりまれに重篤な乳酸アシドーシスを起こすことがある。リスク因子としては、腎機能障害、肝機能障害、低酸素血症を伴いやすい状態、脱水(利尿作用を有する薬剤の併用を含む)、過度のアルコール摂取、感染症、高齢者等が知られている。特に、脱水、過度のアルコール摂取等により患者の状態が急変することもあるので、以下の点に注意すること。[1.1、1.2、2.3、11.1.1参照]
(1)本剤の投与開始前及びその後も投与中は定期的に、腎機能(eGFR等)及び肝機能を確認するとともに、患者の状態に十分注意して投与の適否を検討すること。なお、高齢者等、特に慎重な経過観察が必要な場合には、より頻回に確認すること。[2.1、5.4、9.2、9.3、9.8参照]
(3)本剤の投与開始時及びその後も投与中は適切に、以下の内容を患者及びその家族に十分指導すること。
・乳酸アシドーシスの症状(胃腸障害、倦怠感、筋肉痛、過呼吸等)があらわれた場合には、直ちに受診すること。[11.1.1参照]
(4)ヨード造影剤を用いて検査を行う患者においては、メトホルミンの併用により乳酸アシドーシスを起こすことがあるので、検査前は本剤の投与を一時的に中止すること(ただし、緊急に検査を行う必要がある場合を除く)。ヨード造影剤投与後48時間は本剤の投与を再開しないこと。なお、投与再開時には、患者の状態に注意すること。[10.2参照]
8.3 アログリプチンにより急性膵炎があらわれることがあるので、持続的な激しい腹痛、嘔吐等の初期症状があらわれた場合には、速やかに医師の診察を受けるよう患者に指導すること。[11.1.3参照]
8.4 本剤投与中は、血糖を定期的に検査するとともに、経過を十分に観察し、本剤を2〜3ヵ月投与しても効果が不十分な場合には、より適切と考えられる治療への変更を考慮すること。
8.5 低血糖症状を起こすことがあるので、高所作業、自動車の運転等に従事している患者に投与するときには注意すること。[11.1.2参照]
8.6 本剤と他の糖尿病用薬の併用における安全性は検討されていない。[10.2参照]
8.7 アログリプチンとGLP-1受容体作動薬はいずれもGLP-1受容体を介した血糖降下作用を有している。両剤を併用した際の臨床試験成績はなく、有効性及び安全性は確認されていない。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 低血糖を起こすおそれのある以下の患者または状態
9.1.2 感染症
9.1.3 腹部手術の既往又はイレウスの既往のある患者
アログリプチンにより腸閉塞を含むイレウスを起こすおそれがある。[11.1.7参照]
9.2 腎機能障害患者
腎臓における排泄が減少しメトホルミンの血中濃度が上昇するため、乳酸アシドーシス等の発現リスクが高くなる可能性がある。また、アログリプチンの血中濃度が上昇する。[1.1、1.2、9.8、11.1.1、16.6.1参照]
9.2.1 重度の腎機能障害のある患者(eGFR 30mL/min/1.73m2未満)又は透析患者(腹膜透析を含む)
投与しないこと。[2.1参照]
9.2.2 中等度の腎機能障害のある患者(eGFR 30mL/min/1.73m2以上60mL/min/1.73m2未満)
9.2.3 軽度の腎機能障害のある患者(eGFR 60mL/min/1.73m2以上90mL/min/1.73m2未満)[8.1参照]
9.3 肝機能障害患者
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。メトホルミン及びアログリプチンでは、動物試験(ラット)で乳汁中へ移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
高齢者では、腎機能、肝機能等が低下していることが多く、また脱水症状を起こしやすい。これらの状態では乳酸アシドーシスを起こしやすいので、以下の点に注意すること。[1.2、8.1、9.2、9.3、11.1.1、16.6.1-16.6.3参照]
・本剤の投与開始前、投与中は定期的に、特に慎重な経過観察が必要な場合にはより頻回に腎機能や肝機能を確認すること。メトホルミンはほとんど代謝されず、未変化体のまま尿中に排泄される。また、肝機能の低下により乳酸の代謝能が低下する。
・腎機能や脱水症状等患者の状態に十分注意して投与の中止を検討すること。特に75歳以上の高齢者では、メトホルミンによる乳酸アシドーシスが多く報告されており、予後も不良であることが多いため、本剤投与の適否をより慎重に判断すること。
・血清クレアチニン値が正常範囲内であっても、年齢によっては実際の腎機能が低下していることがあるので、eGFR等も考慮して、慎重に患者の状態を観察すること。
10. 相互作用
10.1 併用禁忌
10.2 併用注意
| ヨード造影剤 [8.1、11.1.1参照] | 乳酸アシドーシスを起こすことがある。併用する場合は本剤の投与を一時的に中止する等適切な処置を行うこと。 | 併用により腎機能が低下し、メトホルミンの排泄が低下する。 |
| 腎毒性の強い抗生物質 ゲンタマイシン 等 [11.1.1参照] | 乳酸アシドーシスを起こすことがある。併用する場合は本剤の投与を一時的に中止する等適切な処置を行うこと。 | 併用により腎機能が低下し、メトホルミンの排泄が低下する。 |
| 利尿作用を有する薬剤 利尿剤 SGLT2阻害剤 等 [8.1、11.1.1参照] | 脱水により乳酸アシドーシスを起こすことがあるため、脱水症状があらわれた場合には、本剤の投与を中止し、適切な処置を行うこと。 | 利尿作用を有する薬剤により、体液量が減少し脱水状態になることがある。 |
| 糖尿病用薬 スルホニルウレア剤 速効型インスリン分泌促進薬 α-グルコシダーゼ阻害剤 チアゾリジン系薬剤 GLP-1受容体作動薬 SGLT2阻害剤 イメグリミン インスリン製剤 等 [8.6、11.1.2参照] | 低血糖を発現するおそれがある。特に、スルホニルウレア剤又はインスリン製剤と併用する場合、低血糖のリスクが増加するおそれがある。これらの薬剤の減量を検討すること。 | 併用により血糖降下作用が増強するおそれがある。 |
| チアゾリジン系薬剤 ピオグリタゾン | 浮腫を発現するおそれがあるので観察を十分に行い、浮腫が認められた場合には、患者の状態に応じてチアゾリジン系薬剤を減量あるいは中止し、ループ利尿剤(フロセミド等)を投与するなど適切な処置を行うこと。 | 併用により循環血漿量が増加するおそれがある。 |
| 糖尿病用薬の血糖降下作用を増強する薬剤 β-遮断薬 サリチル酸製剤 モノアミン酸化酵素阻害薬 フィブラート系の高脂血症治療薬 ワルファリン 蛋白同化ホルモン剤 等 | 血糖が低下するおそれがある。 | 併用により血糖降下作用が増強するおそれがある。 |
| 糖尿病用薬の血糖降下作用を減弱する薬剤 アドレナリン 副腎皮質ホルモン 甲状腺ホルモン 卵胞ホルモン 利尿剤 ピラジナミド イソニアジド ニコチン酸 フェノチアジン系薬剤 等 | 血糖が上昇するおそれがある。 | 併用により血糖降下作用が減弱するおそれがある。 |
| OCT2、MATE1、又はMATE2-Kを阻害する薬剤 シメチジン ドルテグラビル ビクテグラビル バンデタニブ イサブコナゾニウム ピミテスピブ 等 [16.7.3参照] | メトホルミンの作用が増強するおそれがある。 | OCT2、MATE1、又はMATE2-Kを介したメトホルミンの腎排泄が阻害され、血中濃度が上昇するおそれがある。 |
| イメグリミン [8.8参照] | 消化器症状の発現に注意すること。 | 特に併用初期に多く発現する傾向が認められている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 乳酸アシドーシス(頻度不明)
11.1.2 低血糖(頻度不明)
11.1.3 急性膵炎(頻度不明)
持続的な激しい腹痛、嘔吐等の異常が認められた場合には投与を中止し、適切な処置を行うこと。[8.3参照]
11.1.4 肝機能障害、黄疸(頻度不明)
AST、ALT、AL-P等の著しい上昇を伴う肝機能障害、黄疸があらわれることがある。
11.1.5 皮膚粘膜眼症候群(Stevens-Johnson症候群)、多形紅斑(頻度不明)
11.1.6 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがある。
11.1.7 イレウス(頻度不明)
腸閉塞を含むイレウスを起こすおそれがある。高度の便秘、腹部膨満、持続する腹痛、嘔吐等の異常が認められた場合には投与を中止し、適切な処置を行うこと。[9.1.3参照]
11.1.8 間質性肺炎(頻度不明)
咳嗽、呼吸困難、発熱、肺音の異常(捻髪音)等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施すること。間質性肺炎が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.9 類天疱瘡(頻度不明)
水疱、びらん等があらわれた場合には、皮膚科医と相談し、投与を中止するなど適切な処置を行うこと。
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 過敏症 | 発疹、そう痒、じん麻疹 | |
| 消化器注1) | 胃腸障害、便秘 | 下痢、食欲不振、腹痛、悪心、嘔吐、腹部膨満感、鼓腸、消化不良、胃炎、胃腸炎、放屁増加 |
| 血液 | 貧血、白血球減少、血小板減少、白血球増加、好酸球増加 | |
| 肝臓 | 肝機能異常 | |
| 腎臓 | BUN上昇、クレアチニン上昇 | |
| 精神神経系 | 四肢のしびれ | |
| 代謝異常 | CK上昇、ケトーシス、乳酸上昇、血中カリウム上昇、血中尿酸増加 | |
| その他 | 倦怠感注1) | 頭痛、頭重、眠気、筋肉痛注1)、めまい・ふらつき、味覚異常、鼻咽頭炎、浮腫、発汗、脱力感、関節痛、動悸、空腹感、ビタミンB12減少注2) |
13. 過量投与
14. 適用上の注意
14.1 薬剤調製時の注意
本剤とオルメサルタン メドキソミル製剤等との一包化は避けること。一包化して高温高湿度条件下にて保存した場合、本剤が変色することがある。
14.2 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
インスリン又は経口血糖降下剤の投与中にアンジオテンシン変換酵素阻害剤を投与することにより、低血糖が起こりやすいとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人(32例)にアログリプチン/メトホルミン塩酸塩として25mg/500mg配合錠とアログリプチン25mg及びメトホルミン塩酸塩として500mg(単剤併用)をクロスオーバー法により絶食下で単回経口投与した時のアログリプチン及びメトホルミンの血漿中濃度推移及び薬物動態学的パラメータは以下のとおりであり、生物学的同等性が認められた3)。
アログリプチン及びメトホルミンの血漿中濃度推移
| Cmax(ng/mL) | Tmax(h) | AUC0-72(ng・h/mL) | T1/2(h) | |
| アログリプチン(配合錠) | 122.3(29.25) | 3.00(1.50,6.00) | 1,280.2(146.69) | 18.50(3.06) |
| アログリプチン(単剤併用) | 120.1(22.95) | 3.00(1.00,4.00) | 1,264.6(148.14) | 18.31(3.40) |
| Cmax(ng/mL) | Tmax(h) | AUC0-48(ng・h/mL) | T1/2(h) | |
| メトホルミン(配合錠) | 1,722.5(373.66) | 2.50(1.00,4.00) | 10,624.4(1,933.78) | 4.61(0.62) |
| メトホルミン(単剤併用) | 1,700.9(309.21) | 3.00(1.50,4.00) | 10,690.3(1,710.52) | 5.37(3.86) |
16.2 吸収
健康成人(12例)にアログリプチン/メトホルミン塩酸塩として25mg/500mg配合錠を絶食下又は朝食開始30分後に単回経口投与した時、アログリプチンのCmax、AUC0-infは絶食下投与と比較して食後投与でそれぞれ12.5%増加、1.4%減少し、メトホルミンのCmax、AUC0-infは絶食下投与と比較して食後投与でそれぞれ14.1%減少、1.8%減少した4)。
16.3 分布
[14C]アログリプチンを0.01〜10μg/mLの濃度でヒト血漿に添加した時の蛋白結合率は、28.2〜38.4%であった(in vitro)5)。
16.4 代謝
アログリプチンはCYP2D6によりN-脱メチル化体の活性代謝物M-Iに、また、N-アセチル化により非活性代謝物M-IIに代謝されるが、M-I及びM-IIのAUCはそれぞれ血漿中アログリプチンの1%未満及び6%未満であり、いずれも微量代謝物であった6)7)。
また、アログリプチンはCYP3A4/5に対して弱い阻害作用と弱い誘導作用を示したが、CYP1A2、CYP2C8、CYP2C9、CYP2C19、CYP2D6を阻害せず、CYP1A2、CYP2B6、CYP2C9、CYP2C19を誘導しなかった(in vitro)8)。
また、アログリプチンはCYP3A4/5に対して弱い阻害作用と弱い誘導作用を示したが、CYP1A2、CYP2C8、CYP2C9、CYP2C19、CYP2D6を阻害せず、CYP1A2、CYP2B6、CYP2C9、CYP2C19を誘導しなかった(in vitro)8)。
メトホルミンはヒト体内では代謝されず、また、チトクロームP450 1A2、2C8、2C9、2C19、2D6、2E1、3A4に影響を与えなかった(in vitro)9)。
16.5 排泄
健康成人(12例)にアログリプチン/メトホルミン塩酸塩として25mg/500mg配合錠を絶食下又は朝食開始30分後に単回経口投与した時、投与72時間後までのアログリプチンの累積尿中排泄率は、それぞれ73.7%、74.5%であった。また、投与48時間後までのメトホルミンの累積尿中排泄率は、それぞれ50.6%、50.1%であった4)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能の程度が異なる成人にアログリプチンとして50mgを単回経口投与した時注1)のAUCは、年齢と性別を対応させた健康成人と比較して、中等度腎機能障害者(Ccr=30〜50mL/min、6例)では2.1倍、高度腎機能障害者(Ccr<30mL/min、6例)では3.2倍、末期腎不全罹患者(6例)では3.8倍増加した。また、アログリプチンは血液透析3時間後に投与量の7.2%が除去された10)(外国人データ)。[5.4、9.2、9.8、13.2.2参照]
注1)本剤はアログリプチンとして25mg/メトホルミン塩酸塩500mgの配合剤である。
16.6.2 肝機能障害患者
中等度肝機能障害者(Child-Pugh注2)スコアが7〜9、8例)及び健康成人(8例)にアログリプチンとして25mgを単回経口投与した時、中等度肝機能障害者のCmax、AUCは、健康成人と比較してそれぞれ7.7%、10.1%減少した11)(外国人データ)。[9.8参照]
注2)ビリルビン、アルブミン、PT又はINR、肝性脳症、腹水症の状態からスコア化する分類
16.6.3 高齢者
16.7 薬物相互作用
16.7.1 アログリプチンとメトホルミン
健康成人(17例)にアログリプチンとして100mgを1日1回及びメトホルミン塩酸塩として1,000mgを1日2回6日間反復経口併用投与した時注1)(3×3クロスオーバー試験)、アログリプチンのCmax及びAUCに併用投与による影響はみられなかった。一方、メトホルミンのCmaxに影響はみられず、AUCは単独投与時に比較して18.9%増加した13)(外国人データ)。
注1)本剤はアログリプチンとして25mg/メトホルミン塩酸塩500mgの配合剤である。
16.7.2 アログリプチンとその他の薬剤
アログリプチンとピオグリタゾン(CYP2C8基質)、ゲムフィブロジル(CYP2C8、CYP2C9阻害剤)、フルコナゾール(CYP2C9阻害剤)、ケトコナゾール(CYP3A4阻害剤)、シクロスポリン(P-糖蛋白阻害剤)、カフェイン(CYP1A2基質)、ワルファリン(CYP1A2基質、CYP2C9基質、CYP3A4基質)、グリベンクラミド(CYP2C9基質)、トルブタミド(CYP2C9基質)、デキストロメトルファン(CYP2D6基質)、ミダゾラム(CYP3A4基質)、アトルバスタチン(CYP3A4基質)、エチニルエストラジオール(CYP3A4基質)、ノルエチンドロン(CYP3A4基質)、フェキソフェナジン(P-糖蛋白基質)、ジゴキシン(P-糖蛋白基質、腎排泄)又はシメチジン(腎排泄)、ボグリボース注3)との薬物間相互作用を検討したが、いずれも併用投与の影響はみられなかった14)15)16)17)18)19)20)21)22)23)24)(外国人データ)。
注3)ボグリボースのみ日本人データ
16.7.3 メトホルミンとその他の薬剤
(1)メトホルミンとシメチジン
健康成人(7例)にメトホルミン塩酸塩として250mgを1日1回及びシメチジンとして400mgを1日2回併用経口投与した時注1)、シメチジンの薬物動態には併用投与による影響がみられなかったが、メトホルミンのAUCが約50%増加した25)(外国人データ)。[10.2参照]
注1)本剤はアログリプチンとして25mg/メトホルミン塩酸塩500mgの配合剤である。
(2)メトホルミンとドルテグラビル
健康成人(30例)に対しメトホルミン塩酸塩とドルテグラビル50mg/日又は100mg/日を併用して反復経口投与した時注1)、メトホルミンのCmaxがそれぞれ66%及び111%上昇し、AUCがそれぞれ79%及び145%増加した26)。[10.2参照]
注1)本剤はアログリプチンとして25mg/メトホルミン塩酸塩500mgの配合剤である。
(3)メトホルミンとバンデタニブ
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II/III相検証試験(二重盲検比較試験)
食事療法、運動療法に加えてメトホルミン塩酸塩として250mgを1日2回又は3回を12週間経口投与するも血糖コントロールが不十分な2型糖尿病患者を対象にアログリプチンとして25mgを1日1回、12週間併用経口投与した二重盲検比較試験の結果は下表のとおりであった28)。
| 投与群 | HbA1c(NGSP値)(%) | |
| 投与前値注1) | 投与前からの変化量注2) | |
| メトホルミン塩酸塩単独投与(n=100) | 8.00(0.856) | 0.22(0.056) |
| アログリプチン25mg1日1回併用投与(n=96) | 8.02(0.732) | −0.64(0.057) |
| 投与前からの変化量の投与群間差注1) | HbA1c(NGSP値)(%) | ||
| 点推定値 | 両側95%信頼区間 | ||
| 下限 | 上限 | ||
| アログリプチン25mg1日1回併用投与−メトホルミン塩酸塩単独投与 | −0.86 | −1.015 | −0.702 |
治療期終了時(12週)のHbA1c変化量について、上述の共分散分析モデルを適用し、対比検定を行った結果、メトホルミン単独群に対し25mg併用群において有意な差がみられた(p<0.0001)。
副作用発現頻度は25mg併用群で8.3%(8/96)であり、低血糖の副作用はみられなかった。主な副作用は便秘3.1%(3/96)であった。[11.1.2参照]
副作用発現頻度は25mg併用群で8.3%(8/96)であり、低血糖の副作用はみられなかった。主な副作用は便秘3.1%(3/96)であった。[11.1.2参照]
17.1.2 国内第II/III相試験(長期継続投与試験)
アログリプチンとして25mgを1日1回、メトホルミン塩酸塩として250mgを1日2回又は3回、12週間併用経口投与した2型糖尿病患者を対象に、さらに、アログリプチンとして25mgを1日1回、メトホルミン塩酸塩として250mgを1日2回又は3回、40週間継続併用経口投与した非盲検試験の結果は下表のとおりであった29)。
| 投与群 | HbA1c(NGSP値)(%) | |
| 投与前値注1) | 投与前からの変化量注1) | |
| アログリプチン25mg1日1回、メトホルミン塩酸塩250mg1日2回又は3回併用投与(n=145) | 8.09(0.852) | −0.59(0.787) |
副作用発現頻度は25mg併用群で20.0%(29/145)であり、低血糖の副作用発現頻度は0.7%(1/145)であった。主な副作用は、便秘、肝機能異常が各2.8%(4/145)、血中乳酸増加、白血球数増加、血中尿酸増加が各2.1%(3/145)であった。[11.1.2参照]
17.1.3 国内第III相検証試験(二重盲検比較試験)
食事療法、運動療法に加えてアログリプチンとして25mgを1日1回12週間経口投与するも血糖コントロールが不十分な2型糖尿病患者を対象にメトホルミン塩酸塩として500mgを1日1回又は250mgを1日2回、24週間経口併用投与した二重盲検比較試験の結果は下表のとおりであった30)。
| 投与群 | HbA1c(NGSP値)(%) | |
| 投与前値注1) | 投与前からの変化量注2) | |
| アログリプチン単独投与(n=71) | 7.77(0.780) | 0.16(0.072) |
| メトホルミン塩酸塩500mg1日1回併用投与(n=152) | 7.82(0.820) | −0.49(0.049) |
| メトホルミン塩酸塩250mg1日2回併用投与(n=151) | 7.89(0.791) | −0.60(0.049) |
| 投与前からの変化量の投与群間差注1) | HbA1c(NGSP値)(%) | ||
| 点推定値 | 両側95%信頼区間 | ||
| 下限 | 上限 | ||
| メトホルミン塩酸塩500mg1日1回併用投与−アログリプチン単独投与 | −0.65 | −0.821 | −0.480 |
| メトホルミン塩酸塩500mg1日1回併用投与−メトホルミン塩酸塩250mg1日2回併用投与 | 0.11 | −0.026 | 0.247 |
治療期終了時(24週)のHbA1c変化量について、上述の共分散分析モデルを適用し、メトホルミン塩酸塩500mg 1日1回併用群とアログリプチン単独群の比較及びメトホルミン塩酸塩500mg 1日1回併用投与群とメトホルミン塩酸塩250mg 1日2回併用投与群の比較を行った結果、メトホルミン塩酸塩500mg 1日1回併用群のアログリプチン単独群に対する優越性及びメトホルミン塩酸塩500mg 1日1回併用投与群のメトホルミン塩酸塩250mg 1日2回併用投与群に対する非劣性(非劣性の許容限界値:0.30%)が検証された。
副作用発現頻度は、メトホルミン塩酸塩500mg 1日1回併用投与群で2.6%(4/152)であり、低血糖の副作用はみられなかった。[11.1.2参照]
副作用発現頻度は、メトホルミン塩酸塩500mg 1日1回併用投与群で2.6%(4/152)であり、低血糖の副作用はみられなかった。[11.1.2参照]
18. 薬効薬理
18.1 作用機序
<アログリプチン>
<メトホルミン>
メトホルミン塩酸塩は膵β細胞のインスリン分泌を介することなく血糖降下作用を示す。以下のものが血糖降下作用の主要な作用として提唱されている33)。
・肝での糖新生抑制
・末梢での糖利用促進
・腸管からのグルコース吸収抑制
18.2 DPP-4に対する阻害作用
18.2.1 アログリプチンはヒト血漿中DPP-4活性を選択的に阻害した(IC50値:10nmol/L)(in vitro)34)。
18.2.2 健康成人にアログリプチンとして25mgを単回経口投与した時、投与24時間後のDPP-4阻害率は81%であった35)。
18.3 活性型GLP-1濃度増加作用
食事療法、運動療法を実施するも血糖コントロールが不十分な2型糖尿病患者を対象にアログリプチンとして25mgを12週間経口投与(1日1回朝食前)したプラセボ対照二重盲検比較試験(用量設定試験)において、プラセボ投与群と比べて、活性型GLP-1濃度の有意な増加が認められた36)。
18.4 食後血糖改善作用及び耐糖能改善作用
18.4.1 食事療法、運動療法を実施するも血糖コントロールが不十分な2型糖尿病患者を対象にアログリプチンとして25mgを12週間経口投与(1日1回朝食前)したプラセボ対照二重盲検比較試験(用量設定試験)において、プラセボ投与群と比べて、食後血糖の改善が認められた36)。
18.4.2 一晩絶食した非肥満2型糖尿病モデル(N-STZ-1.5ラット)及び肥満2型糖尿病モデル(Wistar fattyラット)にアログリプチンを単回経口投与し、投与1時間後にグルコースを経口投与した糖負荷試験において、耐糖能改善作用が認められた37)。
18.5 血糖低下作用
19. 有効成分に関する理化学的知見
19.1. アログリプチン安息香酸塩
19.2. メトホルミン塩酸塩
22. 包装
PTP 100錠(10錠×10)
23. 主要文献
- Dubourg J,et al., Diabetes Obes Metab., 24 (4), 609-619, (2022) »PubMed
- Tuchmann-Duplessis H,et al., Compt Rend., 253, 321-323, (1961)
- アログリプチン/メトホルミン配合剤の薬物動態試験成績[1](2016年9月28日承認:CTD2.7.6.2)
- アログリプチン/メトホルミン配合剤の薬物動態試験成績[2](2016年9月28日承認:CTD2.7.6.1)
- アログリプチンの蛋白結合に関する検討(2010年4月16日承認:CTD2.7.2.2)
- アログリプチンの代謝に関する検討[1](2010年4月16日承認:CTD2.7.2.1)
- アログリプチンの代謝に関する検討[2](2010年4月16日承認:CTD2.7.2.2)
- アログリプチンの代謝に関する検討[3](2010年4月16日承認:CTD2.7.2.3)
- Study No.AE-4997-G,Final Report(Takeda Pharmaceutical Company Limited.社内資料)
- アログリプチンの腎機能障害患者における薬物動態試験成績(2010年4月16日承認:CTD2.7.6.14)
- アログリプチンの肝機能障害患者における薬物動態試験成績(2010年4月16日承認:CTD2.7.6.15)
- アログリプチンの高齢者における薬物動態試験成績(2010年4月16日承認:CTD2.7.6.13)
- アログリプチン/メトホルミン配合剤とメトホルミンとの薬物相互作用試験成績(2016年9月28日承認:CTD2.7.6.3)
- アログリプチンとピオグリタゾンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
- アログリプチンとボグリボースとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.3)
- アログリプチンとアトルバスタチンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
- アログリプチンとフルコナゾール、ケトコナゾール又はゲムフィブロジルとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
- アログリプチンとシクロスポリンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
- アログリプチンとカフェイン、トルブタミド、デキストロメトルファン、ミダゾラム及びフェキソフェナジンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
- アログリプチンとワルファリンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
- アログリプチンとエチニルエストラジオール及びノルエチンドロンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.2)
- アログリプチンとジゴキシンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.3)
- アログリプチンとグリベンクラミドとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.6.21)
- アログリプチンとシメチジンとの薬物相互作用試験成績(2010年4月16日承認:CTD2.7.2.3)
- Somogyi A,et al., Br J Clin Pharmacol., 23, 545-551, (1987) »PubMed
- Song I H,et al., J Acquir Immune Defic Syndr., 72, 400-407, (2016) »PubMed
- Johansson S,et al., Clin Pharmacokinet., 53, 837-847, (2014) »PubMed
- アログリプチン/メトホルミン配合剤の臨床試験成績[1](2016年9月28日承認:CTD2.7.6.5)
- アログリプチン/メトホルミン配合剤の臨床試験成績[2](2016年9月28日承認:CTD2.7.6.6)
- アログリプチン/メトホルミン配合剤の臨床試験成績[3](2016年9月28日承認:CTD2.7.6.4)
- アログリプチンの耐糖能改善作用に関する検討[1](2010年4月16日承認:CTD2.4.2)
- アログリプチンの耐糖能改善作用に関する検討[2](2010年4月16日承認:CTD2.6.2)
- Lee A J., Pharmacotherapy., 16, 327-351, (1996) »PubMed
- アログリプチンの酵素阻害活性に関する検討(2010年4月16日承認:CTD2.6.2.1)
- アログリプチンの薬物動態試験成績[1](2010年4月16日承認:CTD2.7.6.6)
- アログリプチンの薬物動態試験成績[2](2010年4月16日承認:CTD2.7.6.27)
- アログリプチンの耐糖能改善作用に関する検討[3](2010年4月16日承認:CTD2.6.2.2)
- Proske G,et al., Arzneimittel-Forsch., 12, 314-318, (1962) »PubMed
- Opitz K,et al., Deut Med Wochenschr., 87, 105-106, (1962)
- Sterne J., Therapie., 13, 650-659, (1958) »PubMed
- 小澤光 他, 日薬理誌, 67, 12-13, (1971)
- Kroneberg G,et al., Arzneimittel-Forsch., 8, 470-475, (1958) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
帝人ファーマ株式会社
メディカル情報グループ
〒100-8585
東京都千代田区霞が関3丁目2番1号
電話:フリーダイヤル 0120-189-315
製品情報問い合わせ先
帝人ファーマ株式会社
メディカル情報グループ
〒100-8585
東京都千代田区霞が関3丁目2番1号
電話:フリーダイヤル 0120-189-315
26. 製造販売業者等
26.1 製造販売元
帝人ファーマ株式会社
東京都千代田区霞が関3丁目2番1号
26.2 販売
武田薬品工業株式会社
〒540-8645
大阪市中央区道修町四丁目1番1号