医薬品情報
| 総称名 | リフキシマ |
|---|---|
| 一般名 | リファキシミン |
| 欧文一般名 | Rifaximin |
| 製剤名 | リファキシミン製剤 |
| 薬効分類名 | 難吸収性リファマイシン系抗菌薬 |
| 薬効分類番号 | 6199 |
| ATCコード | A07AA11 D06AX11 |
| KEGG DRUG |
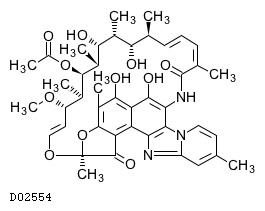
D02554
リファキシミン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年3月 改訂(用法用量変更)(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| リフキシマ錠200mg | RIFXIMA TABLETS | あすか製薬 | 6199001F1026 | 235.1円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
肝性脳症における高アンモニア血症の改善
5. 効能または効果に関連する注意
本剤は抗酸菌に対しても抗菌活性を示し、他のリファマイシン系抗菌薬と交差耐性を示す可能性がある。他のリファマイシン系抗菌薬に対する結核菌の耐性化を防ぐため、肺結核及びその他の結核症を合併している肝性脳症患者における高アンモニア血症に対しては、他の治療法を選択すること。
6. 用法及び用量
通常、成人及び小児にはリファキシミンとして1回400mgを1日3回食後に経口投与する。
7. 用法及び用量に関連する注意
国内臨床試験において、本剤の12週間を超える使用経験はないため、12週間を超えて投与する際はその必要性を慎重に判断すること。
8. 重要な基本的注意
本剤は難吸収性製剤であるが、耐性菌の発現等を防ぐため、治療に際しては効果を十分に確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
9.3.1 重度の肝機能障害患者
本剤は主に肝で代謝されるため、AUCが増大することがある。[16.1.2参照]
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
動物実験(ラット)で乳汁中に移行することが報告されている5)。
動物実験(ラット)で乳汁中に移行することが報告されている5)。
9.7 小児等
9.7.1 本剤を適切に経口投与できると判断された場合にのみ投与すること。
9.7.2 5歳未満の患者に投与する場合には、観察を十分に行い、慎重に投与すること。これらの患者に投与した臨床試験は実施していない。
10. 相互作用
相互作用序文
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
P-糖タンパク(P-gp)
薬物代謝酵素用語
有機アニオン輸送ポリペプチド1A2(OATP1A2)
薬物代謝酵素用語
OATP1B1
薬物代謝酵素用語
OATP1B3
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 偽膜性大腸炎(クロストリディオイデス・ディフィシル関連下痢症)(頻度不明)
腹痛、頻回な下痢があらわれた場合には、直ちに投与を中止するなど適切な処置を行うこと。
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | |
| 過敏症 | 発疹、湿疹 | |
| 消化器 | 便秘、下痢、悪心、腹痛 | 上腹部痛、腹部不快感、痔出血 |
| 肝臓 | 高ビリルビン血症 | ALP上昇 |
| 精神神経系 | めまい、味覚異常、肝性脳症の悪化、頭蓋内動脈瘤 | |
| 循環器 | 高血圧、動悸 | |
| その他 | 声帯の炎症、敗血症、背部痛、発熱、尿中血陽性 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
本剤の投与により、尿が橙赤色となることがある。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人
健康成人男性に、本剤550mg、1,100mg及び1,650mgを空腹時単回投与した結果、最大血漿中濃度到達時間及び血漿中半減期等の薬物動態パラメータは以下のとおりであった6)。
注)本剤の承認された用法及び用量は、リファキシミンとして1回400mgを1日3回食後に経口投与である。
| 投与量 | 例数 | AUC0-∞(ng・hr/mL) | Cmax(ng/mL) | Tmaxa)(hr) | t1/2(hr) |
| 550mg | 8 | 11.32±5.32 | 3.055±1.631 | 1.0(0.5-1.5) | 4.21±2.12 |
| 1,100mg | 8 | 29.47±12.87b) | 7.09±4.25 | 1.5(0.5-4) | 4.73±1.53b) |
| 1,650mg | 8 | 16.08±3.52 | 5.521±2.746 | 0.8(0.5-4) | 4.20±1.56 |
16.1.2 肝性脳症患者
16.1.3 小児肝性脳症患者
日本人小児肝性脳症患者21例に、本剤400mgを1日3回12週間投与し、得られた103点の血漿中薬物濃度データを用いて母集団薬物動態解析を行った。その結果、薬物動態に影響を及ぼす共変量はなく、1回400mgを1日3回投与したときの定常状態のシミュレーションにより推定された1日のうちの1回目投与時の薬物動態パラメータは以下のとおりであった8)。
| 例数 | AUC0-4(ng・hr/mL) | Cmax(ng/mL) | Tmaxa)(hr) |
| 21 | 75.7±33.7 | 21.4±9.5 | 2.0(1.8-2.0) |
16.2 吸収
16.2.1 食事の影響
健康成人男性8例に、本剤550mgを食後(高脂肪食:900kcal以上、脂質35%以上)又は空腹時に投与した結果、Cmaxは同様であったが、食後投与で吸収(Tmax)が遅延し(空腹時:1.0時間、食後:3.0時間)、AUC0-∞が58.1%増加した。本検討は本剤とは異なる製剤(275mg錠)にて実施した6)。
注)本剤の承認された用法及び用量は、リファキシミンとして1回400mgを1日3回食後に経口投与である。
16.3 分布
健康被験者及び肝性脳症の既往がある肝機能障害患者に本剤550mgを反復経口投与した後のリファキシミンの血漿タンパク結合率は健康被験者で67.5±3.7%、肝機能障害患者で62.0±4.4%であった9)(外国人データ)。
注)本剤の承認された用法及び用量は、リファキシミンとして1回400mgを1日3回食後に経口投与である。
16.4 代謝
16.5 排泄
16.5.1 健康被験者へ14C標識した本剤400mgを単回経口投与した場合、総放射能の回収率は96.94%であった。そのうち、96.62%が糞便中からほぼ未変化体として回収され、0.32%は経口投与後48時間以内に尿中から回収された13)(外国人データ)。
16.5.2 肝性脳症患者に本剤600mg/日、1,200mg/日及び2,400mg/日を7日間反復経口投与した場合、最終投与後24時間までの尿中未変化体排泄率は投与量の0.06〜0.1%であった14)(外国人データ)。
注)本剤の承認された用法及び用量は、リファキシミンとして1回400mgを1日3回食後に経口投与である。
16.7 薬物相互作用
16.7.1 in vitro試験成績
16.7.2 リファキシミンの薬物動態に及ぼす併用薬の影響
16.7.3 併用薬の薬物動態に及ぼすリファキシミンの影響
| 併用薬 | 併用薬の投与量 | 本剤の投与量 | 例数 | 併用薬の薬物動態パラメータ比 (併用時/単独投与時) [90%信頼区間] | |
| AUC | Cmax | ||||
| ミダゾラム21) (外国人データ) | 2mg 単回 | 550mg TID | 24 | 0.913 [0.750〜1.11] | 0.948 [0.800〜1.12] |
| 経口避妊薬22) エチニルエストラジオール(EE)・ノルゲスチメート(NGM) (外国人データ) [10.2参照] | EE:0.025mg単回 NGM:0.25mg単回 | 550mg TID | 39 | エチニルエストラジオール | |
| 1.02 [0.915〜1.13] | 0.753 [0.671〜0.843] | ||||
| 17-デアセチルノルゲスチメートa) | |||||
| 0.930 [0.856〜1.01] | 0.869 [0.784〜0.963] | ||||
| ノルゲストレルa) | |||||
| 0.890 [0.747〜1.06] | 0.858 [0.744〜0.988] | ||||
注)本剤の承認された用法及び用量は、リファキシミンとして1回400mgを1日3回食後に経口投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内II/III相試験(成人)
肝性脳症患者を対象とし、ラクチトールを対照とした無作為化並行群間比較試験(評価者盲検)を実施した(本剤の用法・用量は、本剤400mgを1日3回14日間食後経口投与)。血中アンモニア濃度、PSE指数及び肝性脳症昏睡度の変化は以下のとおりであった7)。
| 本剤群 | ラクチトール群 | ||
| 血中アンモニア濃度(μg/dL) | ベースライン | 134.89±49.24(84) | 136.44±42.72(87) |
| 最終評価時 | 119.46±59.45(81) | 125.40±56.63(85) | |
| PSE指数a) | ベースライン | 0.33±0.11(84) | 0.33±0.10(87) |
| 最終評価時 | 0.20±0.14(80) | 0.23±0.17(84) | |
| 肝性脳症昏睡度b) | ベースライン | 1.2±0.4(84) | 1.2±0.4(87) |
| 最終評価時 | 0.6±0.6(80) | 0.6±0.7(84) | |
17.1.2 国内第II/III相試験(小児)
18歳未満の小児肝性脳症患者[肝硬変、胆道閉鎖症、門脈圧亢進症(バンチ症候群を含む)、先天性門脈欠損症(門脈大循環短絡を含む)、Wilson病、尿素サイクル異常症(慢性期)、リジン尿性蛋白不耐症のいずれかを有する者]を対象とし、非対照非盲検試験を実施した(本剤の用法・用量は、本剤400mgを1日3回12週間経口投与)。5歳以上の患者が組み入れられ、血中アンモニア濃度及び肝性脳症昏睡度の変化は以下のとおりであった24)
| 血中アンモニア濃度(μg/dL) | ベースライン | 96.99±33.40(20) |
| 最終評価時 | 86.04±30.82(20) | |
| 肝性脳症昏睡度a) | ベースライン | 0.70±0.25(20) |
| 最終評価時 | 0.45±0.32(20) |
国内第II/III相試験(小児)において本剤を投与した21例中3例(14.3%)に副作用が認められた。発現した副作用は、腹痛、悪心、血中ビリルビン増加各1例(4.8%)であった。
18. 薬効薬理
18.1 作用機序
リファキシミンは、細菌のDNA依存性RNAポリメラーゼに結合し、RNA合成を阻害することが示唆されている25)。
18.2 抗菌活性
18.3 血中アンモニア濃度抑制作用
ラット肝性脳症モデルにおいて、リファキシミンは昏睡の発症及び静脈血中アンモニア濃度を用量依存的に抑制した28)。
18.4 耐性
19. 有効成分に関する理化学的知見
19.1. リファキシミン
20. 取扱い上の注意
開封後は湿気、光を避けて保存すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
100錠[10錠(PTP)×10]
100錠[瓶、バラ、乾燥剤入り]
500錠[10錠(PTP)×50]
23. 主要文献
- 社内資料:妊娠ラットに14C標識リファキシミンを経口投与後の胎盤通過性(2016年9月28日承認、CTD2.6.4.4.3)
- 社内資料:ウサギにリファキシミンを反復経口投与後の胎盤通過性試験(2016年9月28日承認、CTD2.6.4.4.4)
- 社内資料:ラットを用いた受胎能及び胚・胎児発生毒性に関する試験(2016年9月28日承認、CTD2.6.6.6.3)
- 社内資料:ウサギを用いた胚・胎児発生毒性試験(2016年9月28日承認、CTD2.6.6.6.5)
- 社内資料:ラットに14C標識リファキシミンを単回経口投与した時の乳汁移行性(2016年9月28日承認、CTD2.6.4.6.4)
- 社内資料:国内薬物動態試験、健康成人男性単回投与(2016年9月28日承認、CTD2.7.6.2.1)
- 社内資料:国内第II/III相臨床試験(2016年9月28日承認、CTD2.7.6.3.1)
- 社内資料:小児国内第II/III相臨床試験 母集団薬物動態解析報告書(2024年3月26日承認、CTD2.7.2.2.1)
- 社内資料:限外ろ過法によるリファキシミンのヒト血漿中タンパク結合(2016年9月28日承認、CTD2.6.4.4.2)
- 社内資料:ヒト肝ミクロソームにおけるリファキシミンのCYP代謝酵素の同定(2016年9月28日承認、CTD2.6.4.5.1(3),(4))
- 社内資料:ヒト初代培養肝細胞におけるリファキシミン及びリファンピシンの酵素誘導能評価(2016年9月28日承認、CTD2.6.4.5.3(2))
- 社内資料:ヒト肝ミクロソームにおけるリファキシミンによるCYP代謝酵素に対する阻害試験(2016年9月28日承認、CTD2.6.4.5.3(1))
- 社内資料:海外薬物動態試験:健康被験者男性、14C標識リファキシミン単回経口投与、血漿中濃度、代謝及び排泄(2016年9月28日承認、CTD2.7.6.2.5)
- 社内資料:海外臨床試験:肝性脳症患者、多施設二重盲検用量設定試験(2016年9月28日承認、CTD2.7.6.3.3)
- 社内資料:Caco-2細胞を用いたP-糖タンパク質に対するリファキシミンの基質特異性及び阻害能評価(2016年9月28日承認、CTD2.6.4.7.1、2.6.4.7.2)
- 社内資料:OATP1A2、OATP1B1、OATP1B3及びOATP2B1に対するリファキシミンの基質特異性及び阻害能評価(2016年9月28日承認、CTD2.6.4.7.4)
- 社内資料:排出トランスポーター:ヒトP-糖タンパク質におけるリファキシミンの相互作用試験(2016年9月28日承認、CTD2.6.4.7.2)
- 社内資料:排出トランスポーター:ヒトP-糖タンパク質、MRP2、MRP4及びBCRPを用いたリファキシミンの相互作用試験(2016年9月28日承認、CTD2.6.4.7.3)
- 社内資料:排出トランスポーター:ヒトBSEPにおけるリファキシミン及びリファンピシンの相互作用試験(2016年9月28日承認、CTD2.6.4.7.3)
- 社内資料:海外薬物動態試験:健康被験者、本剤550mg単回投与、シクロスポリンとの薬物相互作用(2016年9月28日承認、CTD2.7.6.3.8)
- 社内資料:海外薬物動態試験:健康被験者、本剤550mg反復投与、ミダゾラムとの薬物相互作用(2016年9月28日承認、CTD2.7.6.3.4)
- 社内資料:海外薬物動態試験:健康女性、本剤550mg反復投与、経口避妊薬との薬物相互作用(2016年9月28日承認、CTD2.7.6.3.6)
- 社内資料:国内第III相臨床試験(2016年9月28日承認、CTD2.7.6.4.4)
- 社内資料:小児国内第II/III相臨床試験(2024年3月26日承認、CTD2.7.3.2.1)
- 社内資料:細菌におけるリファキシミンのRNA合成阻害(2016年9月28日承認、CTD2.6.2.2.1(1))
- Hoover,W.W.et al., Diagn.Microbiol.Infect.Dis., 16 (2), 111-118, (1993) »PubMed
- Sierra,J.M.et al., Antimicrob.Agents Chemother., 45 (2), 643-644, (2001) »PubMed
- Tamaoki,S.et al., Eur.J.Pharmacol., 779, 168-176, (2016) »PubMed
- Vitali,B.et al., Res.Microbiol., 158 (4), 355-362, (2007) »PubMed
- Telenti,A.et al., Lancet., 341 (8846), 647-650, (1993) »PubMed
- Lucchesi,M.et al., Chemioterapia., 3 (6), 371-372, (1984) »PubMed
- Malvisi Stracciari,J.et al., Chemioterapia., 6 (2), 82-84, (1987) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
あすか製薬株式会社
くすり相談室
〒108-8532
東京都港区芝浦二丁目5番1号
電話:0120-848-339
FAX:03-5484-8358
製品情報問い合わせ先
あすか製薬株式会社
くすり相談室
〒108-8532
東京都港区芝浦二丁目5番1号
電話:0120-848-339
FAX:03-5484-8358
26. 製造販売業者等
26.1 製造販売元
あすか製薬株式会社
東京都港区芝浦二丁目5番1号
26.2 販売元
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号
26.3 提携先
Alfasigma S.p.A.