医薬品情報
| 総称名 | テクフィデラ |
|---|---|
| 一般名 | フマル酸ジメチル |
| 欧文一般名 | Dimethyl Fumarate |
| 製剤名 | フマル酸ジメチル |
| 薬効分類名 | 多発性硬化症治療剤 |
| 薬効分類番号 | 1190 |
| ATCコード | L04AX07 |
| KEGG DRUG |
D03846
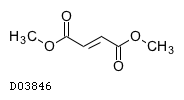
フマル酸ジメチル
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年11月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| テクフィデラカプセル120mg | Tecfidera capsules | バイオジェン・ジャパン | 1190024M1028 | 2061.7円/カプセル | 処方箋医薬品注) |
| テクフィデラカプセル240mg | Tecfidera capsules | バイオジェン・ジャパン | 1190024M2024 | 4132円/カプセル | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
多発性硬化症の再発予防及び身体的障害の進行抑制
5. 効能または効果に関連する注意
進行型多発性硬化症に関する本剤の有効性及び安全性は確立していない。
6. 用法及び用量
通常、成人にはフマル酸ジメチルとして1回120mg1日2回から投与を開始し、1週間後に1回240mg1日2回に増量する。なお、いずれの場合も朝・夕食後に経口投与する。
7. 用法及び用量に関連する注意
本剤の主な副作用である潮紅、消化器系副作用等が認められた場合には、患者の状態を慎重に観察しながら1ヵ月程度の期間1回120mg1日2回投与に減量することができる。
なお、1回240mg1日2回投与への再増量に対して忍容性が認められない場合は、本剤の投与を中止すること。
なお、1回240mg1日2回投与への再増量に対して忍容性が認められない場合は、本剤の投与を中止すること。
8. 重要な基本的注意
8.1 本剤の投与によりリンパ球数が減少することがある。また、本剤の投与により、進行性多巣性白質脳症(PML)があらわれ、重度の障害に至った例が報告されているため、本剤の投与開始前、投与中及び投与中止後は以下の点に注意すること。[9.1.1、11.1.1、11.1.2参照]
8.1.1 PMLが報告された症例の多くでは、6ヵ月以上継続するリンパ球数の減少が報告されている。本剤投与開始前及び本剤投与中は少なくとも3ヵ月に1回、リンパ球を含む全血球数の測定を行うこと。
8.1.2 リンパ球数が6ヵ月以上継続して500/mm3未満である場合は、本剤の投与中止を考慮すること。また、リンパ球数が6ヵ月以上継続して800/mm3未満である場合には、治療上の有益性と危険性を慎重に考慮して投与継続の可否を判断すること。
8.1.3 本剤の投与を中止したときは、リンパ球数が回復するまで患者の状態を慎重に観察すること。
8.2 腎機能異常があらわれることがあるので、本剤投与開始前に腎機能検査を行うとともに、本剤投与中は定期的に腎機能検査を行うこと。[11.1.4参照]
8.3 本剤投与後に嘔吐、下痢等を発現して脱水状態となった患者において、急性腎不全に至った例が報告されているので、嘔吐又は下痢がみられた場合には、観察を十分に行い、適切な処置を行うこと。[11.1.4参照]
8.4 肝機能異常があらわれることがあるので、本剤投与開始前に肝機能検査を行うとともに、本剤投与中は定期的に肝機能検査を行うこと。[11.1.5参照]
8.5 本剤投与に関連したアナフィラキシー(呼吸困難、蕁麻疹及び喉・舌の腫脹等)があらわれることがある。また、本剤投与時には潮紅が高頻度で認められるため、潮紅があらわれた場合は、アナフィラキシーとの鑑別を慎重に行うこと。[11.1.6参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 リンパ球減少のある患者
9.1.2 感染症を合併している患者又は感染症が疑われる患者
感染症が増悪するおそれがある。[11.1.3参照]
9.1.3 易感染性の状態にある患者
感染症が誘発されるおそれがある。[11.1.3参照]
9.2 腎機能障害患者
9.2.1 重度の腎機能障害のある患者
血中濃度が上昇するおそれがある。
9.3 肝機能障害患者
9.3.1 重度の肝機能障害のある患者
血中濃度が上昇するおそれがある。
9.5 妊婦
妊娠又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合のみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト乳汁中への移行は不明である。
9.7 小児等
臨床試験において除外され、十分なデータがない。
9.8 高齢者
患者の状態を十分に観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| 抗腫瘍剤、免疫抑制剤 | 免疫系の相加的な抑制作用により、感染症等のリスクが増大する可能性がある。 | 本剤は免疫系に抑制的に作用する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.2 進行性多巣性白質脳症(PML)(頻度不明)
11.1.3 感染症(頻度不明)
11.1.4 急性腎不全(頻度不明)
11.1.5 肝機能障害(頻度不明)
AST、ALTの上昇等を伴う肝機能障害があらわれることがある。[8.4参照]
11.1.6 アナフィラキシー(頻度不明)[8.5参照]
11.2 その他の副作用
| 10%以上 | 1%以上10%未満 | 頻度不明 | |
| 感染症および寄生虫症 | 胃腸炎 | ||
| 過敏症 | 蕁麻疹、血管浮腫、呼吸困難 | ||
| 神経系障害 | 灼熱感 | ||
| 血管障害 | 潮紅(22%) | ほてり | |
| 呼吸器、胸郭および縦隔障害 | 鼻漏 | ||
| 胃腸障害 | 下痢、悪心 | 上腹部痛、腹痛、嘔吐、消化不良、胃炎、胃腸障害 | |
| 皮膚および皮下組織障害 | そう痒症、発疹、紅斑 | 脱毛症 | |
| 腎および尿路障害 | 蛋白尿 | ||
| 一般・全身障害および投与部位の状態 | 熱感 | ||
| 臨床検査 | 尿中アルブミン陽性、アスパラギン酸アミノトランスフェラーゼ増加、アラニンアミノトランスフェラーゼ増加、白血球数減少 | 総ビリルビン増加 |
13. 過量投与
過量投与時に発現した症状は、潮紅、悪心、腹痛である。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。
PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。
PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。
14.1.2 カプセル内容物に腸溶性コーティングを施しているため、服用時にはカプセル内容物を噛んだり、砕いたり、すりつぶしたりしないよう指導すること。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 2年間反復経口投与がん原性試験において、マウスでは200mg/kg/日以上(ヒト曝露量(AUC)の4倍)、ラットでは100mg/kg/日以上(ヒト曝露量(AUC)の2倍)で、腎臓に尿細管腺腫及び尿細管癌の発生頻度の増加が認められた。
15.2.2 マウスを用いたがん原性試験において200mg/kg/日以上(ヒト曝露量(AUC)の4倍)で網膜変性が認められた。なお、マウス、ラット又はイヌを用いた他の試験ではこのような眼の所見は認められなかった。
16. 薬物動態
16.1 血中濃度
経口投与後、フマル酸ジメチルは全身循環前にエステラーゼにより急速に加水分解され、活性代謝物であるフマル酸モノメチルに代謝される。経口投与後の血漿中フマル酸ジメチルは測定不可能であり、薬物動態の検討は血漿中フマル酸モノメチル濃度に基づく。
16.1.1 健康成人
健康成人にフマル酸ジメチル120mgまたは240mgを1日2回食後に経口投与したとき、血漿中フマル酸モノメチル濃度推移並びに薬物動態パラメータは以下の図16-1及び表16-1のとおりであった(日本人における成績)。
図16-1 日本人における1回120mg及び240mg1日2回投与時の血漿中フマル酸モノメチル濃度推移(平均値±標準誤差、片対数軸)
| フマル酸モノメチル 薬物動態パラメータ 「平均値±標準偏差」注1) | 日本人 | |
| 120mg×1日2回 | 240mg×1日2回 | |
| 12例 | 12例 | |
| AUC0-24hr(時間・ng/mL) | 4915±981 | 8235±2911 |
| Cmax(ng/mL) | 1347±638 | 2366±1353 |
| Tmax(時間) | 4.00 | 5.00 |
| t1/2(時間) | 0.86±0.85 | 0.66±0.22 |
16.1.2 健康成人
健康成人にフマル酸ジメチル120mg、240mgまたは360mgを食後に単回経口投与したとき、血漿中フマル酸モノメチルのCmaxとAUCはほぼ線形性を示した(外国人における成績)。
16.1.3 多発性硬化症
多発性硬化症患者にフマル酸ジメチル240mgを1日2回食後に経口投与したとき、血漿中フマル酸モノメチル薬物動態パラメータは表16-2のとおりであった(外国人における成績)。
| フマル酸モノメチル 薬物動態パラメータ 「平均値±標準偏差」注2) | 240mg×1日2回 |
| 22例 | |
| AUC0-24hr(時間・ng/mL) | 8205±3464 |
| Cmax(ng/mL) | 1868±1250 |
| Tmax(時間) | 5.00 |
| t1/2(時間) | 1.30±0.80 |
16.2 吸収
健康成人にフマル酸ジメチル240mgを空腹時又は食後に経口投与したとき、低脂肪食の摂取は血漿中フマル酸モノメチルのAUCとCmaxに影響を与えなかった。高脂肪食の摂取は血漿中フマル酸モノメチルのAUCに影響を与えなかったが、Cmaxは38%低下した(外国人における成績)。
16.3 分布
フマル酸ジメチル240mg経口投与後のフマル酸モノメチルの見かけの分布容積は60〜90Lである。フマル酸モノメチルの血漿蛋白結合率は27〜40%である。
16.4 代謝
フマル酸ジメチルは消化管、血液及び組織に広く存在するエステラーゼにより代謝される。さらにTCA回路を介して代謝され、チトクロームP450(CYP)分子種はフマル酸ジメチル及びフマル酸モノメチルの代謝に関与しない。14C-フマル酸ジメチル240mg経口投与により同定された血漿中の主要代謝物はフマル酸モノメチル、フマル酸、クエン酸及びグルコースであり、フマル酸とクエン酸はさらにTCA回路を介して代謝される。
16.5 排泄
健康成人に14C-フマル酸ジメチル240mgを単回経口投与したとき、投与7日後までに投与放射能の約60%が呼気(CO2)として排泄され、さらに15.5%が尿中に、0.9%が糞中に排泄された。尿中に排泄された主な代謝物はコハク酸モノメチルのシステイン抱合体(投与放射能の4.64%)、コハク酸モノメチルのN-アセチルシステイン抱合体(投与放射能の1.77%)であった(外国人における成績)。
16.7 薬物相互作用
16.7.1 インターフェロン ベータ-1a
健康成人にフマル酸ジメチル(1回240mg1日3回経口投与)とインターフェロン ベータ-1a(30μg単回筋肉内投与)を併用投与したとき、インターフェロン ベータ-1aはフマル酸ジメチルの薬物動態に影響を与えなかった3)(外国人データ)。
16.7.2 グラチラマー酢酸塩
健康成人にフマル酸ジメチル(1回240mg1日3回経口投与)とグラチラマー酢酸塩(20mg単回皮下投与)を併用投与したとき、グラチラマー酢酸塩はフマル酸ジメチルの薬物動態に影響を与えなかった4)(外国人データ)。
16.7.3 経口避妊薬(エチニルエストラジオール−ノルゲスティメート:国内未承認)
経口避妊薬(1日1回経口投与)が投与されている健康成人女性にフマル酸ジメチル(1回240mg1日2回経口投与)を21日間併用したとき、フマル酸ジメチルはエチニルエストラジオール及びノルエルゲストロミン(ノルゲスティメートの主要代謝物)の薬物動態に影響を与えなかった5)(外国人データ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 日本を含む国際共同第III相臨床試験6)
(1)プラセボ対照試験
再発寛解型多発性硬化症患者(224例、日本人患者113例(投与例数))を対象としてプラセボ対照無作為化二重盲検並行群間比較試験を実施した。被験者にはプラセボ又はフマル酸ジメチル240mg/回を1日2回、24週間投与した。頭部MRI検査の結果、投与12、16、20及び24週目の新規Gd造影病巣数は表17-1のとおりであり、プラセボ群と比較し有意な減少が認められた。
| 投与群 | 評価例数 | Gd造影病巣数 | 病巣総数の比注1) [95%信頼区間] | p値注1) | |
| 平均値±標準偏差中央値(最小値,最大値) | 点推定値注1) | ||||
| プラセボ群 | 113 | 4.3±8.20 1(0,55) | 3.257 | 0.164 [0.101,0.266] | <0.0001 |
| 本剤群 | 111 | 1.1±5.46 0(0,55) | 0.534 | ||
本剤1回240mg1日2回を投与された111例中62例(55.9%)に副作用が認められた。主な副作用は潮紅(20.7%)、下痢(9.0%)、腹痛(6.3%)、悪心(6.3%)、ほてり(5.4%)、そう痒症(5.4%)、アラニンアミノトランスフェラーゼ増加(5.4%)であった。
(2)長期投与試験
プラセボ対照試験を完了した患者(213例、日本人患者106例(投与例数))を対象にした継続長期投与試験を実施した。フマル酸ジメチル240mg/回を1日2回投与したとき、長期投与試験のベースラインと投与24週目のGd造影病巣数を表17-2に示す。
| フマル酸ジメチル−フマル酸ジメチル群 | プラセボ−フマル酸ジメチル群 | |||
| ベースライン | 24週目 | ベースライン | 24週目 | |
| Gd造影病巣数 | 0.2±0.5(98) 0(0,3) | 0.3±1.2(101) 0(0,8) | 1.5±3.5(94) 0(0,22) | 0.4±1.0(95) 0(0,6) |
17.1.2 海外第III相臨床試験[1]7)
外国人再発寛解型多発性硬化症患者(1234例(投与例数))を対象としてプラセボ対照無作為化二重盲検並行群間比較試験を実施した。被験者にはプラセボ又はフマル酸ジメチル240mg/回を1日2回又は3回(480mg/日又は720mg/日)、2年間投与した。主要評価項目である2年時点での再発患者の割合を表17-3、再発までの期間を図17-1に示す。フマル酸ジメチル480mg/日群ではプラセボ群と比較して49%減少した(p<0.0001)。また、EDSSを用いて評価した「3ヵ月間持続する身体機能障害の進行が認められた患者の割合」を表17-4に示す。2年時点でプラセボ群と比較してフマル酸ジメチル480mg/日群で38%減少した(p=0.005)。
| 投与群 | 評価例数 | 再発例数 | 再発例の割合注2) | プラセボ群との比較注3) | |
| ハザード比[95%信頼区間] | p値 | ||||
| プラセボ群 | 408 | 171 | 0.461 | / | / |
| 本剤480mg/日群 | 410 | 98 | 0.270 | 0.51[0.40,0.66] | <0.0001 |
| 本剤720mg/日群 | 416 | 95 | 0.260 | 0.50[0.39,0.65] | <0.0001 |
| 投与群 | 評価例数注4) | 障害進行例数 | 障害進行例の割合注5) | プラセボ群との比較注6) | |
| ハザード比[95%信頼区間] | p値 | ||||
| プラセボ群 | 408 | 89 | 0.271 | / | / |
| 本剤480mg/日群 | 409 | 57 | 0.164 | 0.62[0.44,0.87] | 0.0050 |
| 本剤720mg/日群 | 416 | 62 | 0.177 | 0.66[0.48,0.92] | 0.0128 |
図17-1 再発までの期間
17.1.3 海外第III相臨床試験[2]8)
外国人再発寛解型多発性硬化症患者(1417例(投与例数))を対象としてプラセボ対照無作為化二重盲検並行群間比較試験を実施した。被験者にはプラセボ又はフマル酸ジメチル240mg/回を1日2回又は3回(480mg/日又は720mg/日)若しくはグラチラマー酢酸塩を1日1回、2年間投与した。主要評価項目である2年時点での年率換算再発率を表17-5に示す。フマル酸ジメチル480mg/日群ではプラセボ群と比較して44%減少した(p<0.0001)。EDSSを用いて評価した「3ヵ月間持続する身体的機能障害の進行が認められた患者の割合」を表17-6に示す。2年時点でプラセボ群と比較してフマル酸ジメチル480mg/日群で21%減少したが、プラセボ群との統計学的な有意差は認められなかった(p=0.25)。
| 投与群 | 評価例数 | 年間再発率注7)[95%信頼区間] | プラセボ群との比較注7) | |
| 群間比[95%信頼区間] | p値 | |||
| プラセボ群 | 363 | 0.401[0.329,0.488] | / | / |
| 本剤480mg/日群 | 359 | 0.224[0.179,0.282] | 0.560[0.423,0.740] | <0.0001 |
| 本剤720mg/日群 | 345 | 0.198[0.156,0.252] | 0.495[0.369,0.662] | <0.0001 |
| グラチラマー群 | 350 | 0.286[0.232,0.353] | 0.714[0.548,0.931] | 0.0128 |
| 投与群 | 評価例数 | 障害進行例数 | 障害進行例の割合注8) | プラセボ群との比較注9) | |
| ハザード比[95%信頼区間] | p値 | ||||
| プラセボ群 | 363 | 52 | 0.169 | / | / |
| 本剤480mg/日群 | 359 | 40 | 0.128 | 0.79[0.52,1.19] | 0.2536 |
| 本剤720mg/日群 | 345 | 38 | 0.130 | 0.76[0.50,1.16] | 0.2041 |
| グラチラマー群 | 350 | 48 | 0.156 | 0.93[0.63,1.37] | 0.7036 |
本剤1回240mg1日2回を投与された769例中536例(69.7%)に副作用が認められた。主な副作用は潮紅(32.9%)、悪心(9.5%)、下痢(8.3%)、上腹部痛(8.1%)、そう痒症(6.8%)、腹痛(6.2%)、ほてり(5.7%)、発疹(5.3%)であった。
18. 薬効薬理
18.1 作用機序
18.1.1 Nrf2抗酸化応答経路の活性化
18.1.2 抗炎症作用
In vitro試験においてフマル酸ジメチル及びその主要な活性代謝物であるフマル酸モノメチルは、炎症性刺激に対する免疫細胞の活性化及びその後の炎症性サイトカイン産生の抑制を示した11)。
18.2 実験的自己免疫性脳脊髄炎(EAE)
多発性硬化症動物モデルであるラットの慢性EAEにフマル酸ジメチルを経口投与すると、臨床症状軽減作用を示した9)。
19. 有効成分に関する理化学的知見
19.1. フマル酸ジメチル
20. 取扱い上の注意
開封後、直射日光及び高温・高湿を避けて保存すること。
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 製造販売後、一定数の症例にかかるデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
<テクフィデラカプセル120mg>
14カプセル〔14カプセル(PTP)×1〕
<テクフィデラカプセル240mg>
28カプセル〔14カプセル(PTP)×2〕
23. 主要文献
- 社内資料:フマル酸ジメチルの日本人を含む薬物動態試験成績(2016年12月19日承認、CTD2.7.6.3.3.1)
- 社内資料:フマル酸ジメチルの薬物動態試験成績(2016年12月19日承認、CTD2.7.6.3.2.1)
- 社内資料:インターフェロン ベータ-1aとの薬物相互作用試験成績(2016年12月19日承認、CTD2.7.6.3.4.1)
- 社内資料:グラチラマー酢酸塩との薬物相互作用試験成績(2016年12月19日承認、CTD2.7.6.3.4.2)
- 社内資料:エチニルエストラジオール−ノルゲスティメートとの薬物相互作用試験成績(2016年12月19日承認、CTD2.7.6.3.4.3)
- 社内資料:フマル酸ジメチルの臨床試験成績(2016年12月19日承認、CTD2.7.6.5.1.4)
- Gold R,et al., N Engl J Med., 367, 1098-107, (2012) »PubMed »DOI
- Fox RJ,et al., N Engl J Med., 367, 1087-97, (2012) »PubMed »DOI
- Linker RA,et al., Brain., 134, 678-92, (2011) »PubMed »DOI
- Kovac S,et al., Biochim Biophys Acta., 1850, 794-801, (2015) »PubMed »DOI
- Peng H,et al., J Biol Chem., 287, 28017-26, (2012) »PubMed »DOI
24. 文献請求先及び問い合わせ先
文献請求先
バイオジェン・ジャパン株式会社
くすり相談室
〒103-0027
東京都中央区日本橋一丁目4番1号
電話:(フリーダイヤル)0120-560-086 受付時間 9:00〜17:00(祝祭日、会社休日を除く月曜日から金曜日まで)
製品情報問い合わせ先
バイオジェン・ジャパン株式会社
くすり相談室
〒103-0027
東京都中央区日本橋一丁目4番1号
電話:(フリーダイヤル)0120-560-086 受付時間 9:00〜17:00(祝祭日、会社休日を除く月曜日から金曜日まで)
26. 製造販売業者等
26.1 製造販売元
バイオジェン・ジャパン株式会社
〒103-0027
東京都中央区日本橋一丁目4番1号