医薬品情報
| 総称名 | ミグリトール |
|---|---|
| 一般名 | ミグリトール |
| 欧文一般名 | Miglitol |
| 製剤名 | ミグリトール口腔内崩壊錠 |
| 薬効分類名 | 糖尿病食後過血糖改善剤 |
| 薬効分類番号 | 3969 |
| ATCコード | A10BF02 |
| KEGG DRUG |
D00625
ミグリトール
|
| KEGG DGROUP |
DG01663
α-グルコシダーゼ阻害薬
DG02044
血糖降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年6月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ミグリトールOD錠25mg「サワイ」 (後発品) | MIGLITOL OD Tablets[SAWAI] | 沢井製薬 | 3969009F6033 | 7.1円/錠 | 処方箋医薬品注) |
| ミグリトールOD錠50mg「サワイ」 (後発品) | MIGLITOL OD Tablets[SAWAI] | 沢井製薬 | 3969009F4030 | 10.6円/錠 | 処方箋医薬品注) |
| ミグリトールOD錠75mg「サワイ」 (後発品) | MIGLITOL OD Tablets[SAWAI] | 沢井製薬 | 3969009F5037 | 14.9円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 重症ケトーシス、糖尿病性昏睡又は前昏睡の患者[輸液及びインスリンによる速やかな高血糖の是正が必須となるので本剤の投与は適さない。]
2.2 重症感染症、手術前後、重篤な外傷のある患者[インスリン注射による血糖管理が望まれるので本剤の投与は適さない。]
2.3 本剤の成分に対する過敏症の既往歴のある患者
2.4 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
糖尿病の食後過血糖の改善(ただし、食事療法・運動療法を行っている患者で十分な効果が得られない場合、又は食事療法・運動療法に加えてスルホニルウレア剤、ビグアナイド系薬剤若しくはインスリン製剤を使用している患者で十分な効果が得られない場合に限る)
5. 効能または効果に関連する注意
5.1 糖尿病治療の基本である食事療法・運動療法のみを行っている患者では、投与の際の食後血糖1又は2時間値は200mg/dL以上を示す場合に限る。
5.2 食事療法、運動療法に加えて経口血糖降下剤又はインスリン製剤を使用している患者では、投与の際の空腹時血糖値は140mg/dL以上を目安とする。
6. 用法及び用量
通常、成人にはミグリトールとして1回50mgを1日3回毎食直前に経口投与する。なお、効果不十分な場合には、経過を十分に観察しながら1回量を75mgまで増量することができる。
7. 用法及び用量に関連する注意
高齢者には低用量(例えば1回量25mg)から投与を開始するなど慎重に投与すること。[9.8参照]
8. 重要な基本的注意
8.1 本剤投与中は、血糖を定期的に検査するとともに、経過を十分に観察し、常に投与継続の必要性について注意を払うこと。本剤を2〜3カ月投与しても食後血糖に対する効果が不十分な場合(静脈血漿で食後血糖2時間値が200mg/dL以下にコントロールできないなど)には、より適切と考えられる治療への変更を考慮すること。なお、食後血糖の十分なコントロール(静脈血漿で食後血糖2時間値が160mg/dL以下)が得られ、食事療法・運動療法又はこれらに加えて経口血糖降下剤若しくはインスリンを使用するのみで十分と判断される場合には、本剤の投与を中止して経過観察を行うこと。
8.2 本剤の使用にあたっては、患者に対し低血糖症状及びその対処方法について十分説明すること。[11.1.1参照]
8.3 低血糖症状を起こすことがあるので、高所作業、自動車の運転等に従事している患者に投与するときには注意すること。[11.1.1参照]
8.4 本剤の投与により、「腹部膨満」、「鼓腸」、「下痢」等の消化器系副作用が発現することがある。これらの症状が発現するおそれがある場合には、少量から投与を開始し、症状を観察しながら増量することが望ましい。これらは、一般に時間の経過とともに消失することが多いが、症状に応じて減量あるいは消化管内ガス駆除剤の併用を考慮し、高度で耐えられない場合は投与を中止すること。[11.1.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 開腹手術の既往又は腸閉塞の既往のある患者
腸内ガス等の増加により腸閉塞が発現するおそれがある。[11.1.2参照]
9.1.2 消化・吸収障害を伴った慢性腸疾患の患者
本剤の作用により病態が悪化するおそれがある。
9.1.3 ロエムヘルド症候群、重度のヘルニア、大腸の狭窄・潰瘍等の患者
腸内ガス等の増加により症状が悪化するおそれがある。
9.2 腎機能障害患者
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
代謝状態が不安定であり、血糖管理状態が大きく変化するおそれがある。
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。乳中へ移行することが報告されている4)(外国人データ)。
9.7 小児等
国内で実施された小児を対象とした製造販売後臨床試験において、56例中、副作用が報告されたのは37例(66.1%)であった。主な副作用は低血糖18例(32.1%)、下痢14例(25.0%)、腹部膨満7例(12.5%)、腹痛7例(12.5%)であった。
9.8 高齢者
副作用の発現に留意し、経過を十分に観察しながら慎重に投与すること。一般に生理機能が低下している。[7.参照]
10. 相互作用
10.2 併用注意
| 糖尿病用薬 スルホニルウレア系薬剤 ビグアナイド系薬剤 インスリン製剤 チアゾリジン系薬剤 速効型インスリン分泌促進薬 DPP-4阻害剤 GLP-1受容体作動薬 SGLT2阻害剤 [11.1.1参照] | 低血糖症状を発現するおそれがあるので、低用量から投与を開始するなど慎重に投与すること。 | 左記糖尿病用薬の血糖降下作用に本剤の糖質吸収遅延作用が加わる。 |
| 糖尿病用薬及びその血糖降下作用を増強する薬剤を併用している場合 糖尿病用薬の血糖降下作用を増強する薬剤 β-遮断剤 サリチル酸剤 モノアミン酸化酵素阻害剤 フィブラート系の高脂血症治療剤 ワルファリン 等 | 左記の併用に加え更に本剤を併用する場合には、糖尿病用薬の使用上の注意に記載の相互作用に留意するとともに、本剤の糖質吸収遅延作用が加わることによる影響に十分注意すること。 | 左記薬剤により他の糖尿病用薬の血糖降下作用が増強されるところに、本剤の糖質吸収遅延作用が加わる。 |
| 糖尿病用薬及びその血糖降下作用を減弱する薬剤を併用している場合 糖尿病用薬の血糖降下作用を減弱する薬剤 アドレナリン 副腎皮質ホルモン 甲状腺ホルモン 等 | 左記の併用に加え更に本剤を併用する場合には、糖尿病用薬の使用上の注意に記載の相互作用に留意するとともに、本剤の糖質吸収遅延作用が加わることによる影響に十分注意すること。 | 左記薬剤により他の糖尿病用薬の血糖降下作用が減弱されるところに、本剤の糖質吸収遅延作用が加わる。 |
| プロプラノロール ラニチジン | これらの薬剤の生物学的利用率が低下することがある。 | 発現機序は不明である。 |
| ジゴキシン | ジゴキシンの血漿中濃度が低下することがある。ジゴキシンの血漿中濃度が低下した場合には、ジゴキシンの投与量を調節するなど適切な処置を行う。 | 発現機序は不明である。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 低血糖
11.1.2 腸閉塞
11.1.3 肝機能障害、黄疸
AST、ALTの上昇等を伴う肝機能障害(頻度不明)、黄疸(頻度不明)があらわれることがある。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 消化器 | 腹部膨満、鼓腸、下痢 | 便秘、腸雑音異常、腹痛、嘔気、嘔吐、食欲不振、口渇、消化不良、胃不快感、おくび、胃炎、排便障害、痔核 | 口内炎、味覚異常、腸管のう胞様気腫症 |
| 過敏症 | 発疹、紅斑、蕁麻疹、そう痒 | ||
| 肝臓 | ALT上昇、AST上昇、γ-GTP上昇、LDH上昇、Al-P上昇 | ||
| 精神神経系 | めまい、頭痛 | しびれ、眠気 | |
| 血液 | 白血球数減少 | ||
| 代謝 | 血中アミラーゼ増加、血中カリウム増加、血中尿酸増加 | ||
| その他 | 頻尿、咳嗽 | 倦怠感、浮腫 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は舌の上にのせて唾液を浸潤させると崩壊するため水なしで服用可能である。また、水で服用することもできる。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性(6例又は12例)に空腹時にミグリトール25、50、100mg注)を単回経口投与した時、血漿中ミグリトールの薬物動態学的パラメータは以下のとおりであり、用量とCmaxは比例関係を示さなかった5)6)。
| \ | Tmax(h) | Cmax(μg/mL) | T1/2(h) |
| 25mg(n=6) | 1.83±0.26 | 0.875±0.167 | 1.97±0.26 |
| 50mg(n=6) | 2.42±0.66 | 1.156±0.351 | 2.20±0.53 |
| \ | Tmax(h) | Cmax(μg/mL) | T1/2(h) |
| 50mg(n=12) | 2.58±0.67 | 1.313±0.424 | 1.97±0.34 |
| 100mg(n=12) | 2.58±0.51 | 1.960±0.464 | 2.03±0.26 |
また、健康成人男性(6例)に空腹時又は食直前にミグリトール100mg注)を単回経口投与した時、食直前投与の血漿中ミグリトールは空腹時投与と同じ半減期(約2時間)で消失したが、Cmax及びAUCは低下した7)。
16.1.2 反復投与
16.4 代謝
16.5 排泄
健康成人男性(6例又は12例)に空腹時にミグリトール25、50、100mg注)を単回経口投与した時、尿中排泄率は用量増加に伴い低下した5)6)。
| \ | 尿中排泄率(% of Dose) |
| 25mg(n=6) | 86.2±5.3 |
| 50mg(n=6) | 70.7±10.8 |
| \ | 尿中排泄率(% of Dose) |
| 50mg(n=12) | 76.8±22.7 |
| 100mg(n=12) | 51.6±9.6 |
また、健康成人男性(6例)に空腹時又は食直前にミグリトール100mg注)を単回経口投与した時、尿中排泄率は空腹時が約50%、食直前が約30%であった7)。
健康成人男性(12例)にミグリトール50又は100mg注)を1日3回8日間(8日目は朝1回)反復経口投与した時、ミグリトールの累積排泄率は3〜4日以降ほぼ一定であった8)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能障害患者にミグリトール25mg注)を1日3回7日間反復経口投与した時、腎機能低下に伴いT1/2が延長した。また、クレアチニンクリアランスが30mL/min未満の患者では反復投与によりCmaxが増加した1)(外国人データ)。[9.2.1参照]
| パラメータ | 投与日 | クレアチニンクリアランス(mL/min) | ||
| ≧60 (n=7) | ≧30 to <60 (n=6) | <30 (n=6) | ||
| Cmax(μg/mL) | 1 | 1.02(1.19) | 1.18(1.28) | 1.33(1.38) |
| 7 | 1.25(1.26) | 1.37(1.32) | 3.05(1.32) | |
| T1/2(h) | 1 | 3.5(1.54) | 5.5(1.47) | 11.5(1.55) |
| 7 | 3.2(1.37) | 5.4(1.25) | 12.5(1.60) | |
また、血液透析患者(3例)にミグリトール50mgを1日3回7日間反復経口投与した時、投与2、5及び7日目の透析前後で血漿中濃度が7.37〜28.4μg/mLから1.62〜4.50μg/mLに低下した(除去率:平均80.0〜81.8%)13)(外国人データ)。
16.7 薬物相互作用
16.7.1 グリベンクラミド
16.7.2 メトホルミン
健康成人男性(12例)に対し、ミグリトール100mg注)あるいはプラセボ1日3回をクロスオーバー法にて7日間反復投与時に、メトホルミン1000mgを単回投与した時、メトホルミンのAUC0-9h及びCmaxがプラセボと比較して、それぞれ12及び13%低下した16)(外国人データ)。
16.7.3 ジゴキシン
健康成人男性(10例)に対し、ジゴキシン0.3mg 1日1回反復投与時の定常状態においてミグリトール50及び100mg注)を1日3回7日間併用投与した時、単独使用時と比較しジゴキシンのCminは19及び28%低下し、尿中排泄量は19及び33%低下した17)(外国人データ)。
また、2型糖尿病患者(27例)に対し、ジゴキシン0.2mg 1日1回反復投与時に、ミグリトール100mg注)あるいはプラセボ1日3回を14日間併用投与した時、プラセボと比較してジゴキシンのCminに影響を及ぼさなかった18)(外国人データ)。
また、2型糖尿病患者(27例)に対し、ジゴキシン0.2mg 1日1回反復投与時に、ミグリトール100mg注)あるいはプラセボ1日3回を14日間併用投与した時、プラセボと比較してジゴキシンのCminに影響を及ぼさなかった18)(外国人データ)。
| 項目 | ジゴキシン単独投与 (n=10) | ミグリトール50mg併用時 (n=10) | ミグリトール100mg併用時 (n=10) |
| Cmin(ng/mL) | 0.813(1.25) | 0.662(1.41) | 0.586(1.35) |
| 尿中排泄量(μg/24h) | 251.2(1.16) | 202.6(1.30) | 169.5(1.26) |
| 腎クリアランス(mL/min/kg) | 2.965(1.29) | 2.938(1.36) | 2.775(1.39) |
16.7.4 プロプラノロール
健康成人男性(10例)に対し、プロプラノロール40mg 1日3回反復投与時にミグリトール50及び100mg注)を1日3回7日間投与した時、単独使用時と比較しプロプラノロールのAUCは50及び100mgでそれぞれ30及び40%低下した。血糖値、心電図及び心拍出量には併用による影響が認められなかった19)(外国人データ)。
16.7.5 ラニチジン
健康成人男性(12例)に対し、ラニチジン150mgを1日2回反復投与時にミグリトール100mg注)1日3回をクロスオーバー法にて7日間投与した時、単独使用時と比較しラニチジンのAUC及びCmaxがそれぞれ40及び47%に低下した。一方、ミグリトールのAUC及びCmaxには影響が認められなかった20)(外国人データ)。
16.7.6 その他薬剤
16.8 その他
16.8.1 生物学的同等性試験
<ミグリトールOD錠50mg「サワイ」>
ミグリトールOD錠50mg「サワイ」とセイブルOD錠50mgを健康成人男子にそれぞれ1錠(ミグリトールとして50mg)空腹時単回経口投与(クロスオーバー法)し、投与直後にショ糖負荷(75g)して血糖値を測定した。また、コントロールとしてショ糖負荷(75g)のみを行い血糖値を測定した。得られたパラメータ(△AUC、△Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された25)。
| △Cmax(mg/dL) | △AUC0-3hr(mg・hr/dL) | ||
| 水なし | ミグリトールOD錠50mg「サワイ」 | 65.7±21.5 | 83.0±31.0 |
| セイブルOD錠50mg | 66.5±21.9 | 78.8±32.5 | |
| 水あり | ミグリトールOD錠50mg「サワイ」 | 68.3±15.6 | 92.1±39.2 |
| セイブルOD錠50mg | 69.0±14.5 | 90.8±41.0 |
<水なしで服用時>
<水で服用時>
<ミグリトールOD錠75mg「サワイ」>
ミグリトールOD錠75mg「サワイ」とセイブルOD錠75mgを健康成人男子にそれぞれ1錠(ミグリトールとして75mg)空腹時単回経口投与(クロスオーバー法)し、投与直後にショ糖負荷(75g)して血糖値を測定した。また、コントロールとしてショ糖負荷(75g)のみを行い血糖値を測定した。得られたパラメータ(△AUC、△Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された25)。
| △Cmax(mg/dL) | △AUC0-3hr(mg・hr/dL) | ||
| 水なし | ミグリトールOD錠75mg「サワイ」 | 75.4±20.7 | 96.6±34.9 |
| セイブルOD錠75mg | 75.4±19.9 | 97.7±28.1 | |
| 水あり | ミグリトールOD錠75mg「サワイ」 | 65.7±17.9 | 71.4±23.2 |
| セイブルOD錠75mg | 64.6±17.5 | 68.3±26.7 |
<水なしで服用時>
<水で服用時>
血糖値ならびに△AUC、△Cmaxのパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
<ミグリトールOD錠25mg「サワイ」>
ミグリトールOD錠25mg「サワイ」は溶出挙動に基づき、ミグリトールOD錠50mg「サワイ」と生物学的に同等とみなされた26)。
注)本剤の承認された用法及び用量は、通常、ミグリトールとして1回50mgを1日3回毎食直前、最大投与量は1回75mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(単剤療法)
2型糖尿病患者における二重盲検比較対照試験(有効性解析対象:プラセボ84例、ミグリトール錠158例)において、プラセボのHbA1c(JDS値)、食後血糖1及び2時間値がそれぞれ0.25%、0.8mg/dL及び3.3mg/dL上昇したのに対して、ミグリトール錠50mg1日3回12週間投与によりそれぞれ0.35%、73.0mg/dL及び27.8mg/dL低下した27)28)。
副作用発現頻度は、58.0%(101/174例)であった。主な副作用は、腹部膨満23.6%(41/174例)、鼓腸23.0%(40/174例)、下痢16.7%(29/174例)、軟便6.3%(11/174例)、腸雑音異常4.6%(8/174例)であった。
副作用発現頻度は、58.0%(101/174例)であった。主な副作用は、腹部膨満23.6%(41/174例)、鼓腸23.0%(40/174例)、下痢16.7%(29/174例)、軟便6.3%(11/174例)、腸雑音異常4.6%(8/174例)であった。
17.1.2 国内第III相試験(併用療法)
(1)スルホニルウレア剤(SU剤)併用試験
SU剤で治療中の2型糖尿病患者を対象にミグリトール錠50mg 1日3回12週間投与したプラセボ対照単盲検比較試験(有効性解析対象:プラセボ77例、ミグリトール錠152例)において、最終評価時におけるHbA1c(JDS値)は、プラセボでは0.2%上昇、ミグリトール錠では0.28%低下した。投与12週間後の食後血糖1及び2時間値は、プラセボでは有意な変化はなく、ミグリトール錠では76.8mg/dL及び32.6mg/dL低下した。その後52週にわたって継続投与した長期試験(非盲検試験)においても、ミグリトール錠の効果は持続し、安定した血糖コントロールが得られた29)30)。
副作用発現頻度は、60.5%(92/152例)であった。主な副作用は、腹部膨満27.6%(42/152例)、鼓腸27.0%(41/152例)、下痢15.1%(23/152例)、便秘5.3%(8/152例)、軟便4.6%(7/152例)であった。
副作用発現頻度は、60.5%(92/152例)であった。主な副作用は、腹部膨満27.6%(42/152例)、鼓腸27.0%(41/152例)、下痢15.1%(23/152例)、便秘5.3%(8/152例)、軟便4.6%(7/152例)であった。
(2)ビグアナイド剤(BG剤)併用試験
BG剤で治療中の2型糖尿病患者を対象にミグリトール錠50mg 1日3回16週間投与したプラセボ対照二重盲検比較試験(有効性解析対象:プラセボ49例、ミグリトール錠固定用量47例、ミグリトール錠漸増52例)において、最終評価時のHbA1c(JDS値)は、プラセボでは0.11%上昇、ミグリトール錠ではそれぞれ0.40%及び0.37%低下した。投与16週後の食後血糖1時間値はプラセボで0.4mg/dL低下、ミグリトール錠ではそれぞれ84.4mg/dL及び76.3mg/dL低下した。食後血糖2時間値はプラセボで3.3mg/dL低下、ミグリトール錠ではそれぞれ29.1mg/dL及び25.0mg/dL低下した。
副作用発現頻度は、固定用量群が70.2%(33/47例)、漸増群が63.5%(33/52例)であった。固定用量群及び漸増群の主な副作用は、下痢48.9%(23/47例)及び38.5%(20/52例)、鼓腸31.9%(15/47例)及び23.1%(12/52例)、腹部膨満23.4%(11/47例)及び3.8%(2/52例)であった。
また、BG剤で治療中の2型糖尿病患者を対象にミグリトール錠25mg 1日3回で開始し、8週以降はミグリトール錠50mg 1日3回に増量し、24週以降は効果不十分な場合はミグリトール錠75mg 1日3回に増量した52週間の長期投与試験(非盲検試験、有効性解析対象:106例)において、ミグリトール錠の効果は持続し、安定した血糖コントロールが得られた。
副作用発現頻度は、61.3%(65/106例)であった。主な副作用は、鼓腸32.1%(34/106例)、下痢26.4%(28/106例)、腹部膨満15.1%(16/106例)であった31)。
副作用発現頻度は、固定用量群が70.2%(33/47例)、漸増群が63.5%(33/52例)であった。固定用量群及び漸増群の主な副作用は、下痢48.9%(23/47例)及び38.5%(20/52例)、鼓腸31.9%(15/47例)及び23.1%(12/52例)、腹部膨満23.4%(11/47例)及び3.8%(2/52例)であった。
また、BG剤で治療中の2型糖尿病患者を対象にミグリトール錠25mg 1日3回で開始し、8週以降はミグリトール錠50mg 1日3回に増量し、24週以降は効果不十分な場合はミグリトール錠75mg 1日3回に増量した52週間の長期投与試験(非盲検試験、有効性解析対象:106例)において、ミグリトール錠の効果は持続し、安定した血糖コントロールが得られた。
副作用発現頻度は、61.3%(65/106例)であった。主な副作用は、鼓腸32.1%(34/106例)、下痢26.4%(28/106例)、腹部膨満15.1%(16/106例)であった31)。
(3)インスリン製剤併用試験(2型糖尿病)
インスリン製剤で治療中の2型糖尿病患者を対象にミグリトール錠50mg 1日3回12週間投与したプラセボ対照二重盲検比較試験(有効性解析対象:プラセボ100例、ミグリトール錠107例)において、プラセボのHbA1c(JDS値)、食後血糖1及び2時間値がそれぞれ0.03%、3.8mg/dL及び5.7mg/dL上昇したのに対して、ミグリトール錠50mg1日3回12週間投与によりそれぞれ0.36%、77.0mg/dL及び43.7mg/dL低下した32)33)。
副作用発現頻度は、67.3%(72/107例)であった。主な副作用は、低血糖35.5%(38/107例)、鼓腸20.6%(22/107例)、腹部膨満14.0%(15/107例)、下痢11.2%(12/107例)であった。
副作用発現頻度は、67.3%(72/107例)であった。主な副作用は、低血糖35.5%(38/107例)、鼓腸20.6%(22/107例)、腹部膨満14.0%(15/107例)、下痢11.2%(12/107例)であった。
(4)インスリン製剤併用試験(1型糖尿病)
18. 薬効薬理
18.1 作用機序
ミグリトールは、小腸粘膜上皮細胞の刷子縁膜において二糖類から単糖への分解を担う二糖類水解酵素(α-グルコシダーゼ)を阻害し、糖質の消化・吸収を遅延させることにより食後の過血糖を改善する。
18.2 二糖類水解酵素に対する阻害作用
18.2.1 ラット小腸由来スクラーゼとイソマルターゼに対してアカルボースよりそれぞれ約6倍及び120倍強く、同様にボグリボースに対し1/3.6倍及び同程度の強い阻害作用を示した36)(in vitro)。一方、ラット膵α-アミラーゼに対する阻害作用は認められず、ラクターゼ及びトレハラーゼ活性を阻害することが報告されている37)(in vitro)。
18.2.2 ラット小腸由来スクラーゼ、イソマルターゼ、マルターゼに対する阻害様式は競合型である36)(in vitro)。
18.3 血糖上昇抑制作用
18.3.1 正常ラットに経口投与した結果、スクロース、煮沸でんぷん及び生でんぷん負荷後の血糖上昇を抑制するが、グルコース負荷後の血糖上昇に対しては無効であった38)。
18.3.2 健康成人男性(6例)にミグリトール50mgを1日3回、毎食直前に8日間(8日目は朝食時1回投与のみ)経口投与したところ、毎食後の血糖上昇を抑制し、血清インスリンの上昇を抑制した8)。
18.3.3 非肥満2型糖尿病モデルのGKラットに糖質(スクロース)負荷試験を実施した結果、ミグリトールは糖質負荷後の血糖上昇抑制作用を示した39)。
18.3.4 GKラットにミグリトールを8週間混餌投与した結果、食後血糖上昇抑制作用が継続し、HbA1cの改善が認められた39)。
18.3.5 成人2型糖尿病患者(40例)にクロスオーバー法にてプラセボ及びミグリトールを1回50mg投与し食事負荷をしたところ、食後早期(30分〜1時間)の血糖上昇を抑制するとともに、インスリン分泌を抑制した40)。
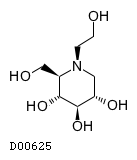
19. 有効成分に関する理化学的知見
19.1. ミグリトール
20. 取扱い上の注意
アルミピロー包装開封後は、湿気を避けて保存すること。
22. 包装
<ミグリトールOD錠25mg「サワイ」>
PTP
100錠(10錠×10)
<ミグリトールOD錠50mg「サワイ」>
PTP
100錠(10錠×10)、500錠(10錠×50)
<ミグリトールOD錠75mg「サワイ」>
PTP
100錠(10錠×10)
23. 主要文献
- 保存期の腎機能低下患者における薬物動態(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(17))
- 生殖発生毒性試験(ウサギ)(セイブル錠:2005年10月11日承認、申請資料概要2.6.6.6)
- 生殖発生毒性試験(ラット)(セイブル錠:2005年10月11日承認、申請資料概要2.6.6.6)
- 産褥期健康成人女性における薬物動態及び乳汁移行(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(12))
- 健康成人における薬物動態の用量反応I(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(5))
- 健康成人における薬物動態の用量反応II(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(6))
- 健康成人における生物学的利用能に及ぼす食事の影響(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 I(1))
- 健康成人における反復投与時の薬物動態(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(7))
- 2型糖尿病における薬物動態(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(13))
- Ahr,H.J.et al., Arzneim-Forsch., 47, 734-745, (1997) »PubMed
- 肝薬物代謝酵素系に対する阻害作用(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(4))
- ラット肝薬物代謝酵素に対する影響−7日間経口投与試験−(セイブル錠:2005年10月11日承認、申請資料概要2.6.4.5)
- 透析患者における薬物動態(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(16))
- グリベンクラミドとの薬物相互作用I(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(18))
- グリベンクラミドとの薬物相互作用II(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(19))
- メトホルミンとの薬物相互作用(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(20))
- Weber,H.et al., Eur.J.Clin.Pharmacol., 36 (Suppl.), 11, (1989)
- ジゴキシンとの薬物相互作用(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(22))
- プロプラノロールとの薬物相互作用(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(23))
- ラニチジンとの薬物相互作用(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(27))
- ニフェジピンとの薬物相互作用(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(24))
- Schall,R.et al., Arzneim-Forsch., 46, 41-46, (1996) »PubMed
- Richardt,D.et al., Clin.Drug Invest., 13, 171-174, (1997)
- 制酸剤との薬物相互作用(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 II(28))
- 村上晴美他, 診療と新薬, 54, 460-482, (2017)
- 社内資料:生物学的同等性試験(OD錠25mg)
- Kawamori,R.et al., Diabetes Metab., 29, 4S263, (2003)
- 食事・運動療法への追加療法(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 III(3))
- 田嶼尚子他, 薬理と治療, 34, 79-90, (2006)
- スルホニルウレア剤併用試験(セイブル錠:2005年10月11日承認、申請資料概要2.7.6 III(5))
- ビグアナイド剤併用試験(セイブル錠:2009年11月6日承認、審査報告書)
- Nemoto,M.et al., Acta Diabetol., 48, 15-20, (2011) »PubMed
- インスリン併用試験<2型糖尿病>(セイブル錠:2008年12月22日承認、審査報告書)
- Kubo,S.et al., J.Diabetes Invest., 1, 60-65, (2010)
- インスリン併用試験<1型糖尿病>(セイブル錠:2008年12月22日承認、審査報告書)
- 二糖類水解酵素に対する阻害作用(セイブル錠:2005年10月11日承認、申請資料概要2.6.2.2)
- Samulitis,B.K.et al., Drugs Exp.Clin.Res., 13, 517-524, (1987) »PubMed
- 塚本桂他, 薬理と治療, 29, 623-633, (2001)
- Goda,T.et al., Br.J.Nutr., 98, 702-710, (2007) »PubMed
- Osonoi,T.et al., Diabetes Metab., 29, 4S263-4S264, (2003)
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30