医薬品情報
| 総称名 | インチュニブ |
|---|---|
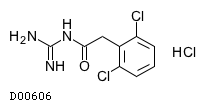
| 一般名 | グアンファシン塩酸塩 |
| 欧文一般名 | Guanfacine Hydrochloride |
| 製剤名 | グアンファシン塩酸塩徐放錠 |
| 薬効分類名 | 注意欠陥/多動性障害治療剤(選択的α2Aアドレナリン受容体作動薬) |
| 薬効分類番号 | 1179 |
| KEGG DRUG |
D00606
グアンファシン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年11月 改訂(第5版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| インチュニブ錠1mg | intuniv Tablets | 武田薬品工業 | 1179057G1021 | 398.8円/錠 | 劇薬, 処方箋医薬品注) |
| インチュニブ錠3mg | intuniv Tablets | 武田薬品工業 | 1179057G2028 | 527.2円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
注意欠陥/多動性障害(AD/HD)
5. 効能または効果に関連する注意
5.2 AD/HDの診断は、米国精神医学会の精神疾患の診断・統計マニュアル(DSM※)等の標準的で確立した診断基準に基づき慎重に実施し、基準を満たす場合にのみ投与すること。
※:Diagnostic and Statistical Manual of Mental Disorders
6. 用法及び用量
<18歳未満の患者>
通常、体重50kg未満の場合はグアンファシンとして1日1mg、体重50kg以上の場合はグアンファシンとして1日2mgより投与を開始し、1週間以上の間隔をあけて1mgずつ、下表の維持用量まで増量する。
なお、症状により適宜増減するが、下表の最高用量を超えないこととし、いずれも1日1回経口投与すること。
なお、症状により適宜増減するが、下表の最高用量を超えないこととし、いずれも1日1回経口投与すること。
| 体重 | 開始用量 | 維持用量 | 最高用量 |
| 17kg以上25kg未満 | 1mg | 1mg | 2mg |
| 25kg以上34kg未満 | 1mg | 2mg | 3mg |
| 34kg以上38kg未満 | 1mg | 2mg | 4mg |
| 38kg以上42kg未満 | 1mg | 3mg | 4mg |
| 42kg以上50kg未満 | 1mg | 3mg | 5mg |
| 50kg以上63kg未満 | 2mg | 4mg | 6mg |
| 63kg以上75kg未満 | 2mg | 5mg | 6mg |
| 75kg以上 | 2mg | 6mg | 6mg |
<18歳以上の患者>
通常、グアンファシンとして1日2mgより投与を開始し、1週間以上の間隔をあけて1mgずつ、1日4〜6mgの維持用量まで増量する。
なお、症状により適宜増減するが、1日用量は6mgを超えないこととし、いずれも1日1回経口投与すること。
なお、症状により適宜増減するが、1日用量は6mgを超えないこととし、いずれも1日1回経口投与すること。
7. 用法及び用量に関連する注意
7.1 CYP3A4/5阻害剤を投与中の患者、重度の肝機能障害のある患者又は重度の腎機能障害のある患者に投与する場合には、1日1mgより投与を開始すること。[9.2.1、9.3.1、10.2、16.6.1、16.7.1参照]
7.2 本剤の投与を中止する場合は、原則として3日間以上の間隔をあけて1mgずつ、血圧及び脈拍数を測定するなど患者の状態を十分に観察しながら徐々に減量すること。本剤の急な中止により、血圧上昇及び頻脈があらわれることがある。[9.1.2参照]
8. 重要な基本的注意
8.1 本剤を投与する医師又は医療従事者は、投与前に患者(小児の場合には患者及び保護者又はそれに代わる適切な者)に対して、本剤の治療上の位置づけ及び本剤投与による副作用発現等のリスクについて、十分な情報を提供するとともに、適切な使用方法について指導すること。
8.2 本剤を長期間投与する場合には、定期的に有用性の再評価を実施し、漫然と投与しないよう注意すること。
8.3 高度な血圧低下及び脈拍数減少が認められ、失神に至る場合があるので、本剤の投与開始前及び用量変更の1〜2週間後には、血圧及び脈拍数を測定すること。至適用量の決定後にも4週に1回を目途に血圧及び脈拍数を測定すること。また、本剤の投与による脱水に十分注意し、脱水の症状があらわれた場合には、補液等適切な措置を講じること。[11.1.1参照]
8.4 心血管系への影響(高度な徐脈、低血圧、QT延長等)があらわれる可能性があるので、本剤投与開始前及び投与中は以下の点に注意すること。[11.1.1-11.1.3、17.3.1参照]
・本剤投与開始前には心電図異常の有無について確認すること。心電図異常が認められた場合は、投与の可否を慎重に判断すること。
・本剤投与中は心血管系の状態に注意し、心血管系への影響を示唆する症状(徐脈、失神、ふらつき、動悸等)があらわれた場合には心電図検査等を行い、適切な処置を行うこと。
8.5 本剤の投与開始時及び用量調節時に副作用(傾眠、血圧低下等)により投与中止に至った症例が認められていることから、本剤の投与中(特に投与開始時及び用量調節時)においては、患者の状態を慎重に観察し、用量の調節を行うこと。
8.6 自殺念慮や自殺行為があらわれることがあるので、患者の状態を注意深く観察すること。また、患者(小児の場合には患者及び保護者又はそれに代わる適切な者)に対し、これらの症状・行為があらわれた場合には、速やかに医療機関に連絡するよう指導すること。
8.7 攻撃性、敵意はAD/HDにおいてしばしば観察されるが、本剤の投与中にも攻撃性、敵意の発現が報告されている。投与中は、攻撃的行動、敵意の発現又は悪化について観察すること。
8.8 眠気、鎮静等が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作には従事させないよう注意すること。
8.9 本剤の投与により体重増加を来すことがあるので、定期的に体重を測定し、肥満の徴候があらわれた場合は、食事療法、運動療法等の適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 低血圧、起立性低血圧、徐脈、心血管疾患のある患者又はその既往歴のある患者、血圧を低下又は脈拍数を減少させる作用を有する薬剤を投与中の患者
血圧及び心拍数を低下させることがある。[8.4参照]
9.1.2 高血圧のある患者又はその既往歴のある患者
本剤を急に中止した場合、血圧上昇があらわれることがある。[7.2参照]
9.1.3 不整脈又はその既往歴のある患者、先天性QT延長症候群の患者又はQT延長を起こすことが知られている薬剤を投与中の患者
9.1.4 狭心症及び心筋梗塞等の虚血性心疾患のある患者又はその既往歴のある患者
急激な血圧低下があらわれた場合、冠血流量が減少し虚血性心疾患が悪化するおそれがある。
9.1.5 脳梗塞等の脳血管障害のある患者
急激な血圧低下があらわれた場合、脳血流量が減少し症状が悪化するおそれがある。
9.1.6 抑うつ状態の患者
本剤の鎮静作用により、症状が悪化するおそれがある。
9.2 腎機能障害患者
9.3 肝機能障害患者
9.3.1 重度の肝機能障害のある患者
本剤の血中濃度が上昇する可能性がある。[7.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。動物実験(マウス)において大量投与により催奇形作用(外脳症、脊椎破裂症)が報告されている。[2.2参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行が報告されている。
9.7 小児等
10. 相互作用
相互作用序文
本剤は、主に肝代謝酵素CYP3A4及びCYP3A5で代謝される。[16.4.2参照]
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP3A5
10.2 併用注意
| CYP3A4/5阻害剤 イトラコナゾール、リトナビル、クラリスロマイシン等 [7.1、16.7.1参照] | 本剤の血中濃度が上昇し、作用が増強するおそれがあるので、本剤を減量するなど注意すること。 | これらの薬剤により、本剤の代謝が阻害される可能性がある。ケトコナゾール(経口剤、国内未発売)との併用により、本剤のAUCが3倍増加した。 |
| CYP3A4/5誘導剤 リファンピシン、カルバマゼピン、フェノバルビタール、フェニトイン等 [16.7.2参照] | 本剤の血中濃度が減少し、作用が減弱するおそれがある。 | これらの薬剤により、本剤の代謝が促進される可能性がある。リファンピシンとの併用により、本剤のAUCが約70%減少した。 |
| 中枢神経抑制剤 鎮静剤、催眠剤、抗精神病薬、フェノチアジン誘導体、バルビツール酸誘導体、ベンゾジアゼピン誘導体等 アルコール | 相互に作用を増強することがある。 | これらの薬剤により、本剤の鎮静作用が増強される可能性がある。 |
| バルプロ酸 | バルプロ酸の血中濃度が増加したとの報告がある。 | 機序は不明である。 |
| 降圧作用を有する薬剤 β遮断剤、Ca拮抗剤、ACE阻害剤、アンジオテンシンII受容体拮抗剤、降圧利尿剤等 | 相互に作用を増強し、失神を起こすことがある。 | これらの薬剤により、本剤の降圧作用及び徐脈作用が増強される可能性がある。 |
| 心拍数減少作用を有する薬剤 ジギタリス製剤等 | 相互に作用を増強し、失神を起こすことがある。 | これらの薬剤により、本剤の降圧作用及び徐脈作用が増強される可能性がある。 |
11. 副作用
重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 低血圧(20.5%注))、徐脈(14.9%注))
11.1.2 失神(頻度不明)[8.4参照]
注)18歳未満の患者より18歳以上の患者で特に高頻度に発現が認められた副作用
その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 過敏症 | 過敏症、発疹、そう痒 | |||
| 循環器 | 起立性低血圧 | 血圧上昇、頻脈、洞性不整脈 | 蒼白、高血圧性脳症、QT延長 | |
| 精神神経系 | 傾眠(49.8%)、頭痛、不眠、めまい注) | 易刺激性、悪夢、感情不安定、激越、鎮静、無力症 | 不安、うつ病、嗜眠、痙攣、過眠症、幻覚 | |
| 消化器 | 口渇注)、便秘 | 腹痛、食欲減退、悪心、下痢 | 腹部不快感、嘔吐、消化不良 | |
| その他 | 倦怠感 | 遺尿、体重増加 | 頻尿、胸痛、ALT上昇 | 喘息、脱水、勃起不全 |
13. 過量投与
13.1 症状
低血圧、徐脈、QT延長、投与初期の一過性高血圧、嗜眠、呼吸抑制等があらわれることがある。
13.2 処置
本剤は透析により除去されない。嗜眠が発現した場合は、昏睡、徐脈及び低血圧等のより重篤な毒性が遅れて発現する可能性があるため、処置を行った上で少なくとも24時間観察すること。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は徐放性製剤であるため、割ったり、砕いたり、すりつぶしたりしないで、そのままかまずに服用するよう指導すること。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人
健康成人男性8例に2mg、4mg及び6mgを漸増法でそれぞれ1日1回空腹時5日間、計15日間反復経口投与したときの各投与量における投与5日目の血漿中濃度を図16-1に、薬物動態パラメータを表16-1に示す。投与後5〜8時間(中央値)でCmaxに達し、Cmax及びAUCはほぼ用量に比例して増加した。また、反復投与開始後約5日で定常状態に達した1)。
図16-1 健康成人における血漿中濃度(反復投与:各投与量における投与5日目)
| 投与量(mg) | 例数 | Cmax※1(ng/mL) | AUC0-τ※1(ng・hr/mL) | Tmax※2(hr) |
| 2 | 8 | 2.70(0.552) | 46.08(10.47) | 5(5-8) |
| 4 | 7.71(3.30) | 139.4(58.16) | 6.5(5-12) | |
| 6 | 11.7(2.44) | 213.0(45.79) | 8(5-8) |
16.1.2 小児患者
日本人小児及び外国人小児AD/HD患者(392例)から得られた血漿中グアンファシン濃度データ(3231ポイント)を用いて母集団薬物動態解析を行った。その結果、見かけの全身クリアランス及び見かけの分布容積に対して体重が統計学的に有意な共変量であった。また、日本人児童患者160例(6〜12歳)及び青少年患者31例(13〜17歳)にそれぞれ0.04mg/kg注1)、0.08mg/kg及び0.12mg/kgを1日1回経口投与したとき、母集団薬物動態解析の結果に基づき推定した薬物動態パラメータは表16-2のとおりである2)。
注1)本剤の承認された最高用量は6mgである。
| 投与群 | 児童(6〜12歳) | 青少年(13〜17歳) | ||||
| 例数 | Cmax(ng/mL) | AUC0-τ(ng・hr/mL) | 例数 | Cmax(ng/mL) | AUC0-τ(ng・hr/mL) | |
| 0.04mg/kg | 54 | 2.47(1.51-3.92) | 45.59(26.86-76.07) | 11 | 2.92(2.06-4.23) | 54.32(29.73-88.48) |
| 0.08mg/kg | 52 | 5.00(2.31-7.48) | 90.40(31.44-152.9) | 10 | 6.57(5.11-9.08) | 129.1(91.42-197.7) |
| 0.12mg/kg | 54 | 7.49(5.02-11.3) | 132.1(90.82-232.2) | 10 | 10.0(6.56-12.9) | 200.5(120.8-272.6) |
16.2 吸収
16.2.1 食事の影響
健康成人140例を対象に、3mg(1mg錠3錠あるいは3mg錠1錠)単回投与時の食事の影響を検討したところ、空腹時投与に比べて食後投与(高脂肪食)ではCmaxは約1.2〜1.4倍高く、AUCは約1.2〜1.3倍高かった3)。
16.3 分布
16.3.1 蛋白結合率
ヒト血漿蛋白結合率は、約70%である4)。
16.4 代謝
16.4.1 代謝経路
グアンファシンの主要な代謝経路は、芳香環における水酸化、それに続くグルクロン酸抱合又は硫酸抱合であると推定された。健康成人男性11例に4mgを反復経口投与したとき、ヒドロキシグアンファシンの硫酸抱合体及びヒドロキシグアンファシンのグルクロン酸抱合体が血漿中の代謝物として検出された5)。
16.4.2 代謝酵素
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
16.7 薬物相互作用
16.7.1 CYP3A4/5阻害剤との併用
16.7.2 CYP3A4/5誘導剤との併用
16.7.3 メチルフェニデート塩酸塩との併用
健康成人38例に、グアンファシン4mgとメチルフェニデート塩酸塩36mgを単回投与したとき、グアンファシンとd-メチルフェニデートのCmax及びAUCに影響は認められなかった10)(外国人データ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<18歳未満の患者>
17.1.1 国内第II/III相試験(二重盲検試験)
小児AD/HD患者(6歳以上18歳未満)を対象に実施したプラセボ対照二重盲検並行群間比較試験において、有効性の評価尺度であるADHD-RS-IV合計スコアの投与7週後のベースラインからの変化量は下表のとおりであった11)。[5.1、9.7参照]
| 投与群※2 | ベースライン | 投与7週後 | 変化量 | プラセボとの比較 | |||
| 例数 | 平均(標準偏差) | 例数 | 平均(標準偏差) | 調整平均値(標準誤差) | 調整平均値の差[95%信頼区間] | p値※3 | |
| プラセボ | 67 | 36.57(8.57) | 62 | 29.95(12.19) | −6.70(1.24) | − | − |
| 0.08mg/kg | 65 | 36.95(8.17) | 61 | 22.41(10.94) | −14.60(1.25) | −7.89[−11.14,−4.65] | <0.0001 |
| 0.12mg/kg | 66 | 35.98(8.70) | 54 | 18.31(11.81) | −16.89(1.29) | −10.19[−13.48,−6.89] | <0.0001 |
副作用は104/197例(52.8%)に認められた。主なものは、傾眠73例(37.1%)、頭痛17例(8.6%)であった。
17.1.2 国内第III相試験(長期投与試験)
小児AD/HD患者(6歳以上18歳未満)を対象に実施したプラセボ対照二重盲検群間比較試験を完了した小児患者を対象に実施した長期投与試験において、有効性の評価尺度であるADHD-RS-IV合計スコアの推移は下表のとおりであった12)。[5.1、9.7参照]
| プラセボ/本剤集団※1 | 本剤/本剤集団※2 | |||
| 例数 | 合計スコア | 例数 | 合計スコア | |
| 二重盲検試験開始時 | 67 | 36.6±8.6 | 197 | 36.3±8.2 |
| 長期投与試験開始時 | 57 | 31.4±12.6 | 165 | 25.9±11.4 |
| 1週 | 57 | 27.7±11.8 | 165 | 24.6±12.1 |
| 2週 | 56 | 26.4±11.9 | 163 | 22.5±12.2 |
| 3週 | 54 | 23.2±10.5 | 163 | 21.1±11.6 |
| 4週 | 54 | 22.1±10.8 | 159 | 19.6±11.5 |
| 5週 | 53 | 21.6±11.3 | 160 | 18.8±11.6 |
| 7週 | 52 | 20.0±10.1 | 155 | 18.4±11.5 |
| 11週 | 49 | 19.7±9.9 | 152 | 17.9±10.6 |
| 15週 | 46 | 20.4±9.6 | 152 | 18.9±11.4 |
| 27週 | 41 | 19.0±8.4 | 138 | 17.9±10.6 |
| 39週 | 38 | 19.3±10.1 | 130 | 16.2±9.8 |
| 51週 | 34 | 19.1±10.9 | 125 | 16.2±10.6 |
| 最終評価時 | 57 | 22.2±12.0 | 165 | 18.8±11.4 |
副作用は156/222例(70.3%)に認められた。主なものは、傾眠120例(54.1%)、頭痛21例(9.5%)、血圧低下18例(8.1%)であった。
<18歳以上の患者>
17.1.3 国内第III相試験(二重盲検試験)
18歳以上のAD/HD患者を対象に実施したプラセボ対照二重盲検並行群間比較試験において、有効性の評価尺度であるADHD-RS-IV with adult prompts日本語版合計スコアの投与10週後のベースラインからの変化量は下表のとおりであった13)。
| 投与群 | ベースライン | 投与10週後 | 変化量 | プラセボとの比較 | |||
| 例数 | 平均(標準偏差) | 例数 | 平均(標準偏差) | 調整平均値(標準誤差) | 調整平均値の差[95%信頼区間] | p値 | |
| プラセボ | 100 | 31.70(6.83) | 93 | 23.55(10.29) | −7.27(1.07) | − | − |
| 本剤 | 100 | 31.45(5.92) | 79 | 19.53(9.45) | −11.55(1.10) | −4.28[−6.67,−1.88] | 0.0005 |
副作用は72/101例(71.3%)に認められた。主なものは、傾眠33例(32.7%)、血圧低下21例(20.8%)、口渇20例(19.8%)、体位性めまい15例(14.9%)、便秘9例(8.9%)、浮動性めまい8例(7.9%)、徐脈8例(7.9%)であった。
17.1.4 国内第III相試験(長期投与試験)
18歳以上のAD/HD患者を対象に実施したプラセボ対照二重盲検群間比較試験を完了した患者及び本臨床試験に新規に登録された18歳以上の成人AD/HD患者を対象に実施した長期投与試験において、有効性の評価尺度であるADHD-RS-IV with adult prompts日本語版合計スコアの推移は下表のとおりであった14)。
| 継続例 | 新規例※3 | |||||
| プラセボ/本剤集団※1 | 本剤/本剤集団※2 | |||||
| 例数 | 合計スコア | 例数 | 合計スコア | 例数 | 合計スコア | |
| 二重盲検試験開始時 | 100 | 31.70±6.83 | 100 | 31.45±5.92 | − | − |
| 長期投与試験開始時 | 88 | 24.76±10.54 | 62 | 22.31±10.47 | 41 | 32.80±5.94 |
| 1週 | 88 | 23.43±10.50 | 62 | 20.82±9.36 | 41 | 30.66±6.25 |
| 2週 | 83 | 22.33±10.64 | 61 | 19.64±8.98 | 41 | 27.56±7.62 |
| 3週 | 80 | 21.18±11.23 | 61 | 18.82±9.62 | 38 | 26.39±7.35 |
| 4週 | 73 | 20.33±11.56 | 58 | 18.14±9.22 | 37 | 24.46±7.58 |
| 5週 | 72 | 19.14±11.21 | 58 | 16.83±8.88 | 37 | 21.81±7.78 |
| 6週 | 68 | 18.54±10.95 | 55 | 16.07±9.08 | 37 | 20.68±6.94 |
| 14週 | 59 | 17.95±11.15 | 53 | 15.58±9.41 | 34 | 18.53±6.50 |
| 26週 | 53 | 17.17±11.57 | 48 | 13.17±8.22 | 32 | 16.53±8.52 |
| 38週 | 49 | 16.55±12.19 | 47 | 12.13±7.32 | 31 | 14.97±8.06 |
| 50週 | 49 | 15.82±11.69 | 45 | 11.80±7.43 | 29 | 13.93±8.42 |
| 最終評価時 | 88 | 18.82±11.06 | 62 | 14.44±9.26 | 41 | 16.27±9.68 |
副作用は160/191例(83.8%)に認められた。主なものは、傾眠77例(40.3%)、口渇58例(30.4%)、血圧低下38例(19.9%)、体位性めまい34例(17.8%)、徐脈33例(17.3%)、倦怠感29例(15.2%)、便秘18例(9.4%)、浮動性めまい17例(8.9%)であった。
17.3 その他
18. 薬効薬理
19. 有効成分に関する理化学的知見
19.1. グアンファシン塩酸塩
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<インチュニブ錠1mg>
100錠[10錠(PTP)×10]、140錠[14錠(PTP)×10]
<インチュニブ錠3mg>
100錠[10錠(PTP)×10]、140錠[14錠(PTP)×10]
23. 主要文献
- 社内資料:健康成人における高用量薬物動態試験(2019/6/18承認、申請資料概要2.7.2.2)
- 社内資料:小児AD/HD患者における母集団薬物動態解析(2017/3/30承認、申請資料概要2.7.2.3)
- 社内資料:健康成人における生物学的同等性試験(2017/3/30承認、申請資料概要2.7.1.3)
- Carchman,S.H.et al., J Clin Pharmacol., 27, 762-767, (1987) »PubMed
- 社内資料:健康成人における反復経口投与後の代謝物検索(2017/3/30承認、申請資料概要2.7.2.3)
- 社内資料:責任代謝酵素同定試験(2017/3/30承認、申請資料概要2.7.2.2)
- Kirch,W.et al., Clin Pharmacokinet., 5, 476-483, (1980) »PubMed
- 社内資料:薬物相互作用試験−ケトコナゾール−(2017/3/30承認、申請資料概要2.7.6.4)
- 社内資料:薬物相互作用試験−リファンピシン−(2017/3/30承認、申請資料概要2.7.6.5)
- 社内資料:薬物相互作用試験−メチルフェニデート−(2017/3/30承認、申請資料概要2.7.6.6)
- 市川宏伸ほか, 臨床精神薬理, 21, 1093-1117, (2018)
- 社内資料:小児AD/HD患者の第2/3相長期投与試験(2017/3/30承認、申請資料概要2.7.6.20)
- 社内資料:成人AD/HD患者の第3相試験(2019/6/18承認、申請資料概要2.7.6.2)
- 社内資料:成人AD/HD患者の第3相長期投与試験(2019/6/18承認、申請資料概要2.7.6.3)
- 社内資料:QT/QTc評価試験(2017/3/30承認、申請資料概要2.7.6.8)
- 社内資料:ヒトα2アドレナリン受容体親和性及び選択性(2017/3/30承認、申請資料概要2.6.2.2)
- 社内資料:脳内局所作用(2017/3/30承認、申請資料概要2.6.2.3)
- 社内資料:in vivo薬理試験(2017/3/30承認、申請資料概要2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
武田薬品工業株式会社
くすり相談室
〒103-8668
東京都中央区日本橋本町二丁目1番1号
電話:フリーダイヤル 0120-566-587 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
製品情報問い合わせ先
武田薬品工業株式会社
くすり相談室
〒103-8668
東京都中央区日本橋本町二丁目1番1号
電話:フリーダイヤル 0120-566-587 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
武田薬品工業株式会社
〒540-8645
大阪市中央区道修町四丁目1番1号