医薬品情報
| 総称名 | フルティフォーム |
|---|---|
| 一般名 | フルチカゾンプロピオン酸エステル ホルモテロールフマル酸塩水和物 |
| 欧文一般名 | Fluticasone Propionate Formoterol Fumarate Hydrate |
| 製剤名 | フルチカゾンプロピオン酸エステル/ホルモテロールフマル酸塩水和物吸入剤 |
| 薬効分類名 | 喘息治療配合剤 |
| 薬効分類番号 | 2290 |
| ATCコード | R03AK11 |
| KEGG DRUG |
D10506
フルチカゾンプロピオン酸エステル・ホルモテロールフマル酸塩水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年9月 改訂(再審査結果)(第7版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| フルティフォーム50エアゾール56吸入用 | Flutiform Aerosol | 杏林製薬 | 2290802G1023 | 2017.7円/瓶 | 処方箋医薬品注) |
| フルティフォーム50エアゾール120吸入用 | Flutiform Aerosol | 杏林製薬 | 2290802G3026 | 4169円/瓶 | 処方箋医薬品注) |
| フルティフォーム125エアゾール56吸入用 | Flutiform Aerosol | 杏林製薬 | 2290802G2020 | 2176.4円/瓶 | 処方箋医薬品注) |
| フルティフォーム125エアゾール120吸入用 | Flutiform Aerosol | 杏林製薬 | 2290802G4022 | 4340.4円/瓶 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 有効な抗菌剤の存在しない感染症、深在性真菌症の患者[ステロイドの作用により症状を増悪させるおそれがある。]
2.2 本剤の成分に対して過敏症の既往歴のある患者
2.3 デスモプレシン酢酸塩水和物(男性における夜間多尿による夜間頻尿)を投与中の患者[10.1参照]
4. 効能または効果
気管支喘息
(吸入ステロイド剤及び長時間作動型吸入β2刺激剤の併用が必要な場合)
(吸入ステロイド剤及び長時間作動型吸入β2刺激剤の併用が必要な場合)
5. 効能または効果に関連する注意
5.1 患者、保護者又はそれに代わる適切な者に対し次の注意を与えること。
本剤は発現した発作を速やかに軽減する薬剤ではないので、急性の発作に対しては使用しないこと。
5.2 本剤の投与開始前には、患者の喘息症状を比較的安定な状態にしておくこと。特に、喘息発作重積状態又は喘息の急激な悪化状態のときには原則として本剤は使用しないこと。
6. 用法及び用量
フルティフォーム50エアゾール56吸入用
成人
通常、成人には、フルティフォーム50エアゾール(フルチカゾンプロピオン酸エステルとして50μg及びホルモテロールフマル酸塩水和物として5μg)を1回2吸入、1日2回投与する。
なお、症状に応じてフルティフォーム125エアゾール(フルチカゾンプロピオン酸エステルとして125μg及びホルモテロールフマル酸塩水和物として5μg)を1回2〜4吸入、1日2回投与する。
なお、症状に応じてフルティフォーム125エアゾール(フルチカゾンプロピオン酸エステルとして125μg及びホルモテロールフマル酸塩水和物として5μg)を1回2〜4吸入、1日2回投与する。
小児
通常、小児には、フルティフォーム50エアゾール(フルチカゾンプロピオン酸エステルとして50μg及びホルモテロールフマル酸塩水和物として5μg)を1回2吸入、1日2回投与する。
フルティフォーム50エアゾール120吸入用
成人
通常、成人には、フルティフォーム50エアゾール(フルチカゾンプロピオン酸エステルとして50μg及びホルモテロールフマル酸塩水和物として5μg)を1回2吸入、1日2回投与する。
なお、症状に応じてフルティフォーム125エアゾール(フルチカゾンプロピオン酸エステルとして125μg及びホルモテロールフマル酸塩水和物として5μg)を1回2〜4吸入、1日2回投与する。
なお、症状に応じてフルティフォーム125エアゾール(フルチカゾンプロピオン酸エステルとして125μg及びホルモテロールフマル酸塩水和物として5μg)を1回2〜4吸入、1日2回投与する。
小児
通常、小児には、フルティフォーム50エアゾール(フルチカゾンプロピオン酸エステルとして50μg及びホルモテロールフマル酸塩水和物として5μg)を1回2吸入、1日2回投与する。
フルティフォーム125エアゾール56吸入用
成人
通常、成人には、フルティフォーム50エアゾール(フルチカゾンプロピオン酸エステルとして50μg及びホルモテロールフマル酸塩水和物として5μg)を1回2吸入、1日2回投与する。
なお、症状に応じてフルティフォーム125エアゾール(フルチカゾンプロピオン酸エステルとして125μg及びホルモテロールフマル酸塩水和物として5μg)を1回2〜4吸入、1日2回投与する。
なお、症状に応じてフルティフォーム125エアゾール(フルチカゾンプロピオン酸エステルとして125μg及びホルモテロールフマル酸塩水和物として5μg)を1回2〜4吸入、1日2回投与する。
フルティフォーム125エアゾール120吸入用
成人
通常、成人には、フルティフォーム50エアゾール(フルチカゾンプロピオン酸エステルとして50μg及びホルモテロールフマル酸塩水和物として5μg)を1回2吸入、1日2回投与する。
なお、症状に応じてフルティフォーム125エアゾール(フルチカゾンプロピオン酸エステルとして125μg及びホルモテロールフマル酸塩水和物として5μg)を1回2〜4吸入、1日2回投与する。
なお、症状に応じてフルティフォーム125エアゾール(フルチカゾンプロピオン酸エステルとして125μg及びホルモテロールフマル酸塩水和物として5μg)を1回2〜4吸入、1日2回投与する。
7. 用法及び用量に関連する注意
症状の緩解がみられた場合は、治療上必要最小限の用量を投与し、必要に応じ吸入ステロイド剤への切り替えも考慮すること。
8. 重要な基本的注意
8.1 本剤は既に起きている気管支喘息の発作を速やかに軽減する薬剤ではないので、毎日規則正しく使用すること。
8.2 過度に本剤の使用を続けた場合、不整脈、場合により心停止を起こすおそれがあるので、用法・用量を超えて投与しないよう注意すること。また、患者に対し、過度の使用による危険性について理解させ、用法・用量を超えて使用しないよう注意を与えること。[13.1参照]
8.3 本剤の投与期間中に発現する急性の発作に対しては、短時間作動型吸入β2刺激剤等の他の適切な薬剤を使用するよう患者に注意を与えること。また、その薬剤の使用量が増加したり、あるいは効果が十分でなくなってきた場合には、喘息の管理が十分でないことが考えられるので、可及的速やかに医療機関を受診し医師の治療を求めるよう患者に注意を与えること。そのような状態では患者の生命が脅かされる可能性があるので、患者の症状に応じてステロイド療法の強化(本剤のより高用量製剤への変更等)を考慮すること。
8.4 感染を伴う喘息症状の増悪がみられた場合には、ステロイド療法の強化と感染症の治療を考慮すること。
8.5 本剤の投与を突然中止すると喘息の急激な悪化を起こすことがあるので、投与を中止する場合には患者の喘息症状を観察しながら徐々に減量すること。
8.6 全身性ステロイド剤と比較し可能性は低いが、吸入ステロイド剤の投与により全身性の作用(クッシング症候群、クッシング様症状、副腎皮質機能抑制、小児の成長遅延、骨密度の低下、白内障、緑内障を含む)が発現する可能性があるので、吸入ステロイド剤の投与量は患者毎に喘息をコントロールできる最少用量に調節すること。特に長期間、大量投与の場合には定期的に検査を行い、全身性の作用が認められた場合には患者の喘息症状を観察しながら徐々に減量するなど適切な処置を行うこと。
8.7 全身性ステロイド剤の減量は本剤吸入開始後症状の安定をみて徐々に行うこと。減量にあたっては一般のステロイド剤の減量法に準ずること。
8.8 本剤を含む吸入ステロイド剤投与後に、潜在していた基礎疾患である好酸球性多発血管炎性肉芽腫症にみられる好酸球増多症がまれにあらわれることがある。この症状は通常、全身性ステロイド剤の減量並びに離脱に伴って発現しており、本剤との直接的な因果関係は確立されていない。本剤の投与期間中は、好酸球数の推移や、他の好酸球性多発血管炎性肉芽腫症の症状(しびれ、発熱、関節痛、肺の浸潤等の血管炎症状等)に注意すること。
8.9 全身性ステロイド剤の減量並びに離脱に伴って、鼻炎、湿疹、蕁麻疹、めまい、動悸、倦怠感、顔のほてり、結膜炎等の症状が発現・増悪することがあるので、このような症状があらわれた場合には適切な処置を行うこと。
8.10 本剤は患者の喘息症状に応じて最適な用量を選択する必要があるため、本剤の投与期間中は患者を定期的に診察すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 結核性疾患の患者
ステロイドの作用により症状を増悪させるおそれがある。
9.1.2 感染症(有効な抗菌剤の存在しない感染症、深在性真菌症を除く)の患者
ステロイドの作用により症状を増悪させるおそれがある。
9.1.3 甲状腺機能亢進症の患者
甲状腺ホルモンの分泌を亢進させるおそれがある。
9.1.4 高血圧の患者
血圧を上昇させるおそれがある。
9.1.5 心疾患のある患者
β1作用により症状を増悪させるおそれがある。
9.1.6 糖尿病の患者
グリコーゲン分解作用及びステロイドの作用により症状を増悪させるおそれがある。
9.1.7 低カリウム血症の患者
Na+/K+ATPaseを活性化し細胞外カリウムを細胞内へ移動させることにより低カリウム血症を増悪させるおそれがある。[11.1.2参照]
9.1.8 気管支粘液の分泌が著しい患者
本剤の肺内での作用を確実にするため、本剤の吸入に先立って、分泌がある程度減少するまで他剤を使用すること。
9.1.9 長期又は大量の全身性ステロイド療法を受けている患者
全身性ステロイド剤の減量中並びに離脱後も副腎皮質機能検査を行い、外傷、手術、重症感染症等の侵襲には十分に注意を払うこと。また、必要があれば一時的に全身性ステロイド剤の増量を行うこと。これらの患者では副腎皮質機能不全となっていることが考えられる。
9.1.10 低酸素血症の患者
血清カリウム値をモニターすることが望ましい。低酸素血症は血清カリウム値の低下が心リズムに及ぼす作用を増強することがある。[11.1.2参照]
9.3 肝機能障害患者
9.3.1 重度の肝機能障害患者
本剤の成分であるフルチカゾンプロピオン酸エステル及びホルモテロールはいずれも主に肝臓で代謝されるため、血中濃度が上昇する。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。フルチカゾンプロピオン酸エステル1.6μg/kg以上/ホルモテロールフマル酸塩水和物0.16μg/kg以上をウサギに吸入投与したときに、胎児の発育抑制及び催奇形性が認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ラットにおいて、フルチカゾンプロピオン酸エステル及びホルモテロールは乳汁への移行が報告されている。
9.7 小児等
9.7.1 長期間投与する場合には、身長等の経過の観察を十分行うこと。また使用にあたっては、使用法を正しく指導すること。全身ステロイド剤と比較し可能性は低いが、吸入ステロイド剤を特に長期間、大量に投与する場合に成長遅延をきたすおそれがある。なお、小児等に対しては国内での24週間を超える臨床試験は実施していない。
9.7.2 低出生体重児、新生児、乳児又は5歳未満の幼児を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
相互作用序文
フルチカゾンプロピオン酸エステルは、主として肝チトクロームP-450 3A4(CYP3A4)で代謝される。[16.4参照]
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
| デスモプレシン酢酸塩水和物 ミニリンメルト(男性における夜間多尿による夜間頻尿) [2.3参照] | 低ナトリウム血症が発現するおそれがある。 | 機序不明。 |
10.2 併用注意
| CYP3A4阻害作用を有する薬剤 リトナビル等 | 副腎皮質ステロイド剤を全身投与した場合と同様の症状があらわれる可能性がある。 特に、リトナビルとフルチカゾンプロピオン酸エステル製剤の併用により、クッシング症候群、副腎皮質機能抑制等が報告されている。 | CYP3A4による代謝が阻害されることにより、フルチカゾンプロピオン酸エステルの血中濃度が上昇する可能性がある。 |
| カテコールアミン アドレナリン イソプレナリン等 | 不整脈、場合によっては心停止を起こすおそれがあるので、副作用の発現に注意し、異常が認められた場合には減量又は投与を中止するなど適切な処置を行うこと。 | 併用により、アドレナリン作動性神経刺激の増大が起きる。 そのため、不整脈を起こすことがある。 |
| キサンチン誘導体 テオフィリン アミノフィリン等 [11.1.2参照] | 低カリウム血症による不整脈を起こすおそれがある。血清カリウム値のモニターを行うことが望ましい。 | キサンチン誘導体はアドレナリン作動性神経刺激を増大させるため、血清カリウム値の低下を増強することがある。 |
| ステロイド剤 プレドニゾロン ベタメタゾン等 [11.1.2参照] | 低カリウム血症による不整脈を起こすおそれがある。血清カリウム値のモニターを行うことが望ましい。 | ステロイド剤及び利尿剤は尿細管でのカリウム排泄促進作用があるため、血清カリウム値の低下が増強することが考えられる。 |
| 利尿剤 フロセミド等 [11.1.2参照] | 低カリウム血症による不整脈を起こすおそれがある。血清カリウム値のモニターを行うことが望ましい。 | ステロイド剤及び利尿剤は尿細管でのカリウム排泄促進作用があるため、血清カリウム値の低下が増強することが考えられる。 |
| β遮断剤 アテノロール等 | ホルモテロールの作用を減弱する可能性がある。 | β受容体において競合的に拮抗する。 |
| QT間隔延長を起こすことが知られている薬剤 抗不整脈剤 三環系抗うつ剤等 | QT間隔が延長され心室性不整脈等のリスクが増大するおそれがある。 | いずれもQT間隔を延長させる可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(呼吸困難、気管支攣縮、全身潮紅、血管浮腫、蕁麻疹等)があらわれることがある。
11.1.2 重篤な血清カリウム値低下(頻度不明)
11.1.3 肺炎(0.42%)
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 口腔・呼吸器 | 嗄声 | 口腔・呼吸器感染症、口腔・咽喉頭症状(疼痛、不快感)、喘息、口内炎 | 口腔内乾燥 | 咳嗽、味覚異常 |
| 消化器 | 悪心、嘔吐 | |||
| 循環器 | 不整脈、動悸 | 心電図異常、高血圧 | ||
| 肝臓 | γ-GTP増加、ALT増加、血中ビリルビン増加 | |||
| 精神神経系 | 振戦、めまい | |||
| 過敏症 | 発疹・蕁麻疹 | |||
| その他 | CK増加 | 血中コルチゾール減少、白血球数増加、倦怠感、筋痙縮、胸部不快感 |
13. 過量投与
13.1 症状
ホルモテロールフマル酸塩水和物の過量投与により、動悸、頻脈、不整脈、振戦、頭痛及び筋痙攣等、β刺激剤の薬理学的作用による全身作用が発現する可能性がある。また、重篤な症状として、血圧低下、代謝性アシドーシス、低カリウム血症、高血糖、心室性不整脈あるいは心停止等が発現する可能性がある。
13.2 処置
過量投与後に本剤を減量する際は、患者の管理を十分に行いながら徐々に行うこと。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 吸入前
(1)本剤の投与にあたって、吸入器の操作法、吸入法等を十分に説明すること。
(2)エアゾール剤の噴霧と吸入の同調が難しいと考えられる患者にはスペーサー(吸入用補助器)を使用させることが望ましい。
14.1.2 吸入時
良く振ってから使用させること。
14.1.3 吸入後
口腔カンジダ症又は嗄声の予防のため、本剤吸入後に、うがいを実施するよう患者を指導すること。ただし、うがいが困難な患者には、うがいではなく口腔内をすすぐよう指導すること。
14.1.4 保管時
(1)内側のアルミ容器をアダプターから外さないこと。
(2)噴霧口のつまりを避けるため、少なくとも週1回以上アダプターの吸入口の外側と内側を乾いた布やティッシュペーパーでよく拭き、清潔に保管すること。
(3)アルミ容器は絶対に濡らさないこと(噴霧口がつまる原因となる)。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人への単回投与
健康成人男子各12例にそれぞれ、フルティフォーム50エアゾール1回2吸入(フルチカゾンプロピオン酸エステル100μg/ホルモテロールフマル酸塩水和物10μg)又はフルティフォーム125エアゾール1回4吸入(フルチカゾンプロピオン酸エステル500μg/ホルモテロールフマル酸塩水和物20μg)を1日2回、7日間反復投与したときの初回投与後のフルチカゾンプロピオン酸エステル及びホルモテロールの血漿中濃度は、いずれも速やかに最高濃度(Cmax)に達した1)。
図1 フルチカゾンプロピオン酸エステル/ホルモテロールフマル酸塩水和物を単回吸入投与後の血漿中フルチカゾンプロピオン酸エステル濃度
(n=12 平均値±標準偏差 #:n=11 ##:n=9)
図2 フルチカゾンプロピオン酸エステル/ホルモテロールフマル酸塩水和物を単回吸入投与後の血漿中ホルモテロール濃度
(n=12 平均値±標準偏差 #:n=11 ##:n=10)
| 成分名 投与量(μg) | Cmax(pg/mL) | tmax(hr) | AUC0-12(pg・hr/mL) | t1/2(hr) |
| フルティフォーム50エアゾール 1回2吸入 | ||||
| フルチカゾンプロピオン酸エステル100 | 21.3±5.68 | 0.0833(0.0833,0.250) | 92.0±40.4 | 7.43±2.80 |
| ホルモテロールフマル酸塩水和物10 | 8.43±4.13 | 0.125(0.0833,0.167) | 23.9±7.68 | 4.63±2.39 |
| フルティフォーム125エアゾール 1回4吸入 | ||||
| フルチカゾンプロピオン酸エステル500 | 70.9±19.5 | 0.0833(0.0833,0.500) | 395±155 | 8.29±1.79 |
| ホルモテロールフマル酸塩水和物20 | 26.3±15.9 | 0.0833(0.0833,0.167) | 64.4±26.5 | 4.54±1.08 |
16.1.2 健康成人への反復投与
健康成人男子各12例にそれぞれ、フルティフォーム50エアゾール1回2吸入(フルチカゾンプロピオン酸エステル100μg/ホルモテロールフマル酸塩水和物10μg)又はフルティフォーム125エアゾール1回4吸入(フルチカゾンプロピオン酸エステル500μg/ホルモテロールフマル酸塩水和物20μg)を1日2回、7日間反復投与したとき、フルチカゾンプロピオン酸エステル及びホルモテロールのCmax及びAUC0-12は、投与7日目には定常状態に達していると考えられ、単回投与に比べ、いずれの用量も2〜3倍であった。
7日間反復投与後のフルチカゾンプロピオン酸エステル及びホルモテロールのCmax及びAUC0-12は、ほぼ投与量に比例して増加し、また、半減期はそれぞれ約15時間及び約10時間であった1)。
7日間反復投与後のフルチカゾンプロピオン酸エステル及びホルモテロールのCmax及びAUC0-12は、ほぼ投与量に比例して増加し、また、半減期はそれぞれ約15時間及び約10時間であった1)。
| 成分名 1回投与量(μg) | Cmax(pg/mL) | tmax(hr) | AUC0-12(pg・hr/mL) | t1/2(hr) |
| フルティフォーム50エアゾール 1回2吸入 | ||||
| フルチカゾンプロピオン酸エステル100 | 37.9±10.7 | 0.0833(0.0833,0.0833) | 228±91.2 | 14.2±3.45 |
| ホルモテロールフマル酸塩水和物10 | 13.2±4.31 | 0.0833(0.0833,1.00) | 44.4±6.62 | 8.96±3.03 |
| フルティフォーム125エアゾール 1回4吸入 | ||||
| フルチカゾンプロピオン酸エステル500 | 162±67.8 | 0.0833(0.0833,0.500) | 1240±681 | 16.7±2.98 |
| ホルモテロールフマル酸塩水和物20 | 35.1±18.5 | 0.0833(0.0833,0.167) | 111±33.2 | 11.6±3.46 |
16.3 分布
16.4 代謝
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相単盲検比較試験(成人)
成人気管支喘息患者455例を対象にした無作為化単盲検並行群間比較試験において、フルティフォーム50エアゾール1回2吸入(フルチカゾンプロピオン酸エステル100μg/ホルモテロールフマル酸塩水和物10μg)、又は実薬対照としてフルチカゾンプロピオン酸エステル100μgを1日2回、8週間投与した時の結果は下表の通りであった7)。
副作用発現頻度は本剤投与群で9.6%(22/228例)、対照薬投与群で6.2%(14/227例)であった。主な副作用は、本剤投与群で発声障害2.2%(5/228例)、CK増加1.8%(4/228例)、動悸0.9%(2/228例)であった。
副作用発現頻度は本剤投与群で9.6%(22/228例)、対照薬投与群で6.2%(14/227例)であった。主な副作用は、本剤投与群で発声障害2.2%(5/228例)、CK増加1.8%(4/228例)、動悸0.9%(2/228例)であった。
| 薬剤(1回投与量) | ベースライン | 投与8週間後までの平均値 | 変化量 | 群間差 [両側95%信頼区間]a) p値a) |
| フルティフォーム50エアゾール1回2吸入(フルチカゾンプロピオン酸エステル100μg/ホルモテロールフマル酸塩水和物10μg) | 349.7±84.8(228) | 380.2±90.3(228) | 30.5±30.1(228) | 20.63 [15.47,25.80] p<0.0001 |
| 対照(フルチカゾンプロピオン酸エステル100μg) | 344.2±81.0(227) | 353.6±81.1(226) | 9.9±25.9(226) |
17.1.2 国内第III相長期投与試験(成人)
成人気管支喘息患者244例を対象とした長期投与試験において、観察期間中に使用した吸入ステロイド剤の用量に基づき、フルティフォーム50エアゾール1回2吸入(フルチカゾンプロピオン酸エステル100μg/ホルモテロールフマル酸塩水和物10μg)、フルティフォーム125エアゾール1回2吸入(フルチカゾンプロピオン酸エステル250μg/ホルモテロールフマル酸塩水和物10μg)、又はフルティフォーム125エアゾール1回4吸入(フルチカゾンプロピオン酸エステル500μg/ホルモテロールフマル酸塩水和物20μg)の3用量のいずれかを1日2回で投与を開始し、症状に応じて増量減量を可能として、52週間投与した。肺機能に関する評価指標の推移は下図の通りであった8)。
本剤100/10μg〜500/20μg投与における副作用発現頻度は32.4%(79/244例)であった。主な副作用は、発声障害8.2%(20/244例)、CK増加及び喘息2.5%(6/244例)、動悸、口内炎、咽頭炎及び口腔咽頭不快感1.6%(4/244例)、鼻咽頭炎、血中コルチゾール減少及びγ-GTP増加1.2%(3/244例)であった。
本剤100/10μg〜500/20μg投与における副作用発現頻度は32.4%(79/244例)であった。主な副作用は、発声障害8.2%(20/244例)、CK増加及び喘息2.5%(6/244例)、動悸、口内炎、咽頭炎及び口腔咽頭不快感1.6%(4/244例)、鼻咽頭炎、血中コルチゾール減少及びγ-GTP増加1.2%(3/244例)であった。
図1 朝のピークフロー値の推移(平均値±標準誤差)
17.1.3 国内第III相非盲験クロスオーバー比較試験(小児)
小児気管支喘息患者87例を対象として、フルティフォーム50エアゾール1回2吸入(フルチカゾンプロピオン酸エステル100μg/ホルモテロールフマル酸塩水和物10μg)、又は実薬対照としてフルチカゾンプロピオン酸エステル100μg/サルメテロールキシナホ酸塩50μgをそれぞれ1日2回、2週間投与する無作為化非盲験クロスオーバー比較試験を実施した時の結果(PPS)は下表の通りであった。投与2週間後の朝のピークフロー値のベースラインからの変化量において対照薬に対する本剤の非劣性が示された9)。
副作用発現頻度は本剤投与群で2.5%(2/81例)、対照薬投与群で0%(0/86例)であった。副作用は、本剤投与群で頭痛及び振戦1.2%(1/81例)であった。
副作用発現頻度は本剤投与群で2.5%(2/81例)、対照薬投与群で0%(0/86例)であった。副作用は、本剤投与群で頭痛及び振戦1.2%(1/81例)であった。
| 薬剤(1回投与量) | ベースラインa) | 投与2週時b) | ベースラインからの変化量c) | 群間差 [両側95%信頼区間]c) |
| フルティフォーム50エアゾール1回2吸入(フルチカゾンプロピオン酸エステル100μg/ホルモテロールフマル酸塩水和物10μg) | 215.4±71.3(81) | 233.5±78.1(76) | 20.1±3.1(76) | 0.93 [−4.57,6.43]d) |
| 対照(フルチカゾンプロピオン酸エステル100μg/サルメテロールキシナホ酸塩50μg) | 231.0±75.6(79) | 19.1±3.1(79) |
17.1.4 国内第III相長期投与試験(小児)
小児気管支喘息患者53例を対象として、フルティフォーム50エアゾール1回2吸入(フルチカゾンプロピオン酸エステル100μg/ホルモテロールフマル酸塩水和物10μg)を1日2回、24週間投与した。投与24週間後の朝のピークフロー値のベースラインからの変化量は21.4L/minであった10)。
副作用発現頻度は9.4%(5/53例)であった。副作用は、コルチゾール減少3.8%(2/53例)、口内炎、尿中蛋白陽性及び口腔咽頭不快感1.9%(1/53例)であった。
副作用発現頻度は9.4%(5/53例)であった。副作用は、コルチゾール減少3.8%(2/53例)、口内炎、尿中蛋白陽性及び口腔咽頭不快感1.9%(1/53例)であった。
18. 薬効薬理
18.1 作用機序
フルチカゾンは合成副腎皮質ステロイドであり、グルココルチコイド受容体を介した抗炎症作用により、気管支喘息の症状を改善する。ホルモテロールはβ2受容体を刺激して細胞内cAMPを上昇させ、平滑筋を弛緩させて気管支を拡張し、気管支喘息の症状を改善する。
フルチカゾンとホルモテロールの相乗作用の機序として、フルチカゾンで誘導されるグルココルチコイド応答配列(GRE)依存性転写活性をホルモテロールが増強することが示されている。
18.2 グルココルチコイド受容体親和性
18.3 抗炎症作用
<フルチカゾン>
18.4 β2受容体親和性及び選択性
<ホルモテロール>
ホルモテロールのβ2受容体に対する親和性はヒト受容体発現細胞では8.63(−logKD)であった。また、β2受容体に対する親和性はβ1受容体及びβ3受容体(それぞれの−logKD:6.11及び5.82)の331倍及び646倍であった15)(in vitro)。
18.5 喘息様症状に対する作用
<ホルモテロール>
ホルモテロールの吸入投与は、モルモットにおけるヒスタミン誘発型喘息様症状を抑制し、ED50は経口投与の1/22であった16)。
18.6 気道収縮反応に対する作用
<ホルモテロール>
ホルモテロールの吸入投与は、抗原(OVA)を感作させ、同抗原で誘発したモルモットにおけるIAR(即時性の喘息様反応)及びLAR(遅発性の喘息反応)の気道のコンダクタンス(SGaw)低下を抑制し、BALF中の総細胞数、マクロファージ、好酸球、好中球及びリンパ球数の増加を抑制した17)。
18.7 相乗作用
<フルチカゾンとホルモテロール>
ホルモテロールは、ヒト気管上皮細胞株(BEAS-2B)のフルチカゾンで誘導されるGRE依存性転写活性を増強した18)(in vitro)。
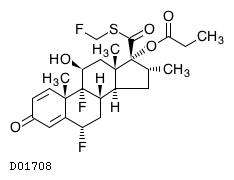
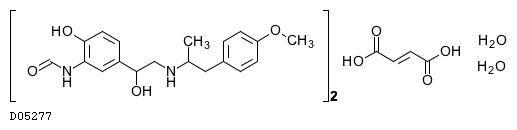
19. 有効成分に関する理化学的知見
19.1. フルチカゾンプロピオン酸エステル
19.2. ホルモテロールフマル酸塩水和物
20. 取扱い上の注意
20.1 30℃以上の場所に保管しないこと。
20.2 アルミ容器は火中に投入しないこと。
20.3 地方自治体により定められたアルミ容器の廃棄処理法に従うこと。
22. 包装
<フルティフォーム50エアゾール56吸入用>
吸入器:1個
<フルティフォーム50エアゾール120吸入用>
吸入器:1個
<フルティフォーム125エアゾール56吸入用>
吸入器:1個
<フルティフォーム125エアゾール120吸入用>
吸入器:1個
23. 主要文献
- 社内資料:フルティフォームの第I相臨床薬理試験(2013年9月20日承認、CTD2.7.6.2.1)
- Daniel,M.J.et al., 基礎と臨床, 26 (6), 2011-2030, (1992)
- Cheer,S.M.et al., Am.J.Respir.Med., 1 (4), 285-300, (2002) »PubMed »DOI
- Pearce,R.E.et al., Drug Metab.Dispos., 34, 1035-1040, (2006) »PubMed
- Harding,S.M., Respir.Med., 84, 25-29, (1990) »PubMed »DOI
- Rosenborg,J.et al., Drug Metab.Dispos., 27 (10), 1104-1116, (1999) »PubMed
- 大田健,他, アレルギー・免疫, 20, 1671-1685, (2013)
- 東田有智,他, アレルギー・免疫, 20, 1686-1704, (2013)
- 社内資料:KRP-108第III相比較試験−小児気管支喘息患者を対象としたKRP-108の非盲検、実薬対照、クロスオーバー比較試験−(2020年6月29日承認、CTD2.5.4.3.1)
- 社内資料:KRP-108第III相長期試験−小児気管支喘息患者を対象としたKRP-108の非盲検、非対照、長期投与試験−(2020年6月29日承認、CTD2.5.4.5.1)
- Johnson,M.et al., J.Allergy Clin.Immunol., 101, S434-S439, (1998)
- Valotis,A.et al., Respir.Res., 8, 54, (2007) »PubMed
- Johnson,M.et al., Int.Arch.Allergy Immunol., 107, 439-440, (1995) »PubMed
- Lawrence,T.E.et al., J.Pharmacol.Exp.Ther., 284, 222-227, (1998) »PubMed
- Baker,J.G., Br.J.Pharmacol., 160, 1048-1061, (2010) »PubMed
- Ida,H., Arzneim.Forsch., 26, 1337-1340, (1976) »PubMed
- Sugiyama,H.et al., J.Allergy Clin.Immunol., 89, 858-866, (1992) »PubMed
- Kaur,M.et al., Mol.Pharamacol., 73, 203-214, (2008)
24. 文献請求先及び問い合わせ先
文献請求先
杏林製薬株式会社
くすり情報センター
〒160-0017
東京都新宿区左門町20番地
電話:0120-409-341 受付時間 9:00〜17:30(土・日・祝日・会社休日を除く)
製品情報問い合わせ先
杏林製薬株式会社
くすり情報センター
〒160-0017
東京都新宿区左門町20番地
電話:0120-409-341 受付時間 9:00〜17:30(土・日・祝日・会社休日を除く)
26. 製造販売業者等
26.1 製造販売元
杏林製薬株式会社
東京都千代田区大手町一丁目3番7号