医薬品情報
| 総称名 | タシグナ |
|---|---|
| 一般名 | ニロチニブ塩酸塩水和物 |
| 欧文一般名 | Nilotinib Hydrochloride Hydrate |
| 製剤名 | ニロチニブ塩酸塩水和物カプセル |
| 薬効分類名 | 抗悪性腫瘍剤(チロシンキナーゼインヒビター) |
| 薬効分類番号 | 4291 |
| ATCコード | L01EA03 |
| KEGG DRUG |
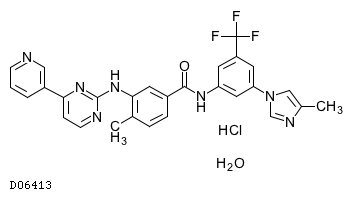
D06413
ニロチニブ塩酸塩水和物
|
| KEGG DGROUP |
DG00716
ニロチニブ
DG03161
BCR-ABL阻害薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年7月 改訂(再審査結果)(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| タシグナカプセル50mg | Tasigna Capsules | ノバルティスファーマ | 4291021M3023 | 899.2円/カプセル | 劇薬, 処方箋医薬品 |
| タシグナカプセル150mg | Tasigna Capsules | ノバルティスファーマ | 4291021M2027 | 2257円/カプセル | 劇薬, 処方箋医薬品 |
| タシグナカプセル200mg | Tasigna Capsules | ノバルティスファーマ | 4291021M1020 | 3056.3円/カプセル | 劇薬, 処方箋医薬品 |
1. 警告
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
慢性期又は移行期の慢性骨髄性白血病
5. 効能または効果に関連する注意
5.1 染色体検査又は遺伝子検査により慢性骨髄性白血病と診断された患者に使用すること。
5.2 「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
5.3 イマチニブ抵抗性の慢性骨髄性白血病患者に対する本剤の投与は、イマチニブで効果不十分又はイマチニブに忍容性のない患者を対象とすること。
6. 用法及び用量
通常、成人にはニロチニブとして1回400mgを食事の1時間以上前又は食後2時間以降に1日2回、12時間毎を目安に経口投与する。ただし、初発の慢性期の慢性骨髄性白血病の場合には、1回投与量は300mgとする。なお、患者の状態により適宜減量する。
通常、小児には体表面積に合わせて次の投与量(ニロチニブとして1回約230mg/m2)を食事の1時間以上前又は食後2時間以降に1日2回、12時間毎を目安に経口投与する。なお、患者の状態により適宜減量する。
| 体表面積 | 1回投与量 |
| 0.32m2以下 | 50mg |
| 0.33〜0.54m2 | 100mg |
| 0.55〜0.76m2 | 150mg |
| 0.77〜0.97m2 | 200mg |
| 0.98〜1.19m2 | 250mg |
| 1.20〜1.41m2 | 300mg |
| 1.42〜1.63m2 | 350mg |
| 1.64m2以上 | 400mg |
7. 用法及び用量に関連する注意
7.1 成人における本剤の用法・用量は、「17.臨床成績」の項の内容を熟知した上で、患者の状態や化学療法歴に応じて選択すること。
7.2 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.3 食後に本剤を投与した場合、本剤の血中濃度が増加するとの報告がある。食事の影響を避けるため食事の1時間前から食後2時間までの間の服用は避けること。[16.2.1参照]
7.4 副作用により、本剤を休薬、減量又は中止する場合には、副作用の症状、重症度等に応じて以下の基準を考慮すること。
7.4.1 血液系の副作用と投与量調節の基準
白血病に関連しない好中球減少、血小板減少、貧血(ヘモグロビン低下)が認められた場合は、次表を参考に投与量を調節すること。[11.1.1参照]
| 休薬・減量基準 | 投与量調節 | |
| 300mg1日2回投与中の初発の慢性期の慢性骨髄性白血病(CML) | 好中球数<1,000/mm3 又は 血小板数<50,000/mm3 又は ヘモグロビン<8.0g/dL | 1. 好中球数1,500/mm3以上又は血小板数75,000/mm3以上又はヘモグロビン10.0g/dL以上に回復するまで休薬する。 2. 2週間以内に回復した場合は、300mg1日2回の用量で再開する。 3. 2週間以内に回復しなかった場合は、患者の状態により、400mg1日1回に減量する。 |
| 400mg1日2回投与中のイマチニブ抵抗性の慢性期CML | 好中球数<1,000/mm3 又は 血小板数<50,000/mm3 | 1. 好中球数1,000/mm3以上又は血小板数50,000/mm3以上に回復するまで休薬する。 2. 2週間以内に回復した場合は、400mg1日2回の用量で再開する。 3. 2週間以内に回復しなかった場合は、患者の状態により、400mg1日1回に減量する。 |
| 400mg1日2回投与中のイマチニブ抵抗性の移行期CML | 好中球数<500/mm3 又は 血小板数<10,000/mm3 | 1. 好中球数1,000/mm3以上又は血小板数20,000/mm3以上に回復するまで休薬する。 2. 2週間以内に回復した場合は、400mg1日2回の用量で再開する。 3. 2週間以内に回復しなかった場合は、患者の状態により、400mg1日1回に減量する。 |
| 小児のCML | 好中球数<1,000/mm3 又は 血小板数<50,000/mm3 | 1. 好中球数1,500/mm3以上又は血小板数75,000/mm3以上に回復するまで休薬する。 2. 2週間以内に回復した場合は、230mg/m21日2回の用量で再開する。 3. 2週間以内に回復しなかった場合は、患者の状態により、230mg/m21日1回に減量する。 4. 減量後に再発した場合は、本剤の投与を中止する。 |
7.4.2 非血液系の副作用と投与量調節の基準
肝機能検査値(ビリルビン、AST、ALT)、膵機能検査値(リパーゼ)の上昇、QT間隔延長及びその他の非血液系の副作用が認められた場合は、次表を参考に投与量を調節すること。[1.2、8.2、8.5、11.1.2、11.1.10、11.1.11参照]
(1)初発の慢性期の慢性骨髄性白血病
| 休薬・減量基準 | 投与量調節 | |
| 肝機能検査値 (ビリルビン、AST、ALT) | ビリルビン値>施設正常値上限の1.5倍かつ≦3倍 又は AST値、ALT値>施設正常値上限の2.5倍かつ≦5倍 | 1. ビリルビン値が施設正常値上限の1.5倍未満に、AST、ALT値が2.5倍未満に低下するまで本剤を休薬する。 2. 300mg1日2回の用量で再開する。 |
| ビリルビン値>施設正常値上限の3倍 又は AST値、ALT値>施設正常値上限の5倍 | 1. ビリルビン値が施設正常値上限の1.5倍未満に、AST、ALT値が2.5倍未満に低下するまで本剤を休薬する。 2. 400mg1日1回に減量して再開する。 | |
| 膵機能検査値 (リパーゼ) | リパーゼ値>施設正常値上限の2倍 | 1. リパーゼ値が施設正常値上限の1.5倍未満に低下するまで本剤を休薬する。 2. 400mg1日1回に減量して再開する。 |
| QT間隔延長 | 480msec以上の延長 | 1. 本剤を休薬する。 2. 2週間以内に、450msec未満かつベースライン値からの延長が20msec以内に回復した場合は、300mg1日2回の用量で再開する。 2週間の休薬以降も、450msec以上の場合は、本剤の投与を中止する。 3. 投与を再開した後に、再度、450msec以上の延長が認められた場合は、本剤の投与を中止する。 |
| グレード2のその他の非血液系の副作用が発現した場合は、グレード1以下に回復するまで、本剤を休薬すること。投与を再開する場合には、300mg1日2回の用量で再開する。 グレード3以上のその他の非血液系の副作用が発現した場合は、グレード1以下に回復するまで、本剤を休薬すること。投与を再開する場合には、400mg1日1回に減量するなど注意すること(グレードはNCI-CTCに準じる)。 | ||
(2)イマチニブ抵抗性の慢性期又は移行期の慢性骨髄性白血病
| 休薬・減量基準 | 投与量調節 | |
| 肝機能検査値 (ビリルビン、AST、ALT) | ビリルビン値>施設正常値上限の3倍 又は AST値、ALT値>施設正常値上限の5倍 | 1. ビリルビン値が施設正常値上限の1.5倍未満に、AST、ALT値が2.5倍未満に低下するまで本剤を休薬する。 2. 400mg1日1回に減量して再開する。 |
| 膵機能検査値 (リパーゼ) | リパーゼ値>施設正常値上限の2倍 | 1. リパーゼ値が施設正常値上限の1.5倍未満に低下するまで本剤を休薬する。 2. 400mg1日1回に減量して再開する。 |
| QT間隔延長 | 480msec以上の延長 | 1. 本剤を休薬する。 2. 2週間以内に、450msec未満かつベースライン値からの延長が20msec以内に回復した場合は、400mg1日2回の用量で再開する。 2週間の休薬以降も、450msec以上480msec未満の場合は、400mg1日1回に減量して再開する。 3. 400mg1日1回に減量して再開した後に、再度、480msec以上の延長が認められた場合は、本剤の投与を中止する。 |
| グレード3以上のその他の非血液系の副作用が発現した場合は、グレード1以下に回復するまで、本剤を休薬すること。投与を再開する場合には、400mg1日1回に減量するなど注意すること(グレードはNCI-CTCに準じる)。 | ||
(3)小児の慢性骨髄性白血病
| 休薬・減量基準 | 投与量調節 | |
| 肝機能検査値 (ビリルビン、AST、ALT) | ビリルビン値>施設正常値上限の1.5倍 又は AST値、ALT値>施設正常値上限の5倍 | 1. ビリルビン値については施設正常値上限の1.5倍未満、AST、ALT値については3倍未満に低下するまで本剤を休薬する。 2. 休薬前に230mg/m21日2回を投与していた場合は、230mg/m21日1回に減量して再開する。休薬前に230mg/m21日1回を投与していた場合は、4週間以内に上記1の値まで回復しなければ本剤の投与を中止する。 |
| 膵機能検査値 (リパーゼ) | リパーゼ値>施設正常値上限の2倍 | 1. リパーゼ値が施設正常値上限の1.5倍未満に低下するまで本剤を休薬する。 2. 休薬前に230mg/m21日2回を投与していた場合は、230mg/m21日1回に減量して再開する。休薬前に230mg/m21日1回を投与していた場合は、本剤の投与を中止する。 |
| QT間隔延長 | 480msec以上の延長 | 1. 本剤を休薬する。 2. 2週間以内に、450msec未満かつベースライン値からの延長が20msec以内に回復した場合、休薬前に230mg/m21日2回を投与していた場合は、230mg/m21日1回に減量して再開する。休薬前に230mg/m21日1回を投与していた場合は、本剤の投与を中止する。 2週間の休薬以降も、450msec以上の場合は、本剤の投与を中止する。 3. 投与を再開した後に、再度、450msec以上の延長が認められた場合は、本剤の投与を中止する。 |
| グレード2以上のその他の非血液系の副作用が発現した場合(グレード2の皮疹の初回発現時は、適切な治療を行っても回復しない場合、下痢、嘔吐の発現時は、グレード3以上が発現した場合)は、グレード1以下に回復するまで、本剤を休薬すること。投与を再開する場合には、休薬前に230mg/m21日2回を投与していた場合は、230mg/m21日1回に減量して再開すること。休薬前に230mg/m21日1回を投与していた場合は、本剤の投与を中止すること(グレードはNCI-CTCに準じる)。 | ||
8. 重要な基本的注意
8.1 血小板減少、好中球減少、貧血があらわれることがあるので、定期的に血液検査(血球数算定、白血球分画等)を行うこと。血液検査を投与開始前と投与後の2ヵ月間は2週毎、その後は1ヵ月毎に行い、また必要に応じて追加すること。これらの血球減少はイマチニブ抵抗性の慢性骨髄性白血病患者において頻度が高く、また慢性期に比べ移行期の慢性骨髄性白血病患者での頻度が高い。[11.1.1参照]
8.2 QT間隔延長があらわれることがあるので、本剤投与開始前には、心電図検査を行うこと。また、本剤投与中は適宜心電図検査等を行うこと。[1.2、7.4.2、9.1.2、9.1.3、10.2、11.1.2参照]
8.4 体液貯留があらわれることがあるので、体重を定期的に測定するなど観察を十分に行うこと。[11.1.12参照]
8.5 血中のビリルビン、肝トランスアミナーゼ、リパーゼ増加があらわれることがあるので、肝機能や膵酵素に関する血液検査を定期的に行うこと。[7.4.2、9.1.4、9.3、11.1.10、11.1.11参照]
8.6 Bcr-Ablチロシンキナーゼ阻害剤の投与によりB型肝炎ウイルスの再活性化があらわれることがあるので、本剤投与に先立って肝炎ウイルス感染の有無を確認し、本剤投与前に適切な処置を行うこと。[9.1.6、11.1.9参照]
8.7 感染症があらわれることがあるので、定期的に血液検査を実施するなど観察を十分に行うこと。[11.1.9参照]
8.8 高血糖があらわれることがあるため、本剤投与中は、定期的に血糖値の測定を行うこと。[11.1.6参照]
8.9 めまい、霧視・視力低下等の視力障害等があらわれることがあるので、このような場合には、高所作業、自動車の運転等危険を伴う機械の操作に従事させないよう注意すること。
8.10 頭蓋内出血、消化管出血、後腹膜出血があらわれることがあるので、定期的に血液検査を実施するなど観察を十分に行うこと。[11.1.8参照]
8.11 腫瘍崩壊症候群があらわれることがあるので、血清中電解質濃度及び腎機能検査を行うなど、患者の状態を十分に観察すること。[11.1.16参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心疾患又はその既往歴のある患者
心疾患が悪化するおそれがある。[11.1.3参照]
9.1.2 QT間隔延長のおそれ又はその既往歴のある患者
9.1.3 電解質異常のある患者(低カリウム血症又は低マグネシウム血症等)
9.1.4 膵炎又はその既往歴のある患者
9.1.5 イマチニブに忍容性のない患者
前治療の副作用の内容を確認すること。本剤を投与する際には、慎重に経過観察を行い、副作用の発現に注意すること。イマチニブの投与中止の原因となった副作用と同様の副作用が発現するおそれがある。
9.1.6 B型肝炎ウイルスキャリアの患者又は既往感染者(HBs抗原陰性、かつHBc抗体又はHBs抗体陽性)
9.3 肝機能障害患者
9.4 生殖能を有する者
妊娠可能な女性に対しては、投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット)で乳汁中へ移行したとの報告がある。
9.7 小児等
9.7.1 低出生体重児、新生児、乳児又は2歳未満の幼児を対象とした臨床試験は実施していない。
9.7.2 臨床試験において、本剤が投与された2〜18歳未満の患者に、成長遅延の傾向が認められた。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
相互作用序文
本剤は主に代謝酵素CYP3A4及び一部CYP2C8で代謝され、またP糖蛋白(Pgp)の基質であることから、本剤の吸収と消失はCYP3A4又はPgpに影響を及ぼす薬剤により影響を受けると考えられる。
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2C8
薬物代謝酵素用語
P糖蛋白(Pgp)
10.2 併用注意
| CYP3A4を阻害する薬剤等 アゾール系抗真菌剤(イトラコナゾール、ボリコナゾール等) リトナビル クラリスロマイシン グレープフルーツジュース等 | 本剤の血中濃度が上昇することがあるため、CYP3A4阻害作用がない又は弱い薬剤への代替を考慮すること。併用する場合は、観察を十分に行いQT間隔延長等に注意すること。 また、本剤とアゾール系抗真菌剤(ケトコナゾール:国内未発売の経口剤)との併用により、本剤のCmax及びAUCはそれぞれ1.8倍及び3倍に上昇したとの報告がある。 | これらの薬剤等はCYP3A4活性を阻害することにより、本剤の代謝を阻害し、血中濃度を上昇させる可能性がある。 |
| CYP3A4を誘導する薬剤等 フェニトイン リファンピシン カルバマゼピン フェノバルビタール デキサメタゾン セイヨウオトギリソウ(St.John's Wort,セント・ジョーンズ・ワート)含有食品等 | 本剤の血中濃度が低下することがあるため、CYP3A4誘導作用が弱い薬剤への代替を考慮すること。 本剤とリファンピシンの併用により、本剤のCmax及びAUCがそれぞれ1/3及び1/5に低下したとの報告がある。 | これらの薬剤等はCYP3A4を誘導することにより、本剤の代謝を促進し、血中濃度を低下させる可能性がある。 |
| CYP3A4により代謝される薬剤 ミダゾラム等 | これらの薬剤の血中濃度が上昇することがある。本剤とミダゾラムの併用により、ミダゾラムのCmax及びAUCはそれぞれ2.0倍及び2.6倍に上昇したとの報告がある。 | 本剤がこれらの薬剤の代謝を阻害し、血中濃度を上昇させる可能性がある。 |
| CYP3A4、P糖蛋白の基質及び阻害する薬剤 イマチニブ等 | 本剤及びこれらの薬剤の血中濃度が上昇することがある。 本剤とイマチニブの併用により、イマチニブのAUCは18〜39%、本剤のAUCは18〜40%上昇したとの報告がある。 | これらの薬剤がCYP3A4及びP糖蛋白の活性を阻害して本剤の血中濃度を上昇させる可能性、及び本剤がCYP3A4及びP糖蛋白の活性を阻害してこれらの薬剤の血中濃度を上昇させる可能性がある。 |
| 抗不整脈剤 アミオダロン ジソピラミド プロカインアミド キニジン ソタロール等 QT間隔延長を起こすおそれのある他の薬剤 クラリスロマイシン ハロペリドール モキシフロキサシン ベプリジル ピモジド等 [1.2、8.2、11.1.2参照] | QT間隔延長を起こす又は悪化させるおそれがあるため、観察を十分に行うこと。 | 共にQT間隔延長の副作用を有するため。 |
| 胃内のpHを上昇させる薬剤 プロトンポンプ阻害剤等 | 本剤の吸収が低下することがある。 本剤とエソメプラゾールの併用により、本剤のCmax及びAUCはそれぞれ27%及び34%減少したとの報告がある。 なお、ファモチジン、制酸剤については、本剤と服用時間をずらすことで、本剤のCmax及びAUCに影響はなかったとの報告がある(ファモチジン:本剤投与10時間前及び2時間後に投与、制酸剤:本剤投与2時間前又は2時間後に投与)。 | 本剤の溶解度はpHの上昇により低下するため。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 骨髄抑制
11.1.3 心筋梗塞(1.1%)、狭心症(1.4%)、心不全(0.3%)
11.1.4 末梢動脈閉塞性疾患(0.9%)
閉塞性動脈硬化症、末梢性虚血、四肢動脈血栓症等の末梢動脈閉塞性疾患があらわれることがあり、壊死に至った例が報告されている。観察を十分に行い、間欠性跛行、疼痛、冷感、しびれ等が認められた場合には投与を中止するなど、適切な処置を行うこと。
11.1.5 脳梗塞(頻度不明)、一過性脳虚血発作(0.3%)
11.1.6 高血糖(6.8%)[8.8参照]
11.1.7 心膜炎(0.2%)
11.1.8 出血(頭蓋内出血(頻度不明)、消化管出血(0.2%)、後腹膜出血(頻度不明))
出血性ショックに至ることがある。[8.10参照]
11.1.9 感染症
11.1.12 体液貯留(胸水(0.5%)、肺水腫(頻度不明)、心嚢液貯留(0.3%)、うっ血性心不全(頻度不明)、心タンポナーデ(0.2%))
急激な体重の増加、呼吸困難等の異常が認められた場合には投与を中止し、適切な処置を行うこと。[8.4参照]
11.1.13 間質性肺疾患(0.2%)
11.1.14 脳浮腫(頻度不明)
11.1.15 消化管穿孔(頻度不明)
11.1.16 腫瘍崩壊症候群(頻度不明)
異常が認められた場合には投与を中止し、適切な処置(生理食塩液、高尿酸血症治療剤等の投与、透析等)を行うとともに、症状が回復するまで患者の状態を十分に観察すること。[8.11参照]
11.2 その他の副作用
| 1%以上 | 0.5%〜1%未満 | 0.5%未満 | 頻度不明 | |
| 皮膚 | 発疹(41.4%)、そう痒症(15.6%)、脱毛症(11.4%)、皮膚乾燥(9.7%)、紅斑、皮膚炎、湿疹、皮膚色素過剰、多汗症、寝汗、皮膚剥脱、過角化 | 蕁麻疹、挫傷、皮膚乳頭腫、皮膚疼痛、ざ瘡 | 斑状出血、光線過敏、水疱、結節性紅斑、皮膚嚢腫、皮膚萎縮、脂腺過形成、皮膚肥厚、皮膚変色、顔面腫脹、剥脱性発疹、多形紅斑 | 手足症候群、点状出血、皮膚潰瘍 |
| 精神障害 | 不眠症 | 不安、うつ病 | 不快気分、錯乱状態、失見当識 | − |
| 神経系障害 | 頭痛(20.8%)、浮動性めまい、感覚鈍麻、味覚異常、末梢性ニューロパチー | 片頭痛、嗜眠、錯感覚、意識消失、失神、振戦 | 健忘、知覚過敏、異常感覚、下肢静止不能症候群 | 注意力障害、視神経炎、顔面神経麻痺 |
| 眼 | 眼乾燥、結膜炎、眼瞼浮腫、眼そう痒症、眼充血 | 光視症、結膜出血、眼痛、視力低下、眼窩周囲浮腫 | 眼瞼炎、眼刺激、網脈絡膜症、強膜充血、結膜充血、オキュラーサーフェス疾患、霧視、視力障害、眼出血 | 複視、眼部腫脹、視神経乳頭浮腫、羞明 |
| 耳・迷路障害 | 回転性めまい | − | 聴覚障害、耳痛 | 耳鳴 |
| 筋・骨格系 | 筋骨格痛(17.1%)、関節痛(8.6%)、筋痙縮(8.3%)、背部痛 | 筋骨格硬直、筋力低下 | 関節炎、側腹部痛 | 関節腫脹、投与中止に伴う筋骨格系疼痛 |
| 消化器 | 悪心(18.1%)、上腹部痛(8.8%)、嘔吐(9.0%)、便秘(7.9%)、下痢(7.6%)、腹痛(5.6%)、消化不良、腹部膨満、鼓腸、腹部不快感、胃腸炎 | 口内炎、口内乾燥、痔核、胃食道逆流 | 食道痛、胃潰瘍、裂孔ヘルニア、メレナ、歯肉炎、歯の知覚過敏、口腔内潰瘍形成、潰瘍性食道炎 | 吐血、亜イレウス |
| 肝臓 | ビリルビン増加(29.9%)、ALT増加(26.4%)、AST増加(14.5%)、ALP増加、γ-GTP増加 | − | 肝腫大 | 胆汁うっ滞 |
| 呼吸器 | 呼吸困難、咳嗽 | 鼻出血 | 発声障害、胸膜炎、肺高血圧症、口腔咽頭痛 | 胸膜痛、咽喉刺激感、喘鳴 |
| 心臓障害 | 動悸 | 心房細動、頻脈、冠動脈疾患、徐脈、期外収縮 | 駆出率減少、心拡大、チアノーゼ、房室ブロック、不整脈 | 心雑音 |
| 血液 | リンパ球減少症 | 発熱性好中球減少症、好酸球増加症 | 血小板血症、白血球増加症 | − |
| 血管障害 | 高血圧、潮紅 | 低血圧 | 血腫、血栓症 | 高血圧クリーゼ |
| 腎臓 | 血中クレアチニン増加 | BUN増加 | 頻尿、排尿困難、着色尿、血尿 | 尿意切迫、尿失禁、腎不全 |
| 生殖器 | − | 女性化乳房、勃起不全 | 月経過多、乳頭腫脹、乳房硬結、乳房痛 | − |
| 感染症 | 毛包炎、鼻咽頭炎、ヘルペスウイルス感染 | 気道感染、気管支炎、カンジダ症 | せつ、皮下組織膿瘍、肛門膿瘍、足部白癬 | 尿路感染 |
| 内分泌障害 | − | − | 甲状腺機能亢進症、甲状腺機能低下症、続発性副甲状腺機能亢進症 | 甲状腺炎 |
| 代謝障害 | 高コレステロール血症(5.4%)、糖尿病、食欲不振、高尿酸血症、脂質異常症、高トリグリセリド血症 | − | 痛風、低血糖 | 脱水、食欲亢進 |
| 全身障害 | 疲労(10.8%)、無力症(6.6%)、末梢性浮腫(5.6%)、発熱、顔面浮腫、けん怠感、悪寒、胸部不快感、胸痛、疼痛 | − | 過敏症、熱感、重力性浮腫、限局性浮腫、口腔乳頭腫、冷感 | インフルエンザ様疾患 |
| 臨床検査 | 低リン酸血症(14.8%)、リパーゼ増加(10.5%)、血中アミラーゼ増加(6.2%)、低カリウム血症、低カルシウム血症、体重増加、体重減少 | 低マグネシウム血症、低ナトリウム血症、血中インスリン増加、血中非抱合ビリルビン増加、CK増加、超低比重リポ蛋白(VLDL)増加、高カリウム血症、高カルシウム血症 | 血中副甲状腺ホルモン増加、トロポニン増加、LDH増加 | 高リン酸血症 |
13. 過量投与
13.1 症状
好中球減少症、嘔吐、眠気。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
RasH2トランスジェニックマウスを用いた26週間がん原性試験において、AUC比較で臨床曝露量の約30倍に相当する300mg/kg/日の用量で経口投与したところ、皮膚乳頭腫、皮膚癌が認められたとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 反復投与
(1)初発の慢性期の慢性骨髄性白血病
初発の慢性期の慢性骨髄性白血病日本人患者(8例)にニロチニブ300mgを1日2回(1日用量として600mg)反復経口投与したときの定常状態(投与開始8日目以降)でのCmax及びAUC0-12はそれぞれ1,292ng/mL及び11,032ng・h/mLであった1)。
| 1日用量(mg) | N | Tmax(h) | Cmax(ng/mL) | Cmin(ng/mL) | AUC0-12(ng・h/mL) | |
| 定常状態 | 600(300×2) | 8 | 2.04(0.0〜7.95) | 1,292±853 | 1,056±837 | 11,032±7,173 |
初発の慢性期の慢性骨髄性白血病日本人患者にニロチニブ300mgを1日2回反復経口投与したときの血清中ニロチニブ濃度推移(平均値+標準偏差)
(2)イマチニブ抵抗性の慢性期又は移行期の慢性骨髄性白血病
イマチニブで効果不十分又はイマチニブに忍容性のない慢性期、移行期、急性期注1)の慢性骨髄性白血病及びフィラデルフィア染色体陽性急性リンパ性白血病注1)の日本人患者(42例)にニロチニブ200mgを1日1回注2)、400mgを1日1回注2)又は400mgを1日2回(1日用量として800mg)反復経口投与したとき、投与開始6日目には定常状態に到達し、AUCは投与初日のそれぞれ2.1倍、2.0倍及び2.6倍となった。400mgを1日1回投与したときのCmax及びAUCは、200mgを1日1回投与したときの2倍であった。また、400mgを1日2回投与したときの定常状態における1日あたりのAUC(AUC0-12を2倍したもの)は、400mgを1日1回投与したときの1.8倍であり、概ね1日用量に比例して増加した2)3)。
| 1日用量(mg) | N | Tmax(h) | Cmax(ng/mL) | Cmina)(ng/mL) | AUC0-24(ng・h/mL) | AUC0-12(ng・h/mL) | |
| 1日目 | 200(200×1) | 4 | 3.1(3.0〜4.0) | 491±174 | 169±96.4 | 6,410±2,680 | − |
| 400(400×1) | 4 | 3.5(1.9〜7.0) | 818±420 | 324±164 | 11,600±5,630 | − | |
| 800(400×2) | 33 | 3.0(2.0〜23.0) | 1,070±458 | Not measured | − | 7,850±2,790 | |
| 15日目 | 200(200×1) | 3 | 3.0(3.0〜7.0) | 727±170 | 322±73.6 | 11,000±766 | − |
| 400(400×1) | 4 | 3.0(2.0〜7.1) | 1,600±512 | 575±301 | 21,200±9,340 | − | |
| 800(400×2) | 28 | 3.0(1.8〜8.0) | 2,320±1,070 | 1,170±588 | − | 19,000±9,090b) |
イマチニブ抵抗性の慢性期、移行期、急性期の慢性骨髄性白血病及びフィラデルフィア染色体陽性急性リンパ性白血病の日本人患者にニロチニブ400mgを1日2回反復経口投与したときの血清中ニロチニブ濃度推移(平均値+標準偏差)
16.2 吸収
ニロチニブの絶対バイオアベイラビリティに関するデータは得られていないが、健康成人に14C-標識ニロチニブを経口投与したとき、放射能の68.5%が未変化体として糞中に回収されたことから、ニロチニブが消化管では代謝されず、また吸収されたニロチニブは未変化体として消化管に排泄されないと仮定したとき、ヒトにニロチニブを経口投与したときの吸収率は約30%と推定された4)(外国人のデータ)。
16.2.1 食事の影響
ニロチニブを通常食摂取30分後及び2時間後に投与したとき、Cmaxは空腹時に比べてそれぞれ1.55倍及び1.33倍に増加し、AUCは1.32倍及び1.19倍に増加した。また、高脂肪食摂取30分後に投与したとき、Cmax及びAUCは空腹時に比べてそれぞれ2.12倍及び1.82倍に増加した5)(外国人のデータ)。
母集団薬物動態解析の結果、胃全摘出及び部分切除を受けた患者では、ニロチニブの吸収(相対バイオアベイラビリティ)がそれぞれ約48%及び22%低下すると推定された。胃を切除していない患者に対する相対バイオアベイラビリティのベイズ推定値(中央値[最小値〜最大値])は、胃全摘出を受けた患者(n=14)では53%[27〜124%]、部分切除を受けた患者(n=18)では80%[45〜193%]であった6)(外国人のデータ)。[7.3参照]
母集団薬物動態解析の結果、胃全摘出及び部分切除を受けた患者では、ニロチニブの吸収(相対バイオアベイラビリティ)がそれぞれ約48%及び22%低下すると推定された。胃を切除していない患者に対する相対バイオアベイラビリティのベイズ推定値(中央値[最小値〜最大値])は、胃全摘出を受けた患者(n=14)では53%[27〜124%]、部分切除を受けた患者(n=18)では80%[45〜193%]であった6)(外国人のデータ)。[7.3参照]
16.3 分布
16.4 代謝
健康成人に14C-標識ニロチニブ400mgを単回注3)経口投与したとき、血清中のニロチニブ由来放射能の87.5%は未変化体であった。主な代謝経路はメチルイミダゾール環のメチル基の水酸化及び水酸基のカルボン酸への更なる酸化であった4)(外国人のデータ)。
In vitro試験の結果から、ニロチニブの主代謝酵素はCYP3A4であり、CYP2C8も一部寄与すると考えられた9)。
16.5 排泄
健康成人に14C-標識ニロチニブを経口投与したとき、投与168時間後までに投与放射能の90%以上が糞中に排泄され、尿中にはニロチニブ及びその代謝物由来の放射能は検出されなかった。したがって、ニロチニブの主排泄経路は糞中であると考えられた。糞中放射能は主に未変化体に由来するものであった(投与量の68.5%)4)(外国人のデータ)。
16.6 特定の背景を有する患者
16.6.1 肝機能障害患者における薬物動態
ニロチニブの血清中濃度は肝機能障害によりわずかに上昇し、軽度(Child-Pugh分類A)、中等度(Child-Pugh分類B)及び重度(Child-Pugh分類C)の肝機能障害を有する被験者にニロチニブを単回経口投与したときのAUCはそれぞれ健康被験者の1.35倍、1.35倍、1.19倍であった。また、単回投与時の血清中濃度推移データを用いて反復投与時の定常状態におけるニロチニブの濃度推移をシミュレーションした結果、軽度、中等度及び重度の肝機能障害を有する被験者における定常状態でのニロチニブのCmaxは、健康被験者に比べてそれぞれ1.29倍、1.18倍、1.22倍になると推定された。肝機能障害によるニロチニブの薬物動態への影響は小さいことから、肝機能障害を有する患者における用量調節の必要はないと考えられる10)(外国人のデータ)。[9.3参照]
16.6.2 小児患者における薬物動態
小児白血病患者にニロチニブを1回230mg/m2を50mg単位の用量(最大単回投与量400mg)で投与したとき、定常状態における曝露量は、成人患者に400mgを1日2回投与したときと同程度であった。また、母集団薬物動態解析の結果、単回投与時、反復投与時のニロチニブの曝露量は、2歳以上12歳未満の小児患者と12歳以上18歳未満の小児患者とで違いはなかった11)。
注1)本剤の承認された効能又は効果は、慢性期又は移行期の慢性骨髄性白血病である。
注2)本剤の承認された用法及び用量は、イマチニブ抵抗性の慢性期又は移行期の慢性骨髄性白血病の場合、成人では1回400mgを1日2回である。
注3)本剤の承認された用法及び用量は、成人では1回400mgを1日2回であり、初発の慢性期の慢性骨髄性白血病の場合、1回投与量は300mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第III相試験:初発の慢性期の慢性骨髄性白血病(成人)
初発の慢性期の慢性骨髄性白血病患者846例(日本人79例を含む)を対象として、非盲検、ランダム化、実薬対照並行群間比較試験を実施し、ニロチニブ(300mg1日2回又は400mg1日2回注1))の有効性及び安全性について、イマチニブ400mg1日1回を対照として比較検討を行った。
(1)分子遺伝学的効果
投与開始12ヵ月時点で分子遺伝学的効果(MMR)が得られた患者の割合は、ニロチニブ300mg1日2回投与群では44.3%(282例中125例)、イマチニブ400mg1日1回投与群では22.3%(283例中63例)で、主要評価項目である12ヵ月時点でのMMR率はニロチニブ300mg1日2回投与群が有意に高かった(p<0.0001)1)。
| ニロチニブ 300mg1日2回 N=282 | イマチニブ 400mg1日1回 N=283 | |
| 12ヵ月時点でのMMR達成率 | 44.3%(125/282) | 22.3%(63/283) |
| 95%信頼区間 | 38.4〜50.3 | 17.6〜27.6 |
(2)細胞遺伝学的効果
投与開始12ヵ月時点までに細胞遺伝学的完全寛解(Complete CyR)が得られた患者の割合は、ニロチニブ300mg1日2回投与群では80.1%(282例中226例)、イマチニブ400mg1日1回投与群では65.0%(283例中184例)であった1)。
| ニロチニブ 300mg1日2回 N=282 | イマチニブ 400mg1日1回 N=283 | |
| 12ヵ月時点までのComplete CyR達成率 | 80.1%(226/282) | 65.0%(184/283) |
| 95%信頼区間 | 75.0〜84.6 | 59.2〜70.6 |
副作用発現頻度は、本剤300mg1日2回投与群で92.1%(257/279例)であった。主な副作用は300mg1日2回投与群では発疹33.3%(93例)、血小板減少症、そう痒症各17.6%(49例)、頭痛、高ビリルビン血症各16.5%(46例)、好中球減少症15.1%(42例)、悪心14.0%(39例)、低リン酸血症12.5%(35例)、疲労12.2%(34例)、脱毛症、筋肉痛各10.4%(29例)、上腹部痛10.0%(28例)等であった。検査値異常の主な副作用は、ALT増加24.0%(67例)、AST増加12.2%(34例)、リパーゼ増加10.8%(30例)、血中ビリルビン増加10.4%(29例)等であった。(60ヵ月時点(2013年9月)の集計)
17.1.2 国内第II相試験及び海外第II相試験:イマチニブ抵抗性の慢性期の慢性骨髄性白血病(成人)
イマチニブで効果不十分又はイマチニブに忍容性のない慢性期の慢性骨髄性白血病患者に、ニロチニブ400mgを1日2回経口投与した。
(1)細胞遺伝学的効果
国内第II相試験の非対照、非盲検試験では、慢性期の慢性骨髄性白血病患者16例中15例(93.8%)で細胞遺伝学的効果(Major CyR)が得られ、うち11例で完全寛解(Complete CyR)が得られた3)。
海外第II相試験の非対照、非盲検試験では、慢性期の慢性骨髄性白血病患者321例中165例(51.4%)で細胞遺伝学的効果(Major CyR)が得られ、うち118例(36.8%)で完全寛解(Complete CyR)が得られた12)。
| 国内第II相試験 N=16 | 海外第II相試験 N=321 | |
| Major CyR(Complete CyR+Partial CyR) | 93.8%(15/16) | 51.4%(165/321) |
| 95%信頼区間 | 69.8〜99.8 | 45.8〜57.0 |
| Complete CyR | 68.8%(11/16) | 36.8%(118/321) |
| Partial CyR | 25.0%(4/16) | 14.6%(47/321) |
(2)血液学的効果
国内第II相試験の非対照、非盲検試験では、慢性期の慢性骨髄性白血病患者16例中、評価対象の6例全員に血液学的完全寛解(CHR)が得られた3)。
海外第II相試験の非対照、非盲検試験では、慢性期の慢性骨髄性白血病患者321例中、評価対象は207例であった。207例中145例(70.0%)で血液学的完全寛解(CHR)が得られた12)。
| 国内第II相試験 N=16 評価対象(N=6) | 海外第II相試験 N=321 評価対象(N=207) | |
| 血液学的完全寛解(CHR) | 100.0%(6/6) | 70.0%(145/207) |
| 95%信頼区間 | 54.1〜100.0 | 63.3〜76.2 |
国内第II相試験(イマチニブ抵抗性の慢性期の慢性骨髄性白血病)の副作用発現頻度は、100.0%(16/16例)であった。主な副作用は、高血糖、発疹各43.8%(7例)、好中球減少症、血小板減少症、血中ビリルビン増加各37.5%(6例)、白血球減少症、悪心、嘔吐、高ビリルビン血症、リパーゼ増加、頭痛、湿疹各31.3%(5例)、貧血、便秘、けん怠感、心電図QT補正間隔延長、肝機能異常各25.0%(4例)等であった。(効能又は効果の一変承認時までの集計)
海外第II相試験(イマチニブ抵抗性の慢性期の慢性骨髄性白血病)の副作用発現頻度は94.7%(304/321例)であった。主な副作用は、発疹30.8%(99例)、そう痒症26.2%(84例)、血小板減少症28.0%(90例)、悪心24.6%(79例)、疲労20.2%(65例)等であった。(効能又は効果の一変承認時までの集計)
17.1.3 国内第II相試験及び海外第II相試験:イマチニブ抵抗性の移行期の慢性骨髄性白血病(成人)
イマチニブで効果不十分又はイマチニブに忍容性のない移行期の慢性骨髄性白血病患者に、ニロチニブ400mgを1日2回経口投与した。
(1)細胞遺伝学的効果
国内第II相試験の非対照、非盲検試験では、移行期の慢性骨髄性白血病患者7例中1例(14.3%)で細胞遺伝学的効果(Major CyR)が得られた。この1例は完全寛解(Complete CyR)であった3)。
海外第II相試験の非対照、非盲検試験では、移行期の慢性骨髄性白血病患者137例中41例(29.9%)で細胞遺伝学的効果(Major CyR)が得られた。うち、27例(19.7%)で完全寛解(Complete CyR)が得られた12)。
| 国内第II相試験 N=7 | 海外第II相試験 N=137 | |
| Major CyR(Complete CyR+Partial CyR) | 14.3%(1/7) | 29.9%(41/137) |
| 95%信頼区間 | − | 22.4〜38.3 |
| Complete CyR | 14.3%(1/7) | 19.7%(27/137) |
| Partial CyR | 0%(0/7) | 10.2%(14/137) |
(2)血液学的効果
国内第II相試験の非対照、非盲検試験では、移行期の慢性骨髄性白血病患者7例中5例(71.4%)に血液学的効果が得られ、その内訳は、血液学的完全寛解(CHR)が1例、Marrow response/白血病の証拠なし(Marrow response/NEL)が3例、慢性期への回復(RTC)が1例であった3)。
海外第II相試験の非対照、非盲検試験では、移行期の慢性骨髄性白血病患者137例中69例(50.4%)に血液学的効果が得られ、その内訳は、血液学的完全寛解(CHR)が41例(29.9%)、Marrow response/白血病の証拠なし(Marrow response/NEL)が13例(9.5%)、慢性期への回復(RTC)が15例(10.9%)であった12)。
| 国内第II相試験 N=7 | 海外第II相試験 N=137 | |
| 血液学的効果 | 71.4%(5/7) | 50.4%(69/137) |
| 95%信頼区間 | − | 41.7〜59.0 |
| 血液学的完全寛解(CHR) | 14.3%(1/7) | 29.9%(41/137) |
| Marrow response/白血病の証拠なし(NEL) | 42.9%(3/7) | 9.5%(13/137) |
| 慢性期への回復(RTC) | 14.3%(1/7) | 10.9%(15/137) |
国内第II相試験(イマチニブ抵抗性の移行期の慢性骨髄性白血病)の副作用発現頻度は、100.0%(7/7例)であった。主な副作用は、好中球減少症、悪心、嘔吐、高ビリルビン血症、発疹42.9%(3例)、血小板減少症、白血球減少症、頭痛28.6%(2例)等であった。(効能又は効果の一変承認時までの集計)
海外第II相試験(イマチニブ抵抗性の移行期の慢性骨髄性白血病)の副作用発現頻度は、87.6%(120/137例)であった。主な副作用は、血小板減少症38.0%(52例)、好中球減少症22.6%(31例)、発疹21.2%(29例)等であった。(効能又は効果の一変承認時までの集計)
17.1.4 国際共同第II相試験:慢性期の慢性骨髄性白血病(小児)
初発もしくはイマチニブ又はダサチニブに抵抗性又は不耐容の患者58例(日本人9例を含む)を対象に非盲検、非対照試験を実施し、ニロチニブ230mg/m2を1日2回投与した。
(1)初発の慢性期の慢性骨髄性白血病(小児)の分子遺伝学的効果
主要評価項目であるサイクル12時点までに少なくとも1回MMRが得られた患者の割合は、64.0%(25例中16例)であった13)。
| N=25 | |
| サイクル12時点までに少なくとも1回のMMR達成率 | 64.0%(16/25) |
| 95%信頼区間 | 42.5〜82.0 |
(2)初発の慢性期の慢性骨髄性白血病(小児)の細胞遺伝学的効果
主要評価項目であるサイクル12時点で細胞遺伝学的完全寛解(Complete CyR)が得られた患者の割合は、64.0%(25例中16例)であった13)。
| N=25 | |
| サイクル12時点でのComplete CyR達成率 | 64.0%(16/25) |
| 95%信頼区間 | 42.5〜82.0 |
(3)イマチニブ又はダサチニブ抵抗性又は不耐容の慢性期の慢性骨髄性白血病(小児)の分子遺伝学的効果
MMRが得られた患者の割合は、主要評価項目であるサイクル6時点で39.4%(33例中13例)であった13)。
| N=33 | |
| サイクル6時点でのMMR達成率 | 39.4%(13/33) |
| 95%信頼区間 | 22.9〜57.9 |
副作用発現頻度は、86.2%(初発及びイマチニブ又はダサチニブに抵抗性又は不耐容の患者50/58例、日本人9例を含む)であった。主な副作用は頭痛27.6%(16例)、高ビリルビン血症、発疹各20.7%(12例)、悪心15.5%(9例)、斑状丘疹状皮疹13.8%(8例)、嘔吐12.1%(7例)、脱毛症10.3%(6例)等であった。検査値異常の主な副作用は、血中ビリルビン増加31.0%(18例)、ALT増加29.3%(17例)、AST増加24.1%(14例)等であった。(用法及び用量の一変承認時までの集計)
注1)本剤の承認された用法及び用量は、初発の慢性期の慢性骨髄性白血病の場合、成人では1回300mgを1日2回である。
18. 薬効薬理
18.1 作用機序
18.2 抗腫瘍作用
19. 有効成分に関する理化学的知見
19.1. ニロチニブ塩酸塩水和物
22. 包装
<タシグナカプセル50mg>
20カプセル[10カプセル(PTP)×2]
<タシグナカプセル150mg>
20カプセル[10カプセル(PTP)×2]
120カプセル[10カプセル(PTP)×12]
<タシグナカプセル200mg>
20カプセル[10カプセル(PTP)×2]
120カプセル[10カプセル(PTP)×12]
23. 主要文献
- 社内資料:初発の慢性期CML患者に対する国際共同第III相試験
- 社内資料:白血病患者に対する国内第I相試験(2009年1月21日承認、CTD2.7.6-4.1.2)
- Tojo,A.et al., Int.J.Hematol., 89 (5), 679-688, (2009) »PubMed
- 社内資料:外国人における吸収、代謝、排泄試験(2009年1月21日承認、CTD2.7.6-2.1.1)
- Tanaka,C.et al., Clin.Pharmacol.Ther., 87 (2), 197-203, (2010) »PubMed
- 社内資料:GIST患者における母集団薬物動態解析
- 社内資料:血漿蛋白結合(2009年1月21日承認、CTD2.7.2-3.1.2)
- 社内資料:血球移行率(2009年1月21日承認、CTD2.7.2-3.1.2)
- 社内資料:代謝酵素の同定(2009年1月21日承認、CTD2.7.2-3.1.3)
- Yin,O.Q.P.et al., Clin.Ther., 31 (Pt2), 2459-2469, (2009)
- 社内資料:小児の白血病患者における薬物動態(2017年12月25日承認、CTD2.7.2-2.1)
- 社内資料:イマチニブ抵抗性の慢性期又は移行期CML患者に対する外国第II相試験
- 社内資料:小児のCML患者に対する国際共同第II相試験(2017年12月25日承認、CTD2.7.6-4.2.1)
- 社内資料:Ablキナーゼに対する阻害様式(2009年1月21日承認、CTD2.6.2-2.1)
- Fiskus,W.et al., Blood, 108 (2), 645-652, (2006) »PubMed
- 社内資料:細胞株を用いた測定系による選択的阻害作用(2009年1月21日承認、CTD2.6.2-2.1)
- Manley,P.W.et al., Biochim.Biophys.Acta, 1754 (1-2), 3-13, (2005) »PubMed
- 社内資料:Bcr-Abl変異体に対する自己リン酸化阻害、細胞増殖阻害(2009年1月21日承認、CTD2.6.2-2.2)
- 社内資料:BCR-ABL遺伝子導入細胞を静脈内移植したマウスに対する抗腫瘍効果(2009年1月21日承認、CTD2.6.2-2.3)
24. 文献請求先及び問い合わせ先
文献請求先
ノバルティスファーマ株式会社
ノバルティスダイレクト
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-003-293 受付時間:月〜金 9:00〜17:30(祝祭日及び当社休日を除く)
製品情報問い合わせ先
ノバルティスファーマ株式会社
ノバルティスダイレクト
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-003-293 受付時間:月〜金 9:00〜17:30(祝祭日及び当社休日を除く)
26. 製造販売業者等
26.1 製造販売
ノバルティスファーマ株式会社
東京都港区虎ノ門1-23-1