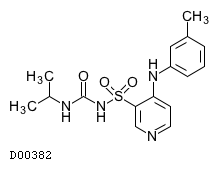
医薬品情報
| 総称名 | トラセミド |
|---|---|
| 一般名 | トラセミド |
| 欧文一般名 | Torasemide |
| 製剤名 | トラセミド口腔内崩壊錠 |
| 薬効分類名 | ループ利尿剤 |
| 薬効分類番号 | 2139 |
| ATCコード | C03CA04 |
| KEGG DRUG |
D00382
トラセミド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第3版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| トラセミドOD錠4mg「TE」 (後発品) | Torasemide OD Tablets 4mg「TE」 | トーアエイヨー | 2139009F3029 | 6.1円/錠 | 処方箋医薬品注) |
| トラセミドOD錠8mg「TE」 (後発品) | Torasemide OD Tablets 8mg「TE」 | トーアエイヨー | 2139009F4025 | 7.3円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
○心性浮腫
○腎性浮腫
○肝性浮腫
6. 用法及び用量
通常、成人には、トラセミドとして、1日1回4〜8mgを経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
8. 重要な基本的注意
8.1 本剤の利尿効果は急激にあらわれることがあるので、電解質失調、脱水に十分注意し、少量から投与を開始して、徐々に増量すること。[11.1.3参照]
8.2 連用する場合、電解質失調があらわれることがあるので定期的に検査を行うこと。[11.1.3参照]
8.3 降圧作用に基づくめまい、ふらつきがあらわれることがあるので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
8.4 夜間の休息が必要な患者には、夜間の排尿を避けるため、午前中に投与することが望ましい。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 重篤な冠動脈硬化症又は脳動脈硬化症のある患者
急激な利尿があらわれた場合、急速な血漿量減少、血液濃縮を来し、血栓塞栓症を誘発するおそれがある。
9.1.2 本人又は両親、兄弟に痛風、糖尿病のある患者
痛風発作を起こすおそれがある。糖尿病を悪化するおそれがある。
9.1.3 下痢、嘔吐のある患者
電解質失調を起こすおそれがある。
9.1.4 手術前の患者[10.2参照]
9.1.5 減塩療法時の患者
低ナトリウム血症を起こすおそれがある。
9.2 腎機能障害患者
9.2.1 腎機能障害のある患者
腎機能障害が増悪することがある。また、排泄遅延により血中濃度が上昇するおそれがある。[16.6.1参照]
9.3 肝機能障害患者
9.3.1 肝性昏睡の患者
投与しないこと。低カリウム血症によるアルカローシスの増悪により肝性昏睡が悪化するおそれがある。[2.2参照]
9.3.2 進行した肝硬変症のある患者
肝性昏睡を起こすおそれがある。
9.3.3 肝疾患・肝機能障害のある患者
肝性昏睡を起こすおそれがある。
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット)で本剤の乳汁移行が認められている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。乳児では電解質バランスがくずれやすい。
9.8 高齢者
次の点に注意し、少量(4mg)から投与を開始するなど患者の状態を観察しながら慎重に投与すること。
・急激な利尿は血漿量の減少を来し、脱水、低血圧等による立ちくらみ、めまい、失神等を起こすことがある。
・特に心疾患等で浮腫のある患者では急激な利尿は急速な血漿量の減少と血液濃縮を来し、脳梗塞等の血栓塞栓症を誘発するおそれがある。
・低ナトリウム血症、低カリウム血症があらわれやすい。[11.1.3参照]
10. 相互作用
10.1 併用禁忌
| デスモプレシン酢酸塩水和物 (ミニリンメルト)(男性における夜間多尿による夜間頻尿) [2.4参照] | 低ナトリウム血症が発現するおそれがある。 | いずれも低ナトリウム血症が発現するおそれがある。 |
10.2 併用注意
| 昇圧アミン (ノルアドレナリン等) [9.1.4参照] | 昇圧アミンの作用を減弱するおそれがあるので、手術前の患者に使用する場合には、一時休薬等の処置を講ずること。 | 本剤が昇圧アミンに対する血管壁の反応性を低下させるためと考えられている。 |
| ツボクラリン及びその類似物質 (ツボクラリン塩化物塩酸塩水和物) [9.1.4参照] | 麻痺作用を増強することがあるので、手術前の患者に使用する場合には、一時休薬等の処置を講ずること。 | 血清カリウム値の低下により、これらの薬剤の神経・筋遮断作用が増強されると考えられている。 |
| 降圧剤 (ACE阻害剤、β遮断剤等) | 併用する降圧剤の用量調節に注意する。 | 併用により降圧作用を増強するおそれがある。 |
| アミノグリコシド系抗生物質 (ゲンタマイシン硫酸塩、アミカシン硫酸塩等) | 併用を避けることが望ましい。やむを得ず投与する場合には、アミノグリコシド系抗生物質の血中濃度をモニターし、投与量、投与間隔を調節する。 | アミノグリコシド系抗生物質の腎障害及び第8脳神経障害(聴力障害)を増強するおそれがある。 |
| セファロスポリン系抗生物質 | 併用する場合には、慎重に投与する。 | 尿細管でのナトリウムの再吸収の増加に伴い、セファロスポリン系抗生物質の再吸収も増加し、腎毒性を増強するおそれがある。 |
| ジギタリス剤 (ジギトキシン、ジゴキシン等) [11.1.3参照] | 不整脈を起こすおそれがある。血清カリウム値をモニターし、カリウム剤の補充を行う。 | 低カリウム血症を起こし、ジギタリスの心臓毒性を増強する可能性が考えられる。 |
| 糖質副腎皮質ホルモン剤 ACTH グリチルリチン製剤 [11.1.3参照] | 過剰のカリウム放出を起こすおそれがあるので、併用する場合には、慎重に投与する。 | ともにカリウム排泄作用を有する。 |
| 糖尿病用剤 | 糖尿病用剤の作用を著しく減弱するおそれがある。 | 細胞内外のカリウム喪失がインスリン分泌の抑制、末梢でのインスリン感受性の低下をもたらすと考えられている。 |
| リチウム (炭酸リチウム) | リチウム中毒を起こすおそれがあるので、血中リチウム濃度に注意すること。 | リチウムの腎における再吸収を促進し、リチウムの血中濃度が上昇するおそれがある。 |
| サリチル酸誘導体 (サリチル酸ナトリウム、アスピリン等) | サリチル酸中毒が発現するおそれがある。 | 腎の排泄部位において両剤の競合が起こり、サリチル酸誘導体の排泄が遅れるおそれがある。 |
| 非ステロイド性消炎鎮痛剤 (インドメタシン等) | 本剤の利尿作用が減弱されるおそれがある。 | 非ステロイド性消炎鎮痛剤のプロスタグランジン合成抑制による水、ナトリウム体内貯留傾向が、本剤の水、ナトリウム排泄作用に拮抗するためと考えられている。 |
| 尿酸排泄促進剤 (プロベネシド等) | 尿酸排泄促進剤の尿酸排泄作用を減弱するおそれがある。 | 尿酸再吸収の間接的増大により、尿酸排泄促進剤の作用が抑制される。 |
| カルバマゼピン | 症候性低ナトリウム血症があらわれることがある。 | ナトリウム排泄作用が増強され、低ナトリウム血症が起こる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肝機能障害(0.03%)、黄疸(頻度不明)
AST、ALT、ALPの上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.1.2 血小板減少(頻度不明)
11.1.3 低カリウム血症、高カリウム血症(いずれも頻度不明)
注)発現頻度は、製造販売後調査の結果を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 血液 | 血液障害(血小板数減少、白血球数減少、赤血球数減少、ヘマトクリット値減少等) | ||
| 代謝異常 | 電解質失調(低ナトリウム血症、低カリウム血症、低クロール性アルカローシス)、血清尿酸値上昇、高カリウム血症 | 血清脂質増加、高血糖症 | |
| 過敏症 | 発疹、そう痒 | ||
| 消化器 | 口渇 | 食欲不振、下痢、腹痛、嘔気・嘔吐、胸やけ | |
| 肝臓 | AST、ALTの上昇 | γ-GTP、ALPの上昇 | |
| 腎臓 | BUN、クレアチニンの上昇、頻尿 | ||
| 精神神経系 | 頭痛、めまい | 手足のしびれ、聴覚障害 | |
| その他 | 倦怠感 | 動悸、痛風様発作、関節痛、筋痙攣、CK上昇、LDH上昇 | 女性化乳房 |
13. 過量投与
13.1 症状
電解質及び体液喪失により血圧低下、心電図異常、血栓塞栓症、急性腎障害、譫妄状態等を起こす可能性がある。
13.2 処置
本剤は血液透析によって除去できない。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は舌の上にのせて唾液を浸潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
14.1.3 本剤は寝たままの状態では、水なしで服用させないこと。
15. その他の注意
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男子にトラセミド2、5、10mg注)を空腹時に単回経口投与したとき、投与後約1時間で最高血漿中濃度に達し、消失半減期は約2時間であった6)。
| 投与量(mg) | 投与条 | Cmax(μg/mL) | Tmax(h) | T1/2β(h) | AUC0-∞(μg・h/mL) |
| 2 | 1mg×2 | 0.23±0.04 | 0.6±0.2 | 2.0±0.8 | 0.45±0.05 |
| 5 | 5mg×1 | 0.48±0.14 | 0.8±0.3 | 2.4±0.6 | 1.28±0.32 |
| 10 | 5mg×2 | 1.40±0.26 | 0.9±0.2 | 2.2±0.4 | 3.55±0.52 |
16.1.2 生物学的同等性試験
トラセミドOD錠8mg「TE」とルプラック錠8mgを、クロスオーバー法によりそれぞれ1錠(トラセミドとして8mg)、健康成人男子に絶食単回経口投与(水で服用及び水なしで服用)して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された7)。
(1)水で服用
| AUC0-12(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | |
| トラセミドOD錠8mg「TE」 | 3327±765.8 | 1427±323.7 | 0.65±0.22 | 2.98±0.51 |
| ルプラック錠8mg | 3281±684.5 | 1443±371.1 | 0.88±0.62 | 3.08±0.42 |
(2)水なしで服用(ルプラック錠8mgは水で服用)
| AUC0-12(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | |
| トラセミドOD錠8mg「TE」 | 3158±683.9 | 1373±322.6 | 0.87±0.37 | 2.92±0.53 |
| ルプラック錠8mg | 3145±650.2 | 1430±377.5 | 0.87±0.39 | 2.96±0.46 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 食事の影響
健康成人男子6例にトラセミド8mgをクロスオーバー法で単回経口投与したとき、食後投与時には未変化体のTmaxの遅延が認められたが、その他の薬物動態パラメータは変化せず、食事の影響は少なかった8)。
16.3 分布
血漿蛋白結合率は97〜99%9)。
16.5 排泄
健康成人にトラセミド2、5、10mg注)を単回経口投与したとき、24時間後の代謝物及び未変化体尿中排泄率は50〜80%であった。このうち20〜30%が未変化体(トラセミド)であった6)。
16.6 特定の背景を有する患者
16.6.1 腎疾患患者
16.6.2 肝・心疾患患者
16.6.3 高齢者
若年者(19〜28歳)及び高齢者(65〜83歳)の健康成人男子にトラセミド5mgを1日1回、8日間反復経口投与し、初日及び8日目の血漿中濃度推移及び尿中排泄率を比較した。その結果、血漿中未変化体の薬物動態パラメータには高齢者と若年者で差がなかった。一方、未変化体の腎クリアランスは高齢者で低下傾向があった。未変化体の腎クリアランスはクレアチニンクリアランスと良好な相関関係が認められ、高齢者においては腎機能の低下により、尿中への排泄が減少したものと推定された。しかし、トラセミドの腎クリアランスは全身クリアランスの約1/4であるため血中薬物動態パラメータに差がなかったと考えられた11)(外国人のデータ)。
16.8 その他
トラセミドOD錠4mg「TE」は、トラセミドOD錠8mg「TE」を標準製剤としたとき、溶出挙動が同等と判断され、生物学的に同等とみなされた7)。
注)本剤の承認用量は1日1回4〜8mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
浮腫患者を対象にトラセミド8mgを1日1回6日間経口投与した二重盲検比較試験の結果は次のとおりであった。
副作用発現頻度は3.5%(4/115例)であった。副作用の内訳は、頭重感、耳鳴、血清尿酸値上昇及び血清カリウム値低下いずれも0.9%(1/115例)であった12)。
副作用発現頻度は3.5%(4/115例)であった。副作用の内訳は、頭重感、耳鳴、血清尿酸値上昇及び血清カリウム値低下いずれも0.9%(1/115例)であった12)。
| 疾患 | 全般改善率(中等度改善以上) |
| 心性浮腫 | 21/28(75.0%) |
| 腎性浮腫 | 35/46(76.1%) |
| 肝性浮腫 | 26/37(70.3%) |
| その他 | 3/4(75.0%) |
| 計 | 85/115(73.9%) |
18. 薬効薬理
18.1 作用機序
18.2 利尿作用
18.3 抗浮腫作用
19. 有効成分に関する理化学的知見
19.1. トラセミド
20. 取扱い上の注意
アルミピロー包装又は容器の開封後は湿気を避けて保存すること。
22. 包装
<トラセミドOD錠4mg「TE」>
100錠[PTP(10錠×10)]
500錠[PTP(10錠×50)]
500錠[バラ]
<トラセミドOD錠8mg「TE」>
100錠[PTP(10錠×10)]
500錠[PTP(10錠×50)]
500錠[バラ]
23. 主要文献
- 太田隆雄ほか, 薬理と治療, 22 (Suppl.5), 1113-1132, (1994)
- 太田隆雄ほか, 薬理と治療, 22 (Suppl.5), 1133-1142, (1994)
- 安藤信明ほか, 薬理と治療, 22 (Suppl.5), 1171-1174, (1994)
- 永澤佳子ほか, 薬理と治療, 22 (Suppl.5), 1175-1178, (1994)
- 梅村昭男ほか, 薬理と治療, 22 (Suppl.5), 1159-1170, (1994)
- 東純一ほか, 臨床医薬, 10 (Suppl.4), 3-18, (1994)
- 信岡史将ほか, 診療と新薬, 55 (2), 100-114, (2018)
- 東純一ほか, 臨床医薬, 10 (Suppl.4), 31-40, (1994)
- 田中千賀子ほか, NEW薬理学 改訂第7版, 434-436, (2017), (南江堂)
- 阿部裕ほか, 臨床医薬, 10 (Suppl.5), 29-61, (1994)
- Barr WH,et al., Prog Pharmacol Clin Pharmacol., 8 (1), 15-28, (1990)
- 阿部裕ほか, 臨床医薬, 13 (10), 2701-2739, (1997)
- 内田武ほか, 基礎と臨床, 28 (8), 2257-2266, (1994)
- Hermes H,et al., Arzneimittelforschung., 35 (10), 1532-1535, (1985) »PubMed
- Wittner M,et al., Pflugers Arch., 407 (6), 611-614, (1986) »PubMed
- 内田武ほか, 基礎と臨床, 28 (8), 2267-2276, (1994)
- 内田武ほか, 基礎と臨床, 28 (8), 2233-2238, (1994)
- 内田武ほか, 基礎と臨床, 28 (8), 2239-2247, (1994)
- 内田武ほか, 基礎と臨床, 30 (3), 471-477, (1996)
- 井上理ほか, 基礎と臨床, 30 (3), 489-496, (1996)
- 木戸秀明ほか, 基礎と臨床, 30 (3), 479-487, (1996)
24. 文献請求先及び問い合わせ先
文献請求先
トーアエイヨー株式会社
くすり相談窓口
〒104-0032
東京都中央区八丁堀3-10-6
電話:0120-387-999
製品情報問い合わせ先
トーアエイヨー株式会社
くすり相談窓口
〒104-0032
東京都中央区八丁堀3-10-6
電話:0120-387-999
26. 製造販売業者等
26.1 製造販売元
トーアエイヨー株式会社
福島県福島市飯坂町湯野字田中1番地