医薬品情報
| 総称名 | オセルタミビル |
|---|---|
| 一般名 | オセルタミビルリン酸塩 |
| 欧文一般名 | Oseltamivir Phosphate |
| 製剤名 | オセルタミビルリン酸塩ドライシロップ |
| 薬効分類名 | 抗インフルエンザウイルス剤 |
| 薬効分類番号 | 6250 |
| ATCコード | J05AH02 |
| KEGG DRUG |
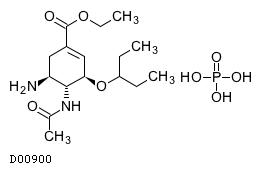
D00900
オセルタミビルリン酸塩
|
| KEGG DGROUP |
DG03029
抗インフルエンザウイルス薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年10月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オセルタミビルDS3%「サワイ」 (後発品) | OSELTAMIVIR Dry Syrup[SAWAI] | 沢井製薬 | 6250021R1032 | 79.5円/g | 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある者
4. 効能または効果
A型又はB型インフルエンザウイルス感染症及びその予防
5. 効能または効果に関連する注意
<治療>
5.1 A型又はB型インフルエンザウイルス感染症と診断された患者のみが対象となるが、抗ウイルス薬の投与がA型又はB型インフルエンザウイルス感染症の全ての患者に対しては必須ではないことを踏まえ、患者の状態を十分観察した上で、本剤の使用の必要性を慎重に検討すること。特に、幼児及び高齢者に比べて、その他の年代ではインフルエンザによる死亡率が低いことを考慮すること。[1.1参照]
<予防>
<効能共通>
6. 用法及び用量
<治療>
成人
通常、オセルタミビルとして1回75mgを1日2回、5日間、用時懸濁して経口投与する。
小児
通常、オセルタミビルとして以下の1回用量を1日2回、5日間、用時懸濁して経口投与する。ただし、1回最高用量はオセルタミビルとして75mgとする。
幼小児の場合
2mg/kg(ドライシロップ剤として66.7mg/kg)
新生児、乳児の場合
3mg/kg(ドライシロップ剤として100mg/kg)
<予防>
成人
通常、オセルタミビルとして1回75mgを1日1回、7〜10日間、用時懸濁して経口投与する。
小児
通常、オセルタミビルとして以下の1回用量を1日1回、10日間、用時懸濁して経口投与する。ただし、1回最高用量はオセルタミビルとして75mgとする。
幼小児の場合
2mg/kg(ドライシロップ剤として66.7mg/kg)
7. 用法及び用量に関連する注意
<治療>
7.1 インフルエンザ様症状の発現から2日以内に投与を開始すること。症状発現から48時間経過後に投与を開始した患者における有効性を裏付けるデータは得られていない。
<予防>
7.2 インフルエンザウイルス感染症患者に接触後2日以内に投与を開始すること。接触後48時間経過後に投与を開始した場合における有効性を裏付けるデータは得られていない。
7.3 インフルエンザウイルス感染症に対する予防効果は、本剤を連続して服用している期間のみ持続する。
<効能共通>
7.4 成人の腎機能障害患者では、血漿中濃度が増加するので、腎機能の低下に応じて、次のような投与法を目安とすること(外国人における成績による)。[8.2、9.2.1、16.6.3参照]
| クレアチニンクリアランス(mL/分) | 投与法 | |
| 治療 | 予防 | |
| Ccr>30 | 1回75mg 1日2回 | 1回75mg 1日1回 |
| 10<Ccr≦30 | 1回75mg 1日1回 | 1回75mg 隔日 又は 1回30mg 1日1回 |
| Ccr≦10 | 推奨用量は確立していない | |
(参考)国外では、幼小児における本剤のクリアランス能を考慮し、以下に示す体重群別固定用量が用いられている。[16.6.1参照]
| 体重 | 固定用量注) |
| 15kg以下 | 1回30mg |
| 15kgを超え23kg以下 | 1回45mg |
| 23kgを超え40kg以下 | 1回60mg |
| 40kgを超える | 1回75mg |
8. 重要な基本的注意
8.1 抗インフルエンザウイルス薬の服用の有無又は種類にかかわらず、インフルエンザ罹患時には、異常行動を発現した例が報告されている。異常行動による転落等の万が一の事故を防止するための予防的な対応として、(1)異常行動の発現のおそれがあること、(2)自宅において療養を行う場合、少なくとも発熱から2日間、保護者等は転落等の事故に対する防止対策を講じること、について患者・家族に対し説明を行うこと。なお、転落等の事故に至るおそれのある重度の異常行動については、就学以降の小児・未成年者の男性で報告が多いこと、発熱から2日間以内に発現することが多いこと、が知られている。[11.1.7参照]
8.2 本剤は腎排泄型の薬剤であり、腎機能が低下している場合には血漿中濃度が高くなるおそれがあるので、本剤の投与に際しては、クレアチニンクリアランス値に応じた用法及び用量に関連する注意に基づいて、状態を観察しながら慎重に投与すること。[7.4、9.2.1、16.6.3参照]
8.4 細菌感染症がインフルエンザウイルス感染症に合併したり、インフルエンザ様症状と混同されることがあるので、細菌感染症の場合には、抗菌剤を投与するなど適切な処置を行うこと。[5.4参照]
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性に投与する場合には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で胎盤通過性が報告されている。[16.3.1参照]
9.6 授乳婦
治療の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト母乳中へ移行することが報告されている。
9.7 小児等
9.8 高齢者
状態を観察しながら投与すること。一般に高齢者では、生理機能(腎機能、肝機能等)の低下や、種々の基礎疾患を有することが多い。国外で実施されたカプセル剤による臨床試験成績では、副作用の頻度及び種類は非高齢者との間に差は認められていない。[16.6.2参照]
10. 相互作用
10.2 併用注意
| ワルファリン | 併用後にプロトロンビン時間が延長した報告がある。併用する場合には、患者の状態を十分に観察するなど注意すること。 | 機序は不明である。 |
| 経鼻弱毒生インフルエンザワクチン | 経鼻弱毒生インフルエンザワクチンの効果が得られないおそれがある。 | ワクチンウイルスの増殖が抑制され、経鼻弱毒生インフルエンザワクチンの効果が減弱する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(頻度不明)
蕁麻疹、顔面・喉頭浮腫、呼吸困難、血圧低下等があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.2 肺炎(頻度不明)
異常が認められた場合にはX線等の検査により原因(薬剤性、感染性等)を鑑別し、適切な処置を行うこと。
11.1.3 劇症肝炎、肝機能障害、黄疸(頻度不明)
重篤な肝炎、AST、ALT、γ-GTP、Al-Pの著しい上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.1.4 皮膚粘膜眼症候群(Stevens-Johnson症候群)、中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)
11.1.5 急性腎障害(頻度不明)
11.1.6 白血球減少、血小板減少(頻度不明)
11.1.7 精神・神経症状、異常行動(頻度不明)
精神・神経症状(意識障害、譫妄、幻覚、妄想、痙攣等)があらわれることがある。因果関係は不明であるものの、インフルエンザ罹患時には、転落等に至るおそれのある異常行動(急に走り出す、徘徊する等)があらわれることがある。[8.1参照]
11.1.8 出血性大腸炎、虚血性大腸炎(頻度不明)
血便、血性下痢等の異常が認められた場合には投与を中止し、適切な処置を行うこと。[8.3参照]
11.2 その他の副作用
| 0.1%以上注1) | 0.1%未満注1) | 頻度不明 | |
| 皮膚 | 発疹(0.8%)、紅斑(多形紅斑を含む) | 蕁麻疹、そう痒症 | 皮下出血注2) |
| 消化器 | 下痢(2.8%)、嘔吐(2.0%)、腹痛、悪心 | 口内炎(潰瘍性を含む)、便異常 | 口唇炎、血便注2)、メレナ注2)、吐血注2)、消化性潰瘍、腹部膨満、口腔内不快感、食欲不振 |
| 精神神経系 | 激越、嗜眠、傾眠、振戦 | めまい、頭痛、不眠症、感覚鈍麻、悪夢 | |
| 循環器 | 上室性頻脈、心室性期外収縮、心電図異常(ST上昇)、動悸 | ||
| 肝臓 | ALT増加、AST増加 | γ-GTP増加、Al-P増加 | |
| 腎臓 | 血尿注2)、蛋白尿 | ||
| 血液 | 好酸球数増加 | ||
| 呼吸器 | 鼻出血注2)、気管支炎 | 咳嗽 | |
| 眼 | 結膜炎 | 視覚障害(視野欠損、視力低下)、霧視、複視、眼痛 | |
| その他 | 低体温(0.8%) | 発熱 | 疲労、不正子宮出血注2)、耳の障害(灼熱感、耳痛等)、浮腫、血中ブドウ糖増加、背部痛、胸痛 |
13. 過量投与
13.1 症状
嘔吐、傾眠、浮動性めまい等が発現することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 国内で実施されたカプセル剤による第III相予防試験において、糖尿病が増悪したとの報告が1例ある。また、国外で実施されたカプセル剤による第III相予防試験では、糖代謝障害を有する被験者で糖尿病悪化又は高血糖が7例にみられた(外国人データ)。非臨床試験においては、臨床用量の100倍までの用量において糖代謝阻害は認められていない。
15.1.2 国外で実施されたカプセル剤による慢性心疾患患者及び慢性呼吸器疾患患者を対象とした第III相治療試験において、インフルエンザ罹病期間に対する有効性ではプラセボに対し有意な差はみられていない。しかし、本剤投与によりウイルス放出期間を有意に短縮し、その結果、発熱、筋肉痛/関節痛又は悪寒/発汗の回復期間が有意に短縮した(外国人データ)。
15.1.3 国外で実施されたドライシロップ剤による慢性喘息合併小児を対象とした第III相治療試験において、有効性を検証するには至っていない。一方、安全性において特に大きな問題はみられていない(外国人データ)。
15.1.4 シーズン中に重複してインフルエンザに罹患した患者に本剤を繰り返して使用した経験はない。
15.1.5 国外ではドライシロップ剤及びカプセル剤による免疫低下者の予防試験において、12週間の投与経験がある(外国人データ)。
15.2 非臨床試験に基づく情報
15.2.1 幼若ラットの単回経口投与毒性試験において、オセルタミビルリン酸塩を394、657、788、920、1117、1314mg/kgの用量で単回経口投与した時、7日齢ラットでは薬物に関連した死亡が657mg/kg以上で認められた。しかし、394mg/kgを投与した7日齢ラット及び1314mg/kgを投与した成熟ラット(42日齢)では死亡は認められなかった。[9.7参照]
15.2.2 幼若ラットの単回経口投与トキシコキネティクス試験において、毒性が認められなかった用量におけるオセルタミビルの脳/血漿中AUC比は、7日齢ラットで0.31(394mg/kg)、成熟ラット(42日齢)で0.22(1314mg/kg)であった。[9.7参照]
16. 薬物動態
16.1 血中濃度
16.1.1 剤形間の生物学的同等性
タミフルカプセル75及びタミフルドライシロップ3%は成人被験者による生物学的同等性試験成績より、両製剤は同等であることが示された1)(外国人データ)。
| 剤形 | AUCinf (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | t1/2 (hr) |
| タミフルドライシロップ3% | 6,870±1,360 | 546±101 | 5.1±1.5 | 7.2±1.7 |
| タミフルカプセル75 | 6,940±1,620 | 615±147 | 4.5±1.0 | 6.4±1.5 |
16.1.2 生物学的同等性試験
オセルタミビルDS3%「サワイ」とタミフルドライシロップ3%を健康成人男子にそれぞれ2.5g(オセルタミビルとして75mg)空腹時単回経口投与(クロスオーバー法)し、血漿中オセルタミビル濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された2)。
| Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | AUC0-24hr (ng・hr/mL) | |
| オセルタミビルDS3%「サワイ」 | 51.5±24.5 | 0.9±0.7 | 1.5±0.4 | 120.2±33.9 |
| タミフルドライシロップ3% | 45.1±17.6 | 1.4±1.0 | 1.5±0.4 | 123.0±33.0 |
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
16.3.1 組織分布
16.3.2 蛋白結合率
オセルタミビル及びその活性体のヒト、ラット、ウサギ及びイヌ血漿蛋白との結合率は、オセルタミビルでは全ての種類において50%以下の結合であったが、活性体ではいずれの種類においても平均で3%以下の弱いものであった4)(in vitro試験)。
16.4 代謝
オセルタミビルはヒトにおいて経口投与後速やかに主として肝臓で活性体に加水分解される。また、ヒト肝ミクロソームを用いた代謝試験において、P450による代謝は認められなかった5)(in vitro試験)。
16.5 排泄
16.5.1 尿中排泄
健康成人男子に対しオセルタミビルとして37.5〜300mgを単回経口投与注1)したとき、未変化体及び活性体あわせて投与48時間後までに70〜80%が尿中に排泄された6)。
16.5.2 乳汁中移行
授乳ラットに[14C]-オセルタミビル10mg/kgを単回経口投与した際、放射能は乳汁中に移行し、投与1時間後で最高濃度に達した。その後、血漿中とほぼ同様な推移で消失したが、乳汁中/血漿中濃度比は常に乳汁中において高かった7)。
16.6 特定の背景を有する患者
16.6.1 小児における薬物動態
(1)日本人における成績
国内第II相臨床試験において、オセルタミビルとして2mg/kgを1日2回投与時の定常状態におけるオセルタミビル活性体の投与後4時間及び12時間における血漿中濃度を可能な患児において測定した。その結果、トラフに相当する血漿中活性体濃度12hr値はいずれの年齢層においても115ng/mL以上であり、抗インフルエンザウイルス効果を期待できる濃度を維持していた8)。
| 血漿中活性体濃度 (ng/mL) | 項目 | 1〜4歳 | 5〜8歳 | 9〜12歳 | 全体 |
| 4hr | 例数 | 7 | 5 | 4 | 16 |
| 平均 | 264.0 | 328.6 | 354.8 | 306.9 | |
| 標準偏差 | 56.0 | 30.8 | 81.2 | 66.7 | |
| 中央値 | 252.0 | 330.0 | 346.5 | 308.5 | |
| 最小-最大 | 188.0-366.0 | 280.0-355.0 | 265.0-461.0 | 188.0-461.0 | |
| CV | 21.2 | 9.4 | 22.9 | 21.7 | |
| 90%信頼区間 | 222.9-305.1 | 299.3-357.9 | 259.2-450.3 | 277.6-336.1 | |
| 12hr | 例数 | 8 | 5 | 2 | 15 |
| 平均 | 170.4 | 165.4 | 240.5 | 178.1 | |
| 標準偏差 | 31.6 | 40.7 | 13.4 | 40.4 | |
| 中央値 | 162.5 | 167.0 | 240.5 | 167.0 | |
| 最小-最大 | 128.0-217.0 | 115.0-216.0 | 231.0-250.0 | 115.0-250.0 | |
| CV | 18.6 | 24.6 | 5.6 | 22.7 | |
| 90%信頼区間 | 149.2-191.6 | 126.6-204.2 | 180.5-300.5 | 159.7-196.4 |
(2)外国人における成績
健康な男女小児を対象とした2つの臨床試験において、1〜5歳を1〜2歳、3〜5歳の2グループ(各12例)及び5〜18歳を5〜8歳、9〜12歳及び13〜18歳の3グループ(各6例)に分け、食後にオセルタミビルとして2.0〜3.9mg/kgを単回経口投与注1)したとき、1〜2歳における活性体のAUCinfは2,810ng・hr/mLで3〜5歳に比較して16%低かった。また、年齢5〜18歳において年齢5〜8歳のグループでは13〜18歳のグループに比較し活性体の消失は速く、結果として曝露量の低下が認められた。年齢5〜8歳のグループにおける活性体のAUCinfは年齢13〜18歳のグループに比較し60%であった9)。
これら小児グループにおける活性体の薬物動態パラメータをオセルタミビル75mg及び150mg反復投与注1)した日本人及び白人の成人における臨床試験より得られた薬物動態パラメータと比較したとき、年齢5〜8歳のグループにおけるAUCinfは成人の75mg(1mg/kgに相当)投与における投与1日目のAUCinfと同様であり、年齢9〜12歳のグループでは成人の75mg及び150mgの間にあり、年齢13〜18歳のグループでは成人の150mg(2mg/kgに相当)と同様であった(外国人データ)。同様に、すべての年齢グループにおける投与12時間後における血漿中活性体濃度は成人における投与量150mgにおける値を越えるものでなく、抗インフルエンザウイルス活性を期待できる濃度を維持した10)11)。
これら小児グループにおける活性体の薬物動態パラメータをオセルタミビル75mg及び150mg反復投与注1)した日本人及び白人の成人における臨床試験より得られた薬物動態パラメータと比較したとき、年齢5〜8歳のグループにおけるAUCinfは成人の75mg(1mg/kgに相当)投与における投与1日目のAUCinfと同様であり、年齢9〜12歳のグループでは成人の75mg及び150mgの間にあり、年齢13〜18歳のグループでは成人の150mg(2mg/kgに相当)と同様であった(外国人データ)。同様に、すべての年齢グループにおける投与12時間後における血漿中活性体濃度は成人における投与量150mgにおける値を越えるものでなく、抗インフルエンザウイルス活性を期待できる濃度を維持した10)11)。
| 小児グループ(例数) | AUCinf (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | t1/2 (hr) |
| 1〜2歳注2)(12) | 2,810±871 | 121±51 | 5.6±2.2 | 14.9±7.3 |
| 3〜5歳注2)(12) | 3,350±678 | 179±73 | 5.0±2.3 | 11.3±5.5 |
| 5〜8歳(6) | 2,746±368 | 183±36 | 3.7±0.5 | 8.8±2.0 |
| 9〜12歳(6) | 3,208±394 | 231±46 | 3.7±0.5 | 7.8±1.8 |
| 13〜18歳(6) | 4,534±929 | 319±76 | 4.3±0.8 | 8.1±2.2 |
| 投与量 (mg) | AUCinf (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | t1/2 (hr) |
| 75 (日本人) | 2,107±374 | 191±32.5 | 4.91±1.02 | 6.46±1.42 |
| 75 (白人) | 2,274±1,105 | 142±39.7 | 5.84±1.16 | 10.0±6.86 |
| 150 (日本人) | 5,189±1,187 | 468±84.3 | 5.16±0.754 | 6.30±1.95 |
| 150 (白人) | 5,036±1,524 | 383±98.6 | 4.42±1.11 | 7.81±5.23 |
(3)国内小児と国外小児における血中濃度の比較
用量を2mg/kgに補正した日本人小児における定常状態での血漿中活性体濃度4hr値及び12hr値につき、3つの国外小児試験より用量(2mg/kg)及び定常状態への補正を行った4hr値及び12hr値と比較した。この結果、日本人小児における4hr値及び12hr値は国外小児における4hr値及び12hr値の分布の範囲内にあった12)(日本人及び外国人データ)。
16.6.2 高齢者(80歳以上)における薬物動態
16.6.3 腎機能障害者における薬物動態
クレアチニンクリアランス(Ccr)値により規定された腎機能障害者を含む20例を対象とし、オセルタミビルとして100mg1日2回を6日間反復投与注1)したときの活性体薬物動態は、以下の表のとおり腎機能に依存した。高度な腎機能障害者においては投与量の調整が必要であると考えられた14)(外国人データ)。[7.4、8.2、9.2.1参照]
| Ccr値 (mL/分) | AUC0-12h (ng・hr/mL) | Cmax (ng/mL) | CLr0-12h (L/hr) |
| Ccr≦30 | 43,086±18,068 | 4,052±1,519 | 1.54±0.55 |
| 30<Ccr≦60 | 15,010±4,158 | 1,514±392 | 4.19±0.67 |
| 60<Ccr≦90 | 9,931±1,636 | 1,058±183 | 7.25±1.15 |
| Ccr>90 | 4,187±630 | 494±80 | 17.50±2.78 |
16.7 薬物相互作用
P450を介した薬物相互作用の検討において、オセルタミビルはヒト肝ミクロソームにおける各種P450基質の代謝に対してほとんど影響を与えなかった15)(in vitro試験)。
また、オセルタミビルは尿酸排泄促進薬のプロベネシドとの併用により腎クリアランスの低下、AUCinf及びCmaxの約2倍の増加が認められた。このことはアニオン型輸送過程を経て腎尿細管分泌されるオセルタミビルは同経路で排泄される薬剤との併用により競合的相互作用を生ずる可能性を示唆している。しかし、この競合による薬物動態の変化の割合は、投与量の調整が必要であるほど臨床的に重要ではない16)(外国人データ)。なお、インフルエンザウイルス感染症に伴う症状緩和のために併用される可能性がある薬物(抗ヒスタミン薬、マクロライド系抗生物質、NSAIDs等)及び心電図に影響を与える可能性のある薬剤(抗不整脈薬等)の多くの薬物との相互作用は検討されていない。
また、オセルタミビルは尿酸排泄促進薬のプロベネシドとの併用により腎クリアランスの低下、AUCinf及びCmaxの約2倍の増加が認められた。このことはアニオン型輸送過程を経て腎尿細管分泌されるオセルタミビルは同経路で排泄される薬剤との併用により競合的相互作用を生ずる可能性を示唆している。しかし、この競合による薬物動態の変化の割合は、投与量の調整が必要であるほど臨床的に重要ではない16)(外国人データ)。なお、インフルエンザウイルス感染症に伴う症状緩和のために併用される可能性がある薬物(抗ヒスタミン薬、マクロライド系抗生物質、NSAIDs等)及び心電図に影響を与える可能性のある薬剤(抗不整脈薬等)の多くの薬物との相互作用は検討されていない。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験(治療試験、小児)
小児(1〜12歳)を対象とした第II相臨床試験(JV16284、5日間投与)において、インフルエンザ感染が確認された59例(インフルエンザ感染はウイルス分離より判定した。)におけるインフルエンザ罹病期間(咳、鼻症状が改善し、体温37.4℃以下に回復するまでの時間)は72.5時間(中央値)であった。また、投薬中の体温が37.8℃未満に回復するまでの時間は21.3時間(中央値)であり、平熱(37.4℃以下)に回復するまでの時間は35.3時間(中央値)であった17)。
副作用は70例中35例(50.0%)に認められ、嘔吐17件(24.3%)、下痢14件(20.0%)等であった。
副作用は70例中35例(50.0%)に認められ、嘔吐17件(24.3%)、下痢14件(20.0%)等であった。
17.1.2 海外第III相試験(治療試験、小児)
米国及びカナダにおいて1〜12歳の小児で実施されたプラセボを対照とした第III相臨床試験(WV15758)の5日間投与におけるインフルエンザ罹病期間(咳、鼻症状が改善し、体温37.2℃以下、罹患前の日常生活に回復するまでの時間)に対する有効性を以下に示す。
| 薬剤 | 投与期間 | 症例数注2) | インフルエンザ罹病期間 中央値(95%信頼区間) |
| オセルタミビルリン酸塩注1) | 5日間 | 217例 | 101.3時間注3) (88.8-118.3) |
| プラセボ | 5日間 | 235例 | 137.0時間 (124.5-149.6) |
17.1.3 海外第III相試験(治療試験、小児)
慢性喘息合併患児(5〜12歳)に対するプラセボを対照とした第III相臨床試験(WV15759/WV15871、5日間投与)は、目標症例数500例に対し登録例数は335例であった。このため、オセルタミビルリン酸塩の有効性を検証するには至っていないが、インフルエンザ罹病期間(中央値)はオセルタミビルリン酸塩123.9時間、プラセボ134.3時間であった。
また、本試験において、開始時と比較した努力性呼気1秒量(FEV1)の変化率はオセルタミビルリン酸塩10.8%、プラセボ4.7%であった20)(外国人データ)。
オセルタミビルリン酸塩投与群の因果関係が否定できない有害事象は170例中45例(26.5%)に認められた。
また、本試験において、開始時と比較した努力性呼気1秒量(FEV1)の変化率はオセルタミビルリン酸塩10.8%、プラセボ4.7%であった20)(外国人データ)。
オセルタミビルリン酸塩投与群の因果関係が否定できない有害事象は170例中45例(26.5%)に認められた。
17.1.4 国内第III相試験(予防試験)
プラセボを対照とした第III相臨床試験(JV15824)の42日間投与注4)におけるインフルエンザ感染症の発症抑制効果を以下に示す。本試験は高齢者を含む健康成人308例(プラセボ:19歳-83歳、平均34.0歳、65歳以上の高齢者は10例、オセルタミビルリン酸塩:18歳-77歳、平均34.2歳、65歳以上の高齢者は11例)を対象とした。
国内二重盲検比較試験において、インフルエンザ感染症発症率はプラセボ群8.5%、オセルタミビルリン酸塩投与群1.3%であった21)。
国内二重盲検比較試験において、インフルエンザ感染症発症率はプラセボ群8.5%、オセルタミビルリン酸塩投与群1.3%であった21)。
注4)治療投与:成人に対して承認された用法及び用量は、1回75mgを1日2回、5日間投与である。幼小児に対して承認された用法及び用量は、1回2mg/kgを1日2回、5日間投与である。
予防投与:成人に対して承認された用法及び用量は、1回75mgを1日1回、7〜10日間投与である。幼小児に対して承認された用法及び用量は、1回2mg/kgを1日1回、10日間投与である。
予防投与:成人に対して承認された用法及び用量は、1回75mgを1日1回、7〜10日間投与である。幼小児に対して承認された用法及び用量は、1回2mg/kgを1日1回、10日間投与である。
| プラセボ | オセルタミビルリン酸塩注5) | p=0.0032 (95%信頼区間: 2.4%-12.0%) | |
| 対象例数 | 153 | 155 | |
| 感染症発症例(率)注6) | 13(8.5%) | 2(1.3%) |
オセルタミビルリン酸塩投与群の副作用は155例中34例(21.9%)に認められ、上腹部痛8例(5.2%)、下痢7例(4.5%)等であった22)。
17.1.5 海外第III相試験(予防試験)
米国において実施された健康成人(18歳以上)を対象としたプラセボ対照第III相臨床試験(WV15673/697)の42日間投与注4)におけるインフルエンザ感染症の発症抑制効果及び患者背景を以下に示す。
二重盲検比較試験において、インフルエンザ感染症発症率はプラセボ群4.8%、オセルタミビルリン酸塩投与群1.2%であった23)(外国人データ)。
二重盲検比較試験において、インフルエンザ感染症発症率はプラセボ群4.8%、オセルタミビルリン酸塩投与群1.2%であった23)(外国人データ)。
| プラセボ | オセルタミビルリン酸塩注5) | p=0.0006 (95%信頼区間: 1.6%-5.7%) | |
| 対象例数 | 519 | 520 | |
| 感染症発症例(率)注7) | 25(4.8%) | 6(1.2%) | |
| 年齢(歳)(平均) | 18-64(35.0) | 18-65(34.4) |
オセルタミビルリン酸塩投与群の因果関係が否定できない有害事象は520例中250例(48.1%)に認められた。
17.1.6 海外第III相試験(予防試験、高齢者)
高齢者を対象としたプラセボ対照二重盲検比較試験(WV15825、42日間投与注4))におけるインフルエンザ感染症発症率は非予防群4.4%、オセルタミビルリン酸塩投与群0.4%であった。ワクチン接種者におけるインフルエンザ感染症発症率は、プラセボ投与群5.0%、オセルタミビルリン酸塩投与群0.5%であった24)(外国人データ)。患者背景を以下に示す。
| 試験番号 | WV15825 n=548 | |
| 対象 | 高齢者(65歳以上)注8) | |
| 薬剤 | プラセボ n=272 | オセルタミビルリン酸塩 n=276 |
| 年齢(歳)(平均) | 64-96(81.8) | 65-96(80.5) |
オセルタミビルリン酸塩投与群の因果関係が否定できない有害事象は276例中40例(14.5%)に認められた。
17.1.7 海外第III相試験(患者接触後予防試験)
インフルエンザ感染症患者接触後のプラセボ対照二重盲検比較試験(WV15799、7日間投与)におけるインフルエンザ感染症発症率は非予防群12.0%、オセルタミビルリン酸塩投与群1.0%であった25)(外国人データ)。患者背景を以下に示す。
| 試験番号 | WV15799 n=955 | |
| 対象 | 13歳以上 | |
| 薬剤 | プラセボ n=461 | オセルタミビルリン酸塩 n=494 |
| 年齢(歳)(平均) | 12-85(33.8) | 13-82(33.2) |
オセルタミビルリン酸塩投与群の有害事象は494例中124例(25.1%)に認められ、嘔気27例(5.5%)、頭痛12例(2.4%)、上腹部痛9例(1.8%)等であった。
17.1.8 海外第III相試験(患者接触後予防試験)
インフルエンザ感染症患者接触後の予防群と非予防群のオープン比較試験(WV16193、10日間投与)におけるインフルエンザ感染症発症率は非予防群11.3%、オセルタミビルリン酸塩投与群1.8%であった26)(外国人データ)。患者背景を以下に示す。
| 試験番号 | WV16193 n=808 | |
| 対象 | 1歳以上 | |
| 薬剤 | 非予防群 n=392 | 予防群 n=416 |
| 年齢(歳)(平均) | 1-83(26.2) | 1-80(27.7) |
また、本試験では1〜12歳の小児が含まれており、この集団にはオセルタミビルリン酸塩ドライシロップ剤が年齢別固定用量注4)で投与された。発症抑制効果について、小児におけるインフルエンザ感染症発症率は非予防群で21.4%、予防群で4.3%であった。
| 非予防群 | 予防群 | p=0.0206 | |
| 対象例数 | 70 | 47 | |
| 感染症発症例(率)注9) | 15(21.4%) | 2(4.3%) |
18. 薬効薬理
18.1 作用機序
オセルタミビルリン酸塩の活性体はヒトA型及びB型インフルエンザウイルスのノイラミニダーゼを選択的に阻害し(IC50:0.1〜3nM)、新しく形成されたウイルスの感染細胞からの遊離を阻害することにより、ウイルスの増殖を抑制する27)。
18.2 in vitro抗ウイルス作用
オセルタミビルリン酸塩はプロドラッグであり、代謝により活性体に変換された後、抗ウイルス作用を示す。
オセルタミビルリン酸塩の活性体はin vitroでのA型及びB型インフルエンザウイルスの複製を低濃度(実験室株IC50:0.6〜155nM、臨床分離株IC50:<0.35μM)で阻害した28)。
オセルタミビルリン酸塩の活性体はin vitroでのA型及びB型インフルエンザウイルスの複製を低濃度(実験室株IC50:0.6〜155nM、臨床分離株IC50:<0.35μM)で阻害した28)。
18.3 in vivo抗ウイルス作用
18.4 耐性
耐性ウイルスは全てA型ウイルスに由来し、B型では出現が認められなかった。耐性を獲得したウイルスでは、マウス及びフェレットにおいて感染性の低下が認められ、感染部位での増殖、伝播力は低いと考えられる。耐性を獲得したウイルスでは、ノイラミニダーゼのアミノ酸変異が認められている32)。
19. 有効成分に関する理化学的知見
19.1. オセルタミビルリン酸塩
20. 取扱い上の注意
20.1 使用期限内であっても開栓後はなるべく速やかに使用すること。
20.2 吸湿性があるので、開栓後は密栓し、湿気を避けて保存すること。
20.3 開栓後4週間以上保存する場合は、冷蔵庫又は冷所(10℃以下)で保存すること。なお使用時は、結露を避けて開栓すること。
22. 包装
バラ[乾燥剤入り]:30g
23. 主要文献
- ドライシロップ剤(市販用,治験用)及びカプセル剤間の生物学的同等性(海外:WP16225)(タミフルドライシロップ:2002年1月17日承認、申請資料概要ヘ.1-3-1)
- 竹内譲他, 新薬と臨床, 67 (4), 403-415, (2018)
- 臓器、組織内濃度(タミフルカプセル:2000年12月12日承認、申請資料概要ヘ.2-2-1)
- 血漿蛋白質との結合(タミフルカプセル:2000年12月12日承認、申請資料概要ヘ.2-2-4)
- in vitro代謝(タミフルカプセル:2000年12月12日承認、申請資料概要ヘ.2-3-2)
- 健康成人における単回投与試験(国内:JP15734)(タミフルカプセル:2000年12月12日承認、申請資料概要ヘ.3-1)
- 乳汁中への移行(タミフルカプセル:2000年12月12日承認、申請資料概要ヘ.2-4-3)
- 小児における薬物動態(国内:JV16284)(タミフルドライシロップ:2002年1月17日承認、申請資料概要ヘ.1-2-3)
- 小児における薬物動態(海外:NP15826,WV15758,PP16351)(タミフルドライシロップ:2002年1月17日承認、申請資料概要ヘ.1-2-1)
- 小児及び成人における薬物動態の比較(海外WV:15758,NP15826)(タミフルドライシロップ:2002年1月17日承認、申請資料概要ヘ.1-2-2)
- 日本人と白人での反復投与試験(薬物動態直接比較試験)(海外:JP15735)(タミフルカプセル:2000年12月12日承認、申請資料概要ヘ.3-5)
- 国内小児と海外小児及び国内外の成人における血中濃度の比較(タミフルドライシロップ:2002年1月17日承認、申請資料概要ヘ.1-2-4)
- Abe,M.et al., Ann.Pharmacother., 40, 1724-1730, (2006) »PubMed
- 腎機能障害を伴う被験者による反復投与試験(海外:WP15648)(タミフルカプセル:2000年12月12日承認、申請資料概要ヘ.3-7-1)
- in vitro薬物相互作用(タミフルカプセル:2000年12月12日承認、申請資料概要ヘ.2-3-5)
- 腎排泄型薬剤(シメチジン/プロベネシド)との薬物相互作用(海外:WP15728)(タミフルカプセル:2000年12月12日承認、申請資料概要ヘ.3-8-2)
- 小児における第II相試験(国内:JV16284)(タミフルドライシロップ:2002年1月17日承認、申請資料概要ト.1-2-1)
- Whitley,R.J.et al., Pediatr.Infect.Dis.J., 20, 127-133, (2001) »PubMed
- 小児における第III相試験(海外:WV15758)(タミフルドライシロップ:2002年1月17日承認、申請資料概要ト.1-1-4)
- 慢性喘息合併小児における第III相治療試験(海外:WV15759/15871)(タミフルドライシロップ:2002年1月17日承認、申請資料概要ト.1-1-4)
- 柏木征三郎他, 感染症学雑誌, 74, 1062-1076, (2000) »PubMed
- 第III相予防試験の安全性のまとめ(国内:JV15824)(タミフルカプセル:2004年7月9日承認、申請資料概要ト.2-2-1)
- 成人に対する第III相予防試験(42日間投与)(海外:WV15673/15697)(タミフルカプセル:2004年7月9日承認、申請資料概要ト.1-3-2)
- 高齢者に対する第III相予防試験(42日間投与)(海外:WV15825)(タミフルカプセル:2004年7月9日承認、申請資料概要ト.1-3-2)
- 第III相予防試験(7日間投与)(海外:WV15799)(タミフルカプセル:2004年7月9日承認、申請資料概要ト.1-3-2)
- 第III相予防試験(10日間投与)(海外:WV16193)(タミフルカプセル:2004年7月9日承認、申請資料概要ト.1-3-2)
- ノイラミニダーゼ阻害作用(タミフルカプセル:2000年12月12日承認、申請資料概要ホ-1.1)
- ヒトインフルエンザA型及びB型ウイルスにおけるin vitro増殖抑制作用(タミフルカプセル:2000年12月12日承認、申請資料概要イ.1-1-5,ホ-1.2)
- Sidwell,R.W.et al., Antiviral Res., 37, 107-120, (1998) »PubMed
- Mendel,D.B.et al., Antimicrob.Agents Chemother., 42, 640-646, (1998) »PubMed
- 動物モデルにおける効果ニワトリ感染モデル(タミフルカプセル:2000年12月12日承認、申請資料概要ホ-1.3-3)
- 耐性(タミフルカプセル:2004年7月9日承認、申請資料概要ト.1-4)
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
25. 保険給付上の注意
本剤は「A型又はB型インフルエンザウイルス感染症の発症後の治療」の目的で使用した場合にのみ保険給付されます。
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30