医薬品情報
| 総称名 | ファムシクロビル |
|---|---|
| 一般名 | ファムシクロビル |
| 欧文一般名 | Famciclovir |
| 製剤名 | ファムシクロビル錠 |
| 薬効分類名 | 抗ヘルペスウイルス剤 |
| 薬効分類番号 | 6250 |
| ATCコード | J05AB09 |
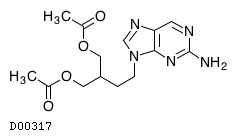
| KEGG DRUG |
D00317
ファムシクロビル
|
| KEGG DGROUP |
DG02840
抗ヘルペスウイルス薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年2月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ファムシクロビル錠250mg「日本臓器」 (後発品) | Famciclovir Tab. 250mg "Nippon-zoki" | 小財家興産 | 6250031F1137 | 77.5円/錠 | 処方箋医薬品 |
| ファムシクロビル錠500mg「日本臓器」 (後発品) | Famciclovir Tab. 500mg "Nippon-zoki" | 小財家興産 | 6250031F2044 | 123.4円/錠 | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
ファムシクロビル錠250mg「日本臓器」
<単純疱疹>
通常、成人にはファムシクロビルとして1回250mgを1日3回経口投与する。
<帯状疱疹>
通常、成人にはファムシクロビルとして1回500mgを1日3回経口投与する。
ファムシクロビル錠500mg「日本臓器」
<帯状疱疹>
通常、成人にはファムシクロビルとして1回500mgを1日3回経口投与する。
7. 用法及び用量に関連する注意
ファムシクロビル錠250mg「日本臓器」
<効能共通>
<単純疱疹>
7.3 本剤の投与は、発病初期に近いほど効果が期待できるので、早期に投与を開始すること。
7.4 本剤は、原則として、5日間使用すること。改善の兆しが見られないか、あるいは悪化する場合には、速やかに他の治療に切り替えること。
<帯状疱疹>
7.5 本剤の投与は、発病初期に近いほど効果が期待できるので、早期に投与を開始すること。なお、目安として、皮疹出現後5日以内に投与を開始することが望ましい。
7.6 本剤は、原則として、7日間使用すること。改善の兆しが見られないか、あるいは悪化する場合には、速やかに他の治療に切り替えること。
ファムシクロビル錠500mg「日本臓器」
<効能共通>
<帯状疱疹>
7.5 本剤の投与は、発病初期に近いほど効果が期待できるので、早期に投与を開始すること。なお、目安として、皮疹出現後5日以内に投与を開始することが望ましい。
7.6 本剤は、原則として、7日間使用すること。改善の兆しが見られないか、あるいは悪化する場合には、速やかに他の治療に切り替えること。
8. 重要な基本的注意
8.1 意識障害等があらわれることがあるので、自動車の運転等、危険を伴う機械の操作に従事する際には注意するよう患者に十分に説明すること。
8.2 急性腎障害があらわれることがあるので、腎機能検査を行うなど観察を十分に行うこと。[11.1.3参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 免疫機能の低下(造血幹細胞移植、臓器移植、HIV感染による)を伴う患者
有効性及び安全性は確立していない。
9.2 腎機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性に投与する場合には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[16.3.4参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)において乳汁中に移行することが報告されている。[16.3.4参照]
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
10. 相互作用
10.2 併用注意
| プロベネシド | 本剤の活性代謝物であるペンシクロビルはプロベネシドと併用した場合、排泄が抑制され、ペンシクロビルの血漿中濃度半減期の延長及び血漿中濃度曲線下面積が増加するおそれがある。 | 本剤の活性代謝物であるペンシクロビルは主として腎臓の尿細管分泌により排泄されることから、プロベネシドによりペンシクロビルの排泄が抑制される可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 精神神経症状(頻度不明)
錯乱、幻覚、意識消失、痙攣、せん妄、脳症、意識障害(昏睡)、てんかん発作などがあらわれることがある。錯乱は主に高齢者であらわれることが報告されている。[9.8参照]
11.1.2 重篤な皮膚障害(頻度不明)
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、多形紅斑等の重篤な皮膚反応があらわれることがある。
11.1.3 急性腎障害(頻度不明)[8.2参照]
11.1.4 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがある。
11.1.5 ショック、アナフィラキシー(いずれも頻度不明)
蕁麻疹、血圧低下、呼吸困難等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.6 汎血球減少、無顆粒球症、血小板減少、血小板減少性紫斑病(いずれも頻度不明)
11.1.7 呼吸抑制(頻度不明)
11.1.8 間質性肺炎(頻度不明)
11.1.9 肝炎、肝機能障害、黄疸(いずれも頻度不明)
11.1.10 急性膵炎(頻度不明)
注2)発現頻度は使用成績調査の結果を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 精神神経系 | 頭痛、傾眠、めまい | 鎮静、失見当識、意識障害 | |
| 腎臓 | 尿中蛋白陽性、BUN増加、血中クレアチニン増加、尿中血陽性 | 尿失禁、尿円柱、尿中白血球、尿中赤血球 | |
| 血液 | 白血球数増加、白血球数減少、赤血球数減少、ヘモグロビン減少、ヘマトクリット減少、好酸球増加、血小板数増加 | 血小板減少症、好中球減少、好中球増加、単球増加、リンパ球増加、リンパ球減少、ヘマトクリット増加 | |
| 肝臓 | ALT増加、AST増加、LDH増加、尿中ウロビリノーゲン増加、γ-GTP増加、ALP増加、黄疸 | ||
| 消化器 | 下痢、悪心、腹部不快感、腹痛、口渇、嘔吐、口唇乾燥、便秘 | 胃炎、白色便、口内炎、食欲減退 | |
| 過敏症 | 発疹 | 蕁麻疹 | そう痒症 |
| 皮膚 | 白血球破砕性血管炎 | ||
| 循環器 | 動悸 | 高血圧 | |
| その他 | CK増加、血中カリウム増加、倦怠感、発熱、尿糖陽性 | 浮腫、総蛋白減少、咳嗽、異常感、筋力低下、CK減少、口腔咽頭痛 | 胸部不快感 |
13. 過量投与
13.1 処置
活性代謝物であるペンシクロビル(血漿中では大部分がペンシクロビルとして存在する)は透析可能であり、4時間の血液透析により血漿中濃度は約75%減少する。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.2 薬剤服用時の注意
本剤は主薬の苦味を防ぐため、コーティングを施しているので、錠剤をつぶすことなく服用させること。
15. その他の注意
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人にファムシクロビル250、500、1000mgを単回経口投与したとき、ファムシクロビルは速やかに代謝され、血漿中には活性代謝物であるペンシクロビルが検出された。血漿中ペンシクロビルの薬物速度論的パラメータは下記の通りであった。ペンシクロビルのCmax及びAUCは投与量の増加に伴って、用量相関的に増加した。11)
| 投与量 | Cmax(μg/mL) | tmax(hr) | AUC0-∞(μg・hr/mL) | t1/2(hr) |
| 250mg | 1.45±0.36 | 0.91±0.55 | 3.84±1.32 | 1.84±0.57 |
| 500mg | 3.21±0.62 | 0.78±0.31 | 8.61±1.32 | 1.97±0.32 |
| 1000mg | 5.76±1.52 | 1.00±0.42 | 16.50±2.33 | 2.03±0.37 |
16.1.2 反復投与
健康成人にファムシクロビル750mg注3)を1日3回5日間反復経口投与したとき、反復による蓄積性は認められず、薬物動態に変化は認められなかった。11)
注3)本剤の承認された用法・用量は、「通常、成人にはファムシクロビルとして1回250mg(単純疱疹)又は500mg(帯状疱疹)を1日3回経口投与する。」である。
16.1.3 生物学的同等性試験
ファムシクロビル錠250mg「日本臓器」
ファムシクロビル錠250mg「日本臓器」とファムビル錠250mgを、クロスオーバー法によりそれぞれ1錠(ファムシクロビルとして250mg)を健康成人男性に絶食単回投与して血漿中ペンシクロビル濃度を測定し、得られた薬物動態パラメーター(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された12)。
| \ | AUCt(μg・hr/mL) | Cmax(μg/mL) | tmax(hr) | t1/2注4)(hr) |
| ファムシクロビル錠250mg「日本臓器」 | 4.53±0.85 | 2.19±0.61 | 0.85±0.39 | 2.12±0.30 |
| ファムビル錠250mg | 4.47±0.89 | 2.21±0.69 | 0.90±0.71 | 2.26±0.50 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 生物学的利用率
健康成人にファムシクロビル500mgを経口投与及びペンシクロビル400mgを静脈内投与して算出した絶対的生物学的利用率は77±8%であった(外国人データ)。13)
16.2.2 食事の影響
食事により血漿中ペンシクロビルのtmaxは僅かに遅延し、Cmax及びAUCは僅かに減少したが、臨床上特に問題となる変化ではなかった。14)
16.2.3 吸収部位
ラットに14C-ファムシクロビルを投与した検討より、ファムシクロビルの吸収部位は小腸上部であり、胃からの吸収は少ないことが示唆されている。15)
16.3 分布
16.3.1 分布容積
健康成人にペンシクロビル400mgを1時間静脈内投与したときの分布容積は、85.3±13.7Lであった(外国人データ)。13)
16.3.2 血漿蛋白結合率
ペンシクロビル
6.4〜16.0%(in vitro)16)
16.3.3 血球移行性(血液/血漿比)
ペンシクロビル
1.07〜1.17(in vitro)17)
16.3.4 乳汁及び胎児移行
16.4 代謝
16.5 排泄
健康成人にファムシクロビル250〜1000mg注3)を単回経口投与したとき、ペンシクロビルの主な排泄経路は尿中であり、24時間以内の尿中にペンシクロビル及び6-デオキシペンシクロビルがそれぞれ投与量の53.35〜60.92%及び5.06〜6.40%排泄され、ファムシクロビルは検出されなかった。11)
16.6 特定の背景を有する患者
16.6.1 腎機能障害者
腎機能障害者にファムシクロビル500mgを単回経口投与したとき、腎機能の低下に伴い、ペンシクロビルのCmax及びAUCの増加、t1/2の延長及び尿中排泄率の減少が観察された。クレアチニンクリアランス値の低下に従いペンシクロビルの腎クリアランスは直線的な低下を示し、ペンシクロビルの消失は腎機能低下の程度により影響を受けることが確認された(外国人データ)。[7.1、7.2、9.2、9.8参照]1)
| \ | CLcr注6)(mL/min) | Cmax(μg/mL) | tmax(hr) | t1/2(hr) | |
| 健康成人(n=9) | 92±9 | 2.83±0.28 | 0.89±0.10 | 2.15±0.17 | |
| 腎機能障害者(n=6) | 軽度注5) | 70±6 | 3.26±0.31 | 0.79±0.08 | 2.47±0.21 |
| 中等度注5) | 43±6 | 4.45±0.64 | 1.38±0.29 | 3.87±0.50 | |
| 高度注5) | 18±6 | 5.31±0.41 | 1.13±0.22 | 9.85±3.12 | |
| \ | AUC0-∞(μg・hr/mL) | CLr(L/hr) | 尿中排泄率(0〜24時間、投与量に対する%) | |
| 健康成人(n=9) | 8.20±1.02 | 31.9±4.2 | 58.4±3.5 | |
| 腎機能障害者(n=6) | 軽度注5) | 8.76±0.82 | 27.3±2.7 | 58.0±3.3 |
| 中等度注5) | 26.08±7.62 | 10.8±2.2注7) | 54.1±5.1注7) | |
| 高度注5) | 71.03±25.96 | 3.2±0.7 | 37.2±4.2 | |
平均値±標準誤差
注5)軽度:60≦CLcr≦80mL/min、中等度:30≦CLcr≦59mL/min、高度:5≦CLcr≦29mL/min
注6)平均値±標準偏差
注7)n=5
16.6.2 肝機能障害者
代償性の慢性肝疾患患者にファムシクロビル500mgを単回経口投与したとき、健康成人に比べて、ペンシクロビルのCmaxの低下、tmaxの延長がみられたものの、t1/2及びAUCには差を認めなかった。この結果から、肝障害のある患者における用量調節は必要ないと考えられた(外国人データ)。20)
16.6.3 高齢者
16.7 薬物相互作用
16.8 その他
16.8.1 ファムシクロビル錠500mg「日本臓器」の溶出挙動
ファムシクロビル錠500mg「日本臓器」は、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン」に基づき、ファムビル錠250mgと生物学的同等性が確認された含量違いのファムシクロビル錠250mg「日本臓器」と溶出挙動の比較により、生物学的に同等とみなされた。12)
17. 臨床成績
17.1 有効性及び安全性に関する試験
<単純疱疹>
17.1.1 国内第III相試験
国内で実施されたバラシクロビル塩酸塩対照二重盲検比較試験(計71施設、555例)において、「全ての単純疱疹の病変部位が治癒するまでの日数」で、ファムシクロビル錠(1回250mg1日3回投与)のバラシクロビル塩酸塩(1回500mg1日2回投与)に対する非劣性が検証された(ハザード比0.918、信頼区間0.774〜1.088)。
また、Kaplan-Meier曲線の比較では、ファムシクロビル錠とバラシクロビル塩酸塩の「全ての単純疱疹の病変部位の治癒率」の推移は概して相似しており、「全ての単純疱疹の病変部位が治癒するまでの日数」の50%点はいずれも6日であった。
ファムシクロビル錠群の副作用発現頻度は8.9%(25/281例)であった。主な副作用は、傾眠2.1%(6/281例)、口渇1.1%(3/281例)であった。28)
また、Kaplan-Meier曲線の比較では、ファムシクロビル錠とバラシクロビル塩酸塩の「全ての単純疱疹の病変部位の治癒率」の推移は概して相似しており、「全ての単純疱疹の病変部位が治癒するまでの日数」の50%点はいずれも6日であった。
ファムシクロビル錠群の副作用発現頻度は8.9%(25/281例)であった。主な副作用は、傾眠2.1%(6/281例)、口渇1.1%(3/281例)であった。28)
<帯状疱疹>
17.1.2 国内第III相試験
国内で実施されたアシクロビル対照二重盲検比較試験(計50施設、471例)において、病変部位が完全痂皮化するまでの日数で、ファムシクロビル錠(1回500mg1日3回投与)のアシクロビル(1回800mg1日5回投与)に対する非劣性が検証された(ハザード比1.080、信頼区間0.888〜1.312)。また、Kaplan-Meier曲線の比較では、ファムシクロビル錠とアシクロビルの完全痂皮化率の推移は概して相似しており、完全痂皮化までの日数の50%点はいずれも7日であった。
ファムシクロビル錠群の副作用発現頻度は10.7%(25/233例)であった。主な副作用は、ALT増加2.6%(6/233例)、頭痛1.7%(4/233例)、AST増加1.3%(3/233例)であった。29)
ファムシクロビル錠群の副作用発現頻度は10.7%(25/233例)であった。主な副作用は、ALT増加2.6%(6/233例)、頭痛1.7%(4/233例)、AST増加1.3%(3/233例)であった。29)
18. 薬効薬理
18.1 作用機序
ファムシクロビルは服用後速やかに代謝を受け活性代謝物ペンシクロビルに変換される。
ペンシクロビルはヘルペス群ウイルス感染細胞内において、ウイルス由来のチミジンキナーゼにより一リン酸化され、更に宿主細胞由来キナーゼにより三リン酸化体(PCV-TP)となる。感染細胞内において、PCV-TPはウイルスDNAポリメラーゼの基質の1つであるデオキシグアノシン三リン酸化体(dGTP)と競合的に拮抗することにより、ウイルスDNAポリメラーゼ阻害作用を示す。また、ウイルスDNAポリメラーゼの基質としてウイルスDNAに取り込まれることにより、ウイルスDNA鎖伸長阻害作用を示す。以上の作用によりウイルスの増殖を抑制すると考えられる。ペンシクロビルリン酸化の第一段階である一リン酸化は感染細胞内に存在するウイルス由来チミジンキナーゼによるため、ウイルス非感染細胞に対する影響は少ないものと考えられる。
また、単純ヘルペスウイルス1型及び2型感染細胞内におけるPCV-TPの半減期はそれぞれ10時間及び20時間、水痘・帯状疱疹ウイルス感染細胞内におけるPCV-TPの半減期は9.1時間であった。30)31)32)
ペンシクロビルはヘルペス群ウイルス感染細胞内において、ウイルス由来のチミジンキナーゼにより一リン酸化され、更に宿主細胞由来キナーゼにより三リン酸化体(PCV-TP)となる。感染細胞内において、PCV-TPはウイルスDNAポリメラーゼの基質の1つであるデオキシグアノシン三リン酸化体(dGTP)と競合的に拮抗することにより、ウイルスDNAポリメラーゼ阻害作用を示す。また、ウイルスDNAポリメラーゼの基質としてウイルスDNAに取り込まれることにより、ウイルスDNA鎖伸長阻害作用を示す。以上の作用によりウイルスの増殖を抑制すると考えられる。ペンシクロビルリン酸化の第一段階である一リン酸化は感染細胞内に存在するウイルス由来チミジンキナーゼによるため、ウイルス非感染細胞に対する影響は少ないものと考えられる。
また、単純ヘルペスウイルス1型及び2型感染細胞内におけるPCV-TPの半減期はそれぞれ10時間及び20時間、水痘・帯状疱疹ウイルス感染細胞内におけるPCV-TPの半減期は9.1時間であった。30)31)32)
18.2 抗ウイルス作用
19. 有効成分に関する理化学的知見
19.1. ファムシクロビル
20. 取扱い上の注意
20.1 アルミピロー開封後、光を避けて保存すること。本剤は光により変色することがある。変色したものは使用しないこと。
20.2 アルミピロー開封後、湿気を避けて保存すること。
22. 包装
ファムシクロビル錠250mg「日本臓器」
PTP包装
42錠(6錠×7)
ファムシクロビル錠500mg「日本臓器」
PTP包装
42錠(6錠×7)
23. 主要文献
- Boike, S. C., et al., Clin.Pharmacol.Ther., 55 (4), 418-426, (1994) »PubMed
- ファムシクロビルの生殖毒性試験(ファムビル錠250mg:2008年4月16日承認、申請資料概要二 3.2)
- ファムシクロビルのイヌ反復経口投与試験(ファムビル錠250mg:2008年4月16日承認、申請資料概要二 2.6)
- ファムシクロビルの再発性器ヘルペス感染患者での試験(ファムビル錠250mg:2008年4月16日承認、申請資料概要二 10.1)
- ファムシクロビルのラットがん原性試験(ファムビル錠250mg:2008年4月16日承認、申請資料概要二 7.2)
- ファムシクロビルのマウスがん原性試験(ファムビル錠250mg:2008年4月16日承認、申請資料概要二 7.1)
- ペンシクロビルの突然変異試験(ファムビル錠250mg:2008年4月16日承認、申請資料概要二 6.2)
- ペンシクロビルの染色体異常試験(ファムビル錠250mg:2008年4月16日承認、申請資料概要二 6.2)
- ペンシクロビルの小核試験(ファムビル錠250mg:2008年4月16日承認、申請資料概要二 6.2)
- ペンシクロビルの小核閾値試験(ファムビル錠250mg:2008年4月16日承認、申請資料概要二 6.2)
- 工藤忍ほか, 薬物動態, 11 (6), 547-555, (1996) »DOI
- 社内資料:ファムシクロビル錠250mg「日本臓器」及び500mg「日本臓器」の生物学的同等性試験に関する資料
- ファムシクロビルの健康成人における生物学的利用率(ファムビル錠250mg:2008年4月16日承認、申請資料概要へ 3.1)
- 工藤忍ほか, 薬理と治療, 24 (7), 117-127, (1996)
- Filer, C. W., et al., 薬理と治療, 24 (8), 159-183, (1996)
- ペンシクロビルの血漿タンパク結合(ファムビル錠250mg:2008年4月16日承認、申請資料概要へ 2.2)
- ペンシクロビルの血球移行性(ファムビル錠250mg:2008年4月16日承認、申請資料概要へ 2.2)
- Clarke, S., et al., Drug Metab.Dispos., 23 (2), 251-254, (1995) »PubMed
- Harrell, A. W., et al., Drug Metab.Dispos., 21 (1), 18-23, (1993) »PubMed
- Boike, S. C., et al., J. Clin. Pharmacol., 34, 1199-1207, (1994) »PubMed
- ファムシクロビルの高齢者における薬物動態(ファムビル錠250mg:2008年4月16日承認、申請資料概要へ 3.2)
- シメチジン併用時におけるファムシクロビルの薬物動態(ファムビル錠250mg:2008年4月16日承認、申請資料概要へ 3.5)
- アロプリノール併用時におけるファムシクロビルの薬物動態(ファムビル錠250mg:2008年4月16日承認、申請資料概要へ 3.5)
- テオフィリン併用時におけるファムシクロビルの薬物動態(ファムビル錠250mg:2008年4月16日承認、申請資料概要へ 3.5)
- ジゴキシンの薬物動態に対するファムシクロビル併用投与の影響(ファムビル錠250mg:2008年4月16日承認、申請資料概要へ 3.5)
- 定常状態におけるジゴキシンの薬物動態に対するファムシクロビル併用投与の影響(ファムビル錠250mg:2008年4月16日承認、申請資料概要へ 3.5)
- プロメタジン併用投与におけるファムシクロビルの薬物動態(ファムビル錠250mg:2008年4月16日承認、申請資料概要へ 3.5)
- 川島眞ほか, 臨床医薬, 29 (3), 285-307, (2013)
- 本田まりこほか, 臨床医薬, 24 (9), 825-848, (2008)
- Vere Hodge, R. A., et al., Antimicrob.Agents Chemother., 33 (2), 223-229, (1989)
- Earnshaw, D. L., et al., Antimicrob.Agents Chemother., 36 (12), 2747-2757, (1992) »PubMed
- Bacon, T. H., et al., Antivir.Chem.Chemother., 7 (2), 71-78, (1996)
- Boyd, M. R., et al., Antimicrob.Agents Chemother., 31 (8), 1238-1242, (1987) »PubMed
- 英国臨床分離株に対するペンシクロビルの抗ウイルス作用(ファムビル錠250mg:2008年4月16日承認、申請資料概要ホ 1.1)
- 英国及び米国臨床分離株に対するペンシクロビルの抗ウイルス作用(ファムビル錠250mg:2008年4月16日承認、申請資料概要ホ 1.1)
- 英国、米国及びベルギー臨床分離株に対するペンシクロビルの抗ウイルス作用(ファムビル錠250mg:2008年4月16日承認、申請資料概要ホ 1.1)
- 本邦臨床分離株に対するペンシクロビルの抗ウイルス作用(ファムビル錠250mg:2008年4月16日承認、申請資料概要ホ 1.1)
- Boyd, M. R., et al., Antivir.Chem.Chemother., 4 (S1), 3-11, (1993)
24. 文献請求先及び問い合わせ先
文献請求先
日本臓器製薬株式会社
くすりの相談窓口 受付時間 9:00〜17:00 土・日・祝日を除く
〒541-0046
大阪市中央区平野町4丁目2番3号
電話:フリーダイヤル 0120-630-093
06-6233-6085
06-6233-6085
FAX:06-6233-6087
製品情報問い合わせ先
日本臓器製薬株式会社
くすりの相談窓口 受付時間 9:00〜17:00 土・日・祝日を除く
〒541-0046
大阪市中央区平野町4丁目2番3号
電話:フリーダイヤル 0120-630-093
06-6233-6085
06-6233-6085
FAX:06-6233-6087
26. 製造販売業者等
26.1 製造販売元
小財家興産株式会社
大阪市中央区平野町4丁目2番3号
26.2 販売元
日本臓器製薬株式会社
大阪市中央区平野町4丁目2番3号