医薬品情報
| 総称名 | スピラマイシン |
|---|---|
| 一般名 | スピラマイシン |
| 欧文一般名 | Spiramycin |
| 製剤名 | スピラマイシン製剤 |
| 薬効分類名 | 抗トキソプラズマ原虫剤 |
| 薬効分類番号 | 6419 |
| ATCコード | J01FA02 |
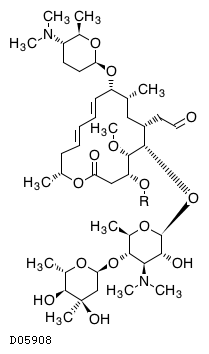
| KEGG DRUG |
D05908
スピラマイシン
|
| KEGG DGROUP |
DG00602
スピラマイシン
DG01551
マクロライド系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年6月 改訂(第2版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| スピラマイシン錠150万単位「サノフィ」 | Spiramycin Tablets | サノフィ | 6419006F1024 | 228.8円/錠 | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
先天性トキソプラズマ症の発症抑制
5. 効能または効果に関連する注意
5.1 最新の国内診療ガイドライン等を参考に、本剤の投与の適否を検討すること。
5.2 トキソプラズマ抗体検査、問診等により妊娠成立後のトキソプラズマ初感染が疑われる妊婦に対して使用すること。
5.3 本剤は母体から胎児への感染の抑制を目的として使用する薬剤であるため、投与開始前に、胎児へのトキソプラズマ感染が疑われる場合には、本剤の投与の適否について慎重に検討すること。
6. 用法及び用量
通常、妊婦には1回2錠(スピラマイシンとして300万国際単位)を1日3回経口投与する。
7. 用法及び用量に関連する注意
7.1 妊娠成立後のトキソプラズマ初感染が疑われる場合、速やかに投与を開始し、胎児感染が確認されない場合には、分娩まで投与を継続すること。
7.2 本剤投与中に、胎児へのトキソプラズマ感染が疑われる場合には、本剤の投与継続の適否について検討する等、適切に対応すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 QT延長を起こすおそれのある患者(電解質異常のある患者、先天性QT延長症候群の患者、心疾患のある患者)
QT延長を起こすおそれがある。[11.1.4参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト母乳中に移行することが報告されている1)。
10. 相互作用
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(頻度不明)
蕁麻疹、血管浮腫、血圧低下、呼吸困難等があらわれることがある。
11.1.2 偽膜性大腸炎(頻度不明)
腹痛、頻回の下痢等が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.3 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、急性汎発性発疹性膿疱症(いずれも頻度不明)
11.1.5 肝機能障害(頻度不明)
胆汁うっ滞性肝炎、混合型肝炎等の肝機能障害があらわれることがある。
11.2 その他の副作用
| 頻度不明 | |
| 過敏症 | IgA血管炎 |
| 血液 | 急性溶血、白血球減少症、好中球減少症 |
| 皮膚 | 発疹、蕁麻疹、そう痒症 |
| 精神神経系 | 錯感覚、味覚異常 |
| 消化器 | 腹痛、悪心、嘔吐、下痢 |
| 肝臓 | 肝機能検査異常 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することが報告されている。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人健康成人女性被験者10例を対象にスピラマイシン300万国際単位を単回経口投与したときのスピラマイシンI及びネオスピラマイシンIの血漿中薬物動態パラメータ及び平均血漿中濃度プロファイルを以下に示す2)。
| 測定対象 | 例数 | Cmax(ng/mL) | tmax注1)(hr) | AUClast(ng・hr/mL) | t1/2z(hr) |
| スピラマイシンI | 10 | 2640±946 | 3.0[2.0-5.0] | 17000±5170 | 9.23±1.80 |
| ネオスピラマイシンI | 10 | 289±304 | 4.5[3.0-6.0] | 1250±1360 | − |
単回投与時の血漿中スピラマイシンI濃度推移
16.1.2 反復投与
外国人健康若年男性被験者10例を対象に、スピラマイシン150万国際単位を8時間ごとに、1時間かけて6日間静脈内投与(初日及び6日目は1日1回、2〜5日目は1日3回投与)注2)したとき、血清中スピラマイシン濃度は反復投与開始約2日目に定常状態に達し、投与初日及び6日目のCmaxは、それぞれ2.14±0.32及び3.10±0.70μg/mLであり、投与初日のAUCinf及び投与6日目のAUC0-8は、それぞれ6.19±1.19及び7.33±1.51μg・h/mLであった3)。
16.2 吸収
16.2.1 バイオアベイラビリティ
外国人健康男性被験者にスピラマイシン300万国際単位を経口投与したとき、絶対バイオアベイラビリティは33%であった4)。
16.2.2 食事の影響
食事と同時に摂取しても、スピラマイシンの吸収には有意な影響はなかった5)。
16.3 分布
16.4 代謝
スピラマイシンを経口投与したとき、一部は胃内で加水分解を受けてネオスピラマイシンに変換されると考えられる。
16.5 排泄
16.7 薬物相互作用
18. 薬効薬理
18.1 作用機序
18.2 トキソプラズマに対する抗原虫作用
19. 有効成分に関する理化学的知見
19.1. スピラマイシン
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
96錠[8錠(PTP)×12]
23. 主要文献
- Briggs G G,et al., Drugs in Pregnancy and Lactation 9th Ed.A Reference Guide to Fetal and Neonatal Risk., 1347-8, (2011), (Wolters Kluwer Health.)
- 渋谷弓枝 他, Ther Res., 38 (3), 301-10, (2017)
- 社内資料:海外第I相臨床試験(No.694)(2018年7月2日承認、CTD2.7.2.2)
- 社内資料:海外第I相臨床試験(No.756)(2018年7月2日承認、CTD2.7.1.2)
- C Kamme,et al., Scand J Infect Dis., 10 (2), 135-42, (1978)
- P Periti,et al., Clin Pharmacokinet., 16 (4), 193-214, (1989), (Apr)
- Seyffart G., Drug Dosage in Renal Insufficiency., 537, (1992), (Springer-Science+Buisiness media BV)
- J P Garin,et al., Presse Med., 76 (48), 2266, (1968), (Dec 7)
- J A Macfarlane,et al., Lancet., 1 (7532), 1-4, (1968), (Jan 6)
- Lamy P,et al., Ann Med Nancy., 16, 109-12, (1977)
- L Gaillard,et al., Lyon Med., 225 (5), 419-24, (1971), (Mar 14) »PubMed
- S Kernbaum,et al., Sem Hop., 58 (5), 289-97, (1982), (Feb 4) »PubMed
- H H Allen,et al., J Antimicrob Chemother., 22 (Suppl B), 111-6, (1988), (Jul)
- R Harf,et al., J Antimicrob Chemother., 22 (Suppl B), 135-40, (1988), (Jul)
- F Forestier,et al., Arch Fr Pediatr., 44 (7), 539-44, (1987), (Aug-Sep)
- R Gratzl,et al., Eur J Clin Microbiol Infect Dis., 21 (1), 12-6, (2002), (Jan)
- 社内資料:排泄(外国人健康男性被験者)(2018年7月2日承認、CTD2.7.2.3)
- M LEVRAT,et al., Rev Int Hepatol., 14, 137-69, (1964)
- K Shimizu,et al., J.J Antibiot B., 19 (6), 423-7, (1966), (Dec)
- N Brion,et al., Clin Neuropharmacol., 15 (3), 229-35, (1992), (Jun)
- C J Beckers,et al., J Clin Invest., 95 (1), 367-76, (1995), (Jan)
- M E Fichera,et al., Nature., 390 (6658), 407-9, (1997), (Nov 27)
- Younjoo Lee,et al., J Med Chem., 54 (8), 2792-804, (2011), (Apr 28) »PubMed
- B T Nguyen,et al., Br J Pharmacol., 85 (3), 713-6, (1985), (Jul)
- I N Costa,et al., Placenta., 30 (10), 884-90, (2009), (Oct)
24. 文献請求先及び問い合わせ先
文献請求先
サノフィ株式会社
コールセンター くすり相談室
〒163-1488
東京都新宿区西新宿三丁目20番2号
電話:フリーダイヤル 0120-109-905
製品情報問い合わせ先
サノフィ株式会社
コールセンター くすり相談室
〒163-1488
東京都新宿区西新宿三丁目20番2号
電話:フリーダイヤル 0120-109-905
26. 製造販売業者等
26.1 製造販売元
サノフィ株式会社
〒163-1488
東京都新宿区西新宿三丁目20番2号