医薬品情報
| 総称名 | アミティーザ |
|---|---|
| 一般名 | ルビプロストン |
| 欧文一般名 | Lubiprostone |
| 製剤名 | ルビプロストンカプセル |
| 薬効分類名 | クロライドチャネルアクチベーター |
| 薬効分類番号 | 2359 |
| ATCコード | A06AX03 |
| KEGG DRUG |
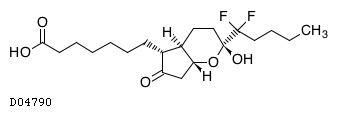
D04790
ルビプロストン
|
| KEGG DGROUP |
DG01770
便秘薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第4版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アミティーザカプセル12μg | Amitiza Capsules | ヴィアトリス製薬 | 2359006M2021 | 48.2円/カプセル | 処方箋医薬品注) |
| アミティーザカプセル24μg | Amitiza Capsules | ヴィアトリス製薬 | 2359006M1025 | 96.9円/カプセル | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
慢性便秘症(器質的疾患による便秘を除く)
5. 効能または効果に関連する注意
症候性の慢性便秘症患者を対象に本剤の有効性及び安全性を評価する臨床試験は実施していない。
6. 用法及び用量
通常、成人にはルビプロストンとして1回24μgを1日2回、朝食後及び夕食後に経口投与する。なお、症状により適宜減量する。
7. 用法及び用量に関連する注意
8. 重要な基本的注意
8.1 本剤による治療により継続的な症状の改善が得られた場合、又は副作用が認められた場合には、症状に応じて減量、休薬又は中止を考慮し、本剤を漫然と継続投与することのないよう注意すること。
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.3 肝機能障害患者
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。[3H]で標識した本剤を用いた動物実験(ラット)で、放射能の乳汁中への移行が報告されている1)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 血液及びリンパ系障害 | 貧血 | |||
| 免疫系障害 | 気道過敏症 | |||
| 代謝及び栄養障害 | 食欲減退 | |||
| 神経系障害 | 頭痛 | 浮動性めまい、体位性めまい、感覚鈍麻、傾眠、失神 | ||
| 耳及び迷路障害 | 回転性めまい | |||
| 心臓障害 | 動悸 | 頻脈 | ||
| 血管障害 | ほてり | 低血圧 | ||
| 呼吸器、胸郭及び縦隔障害 | 呼吸困難 | 咳嗽 | ||
| 胃腸障害 | 下痢(30%)、悪心(23%)、腹痛(6%) | 腹部不快感、腹部膨満、嘔吐 | 消化不良、排便回数増加、出血性胃炎、痔核、逆流性食道炎、心窩部不快感、痔出血 | |
| 皮膚及び皮下組織障害 | 湿疹、紅斑 | 発疹 | ||
| 筋骨格系及び結合組織障害 | 背部痛、筋骨格硬直、四肢不快感 | |||
| 全身障害及び局所様態 | 胸部不快感(5%) | 胸痛、不快感、異常感(気分不良)、倦怠感、浮腫、口渇 | ||
| 臨床検査 | 血中ビリルビン増加、血中クレアチンホスホキナーゼ増加、血中ブドウ糖増加、血中トリグリセリド増加、血中尿素増加、血中γ-グルタミルトランスフェラーゼ増加、尿中ブドウ糖陽性、ヘモグロビン減少、体重増加、白血球数増加、血中リン増加 | 血圧低下 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 ラットに本剤20、100及び400μg/kg/日投与(体表面積換算で臨床用量の4、20及び81倍)を2年間投与したがん原性試験において、400μg/kg/日を投与した雄ラットで精巣の間質細胞腺腫の発生率が有意に増加した。雌ラットでは肝細胞腺腫の用量依存的な発生頻度増加がみられたとの報告がある。
15.2.2 ラットの受胎能及び着床までの初期胚発生に関する試験において、対照群に対し、本剤1000μg/kg/日投与(体表面積換算で臨床用量の約166倍)で着床数及び生存胎児数の有意な減少がみられたとの報告がある。
16. 薬物動態
16.1 血中濃度
健康成人に本剤24、48、72μgを単回経口投与したとき、血漿中の未変化体濃度はいずれも定量下限(10pg/mL)未満であった。また、活性代謝物である15-ヒドロキシ体のCmax及びAUCは以下の表のとおりであった2)。
| 投与群 | 例数 | Cmax(pg/mL) | AUCt(pg・h/mL) |
| 24μg群 | 5 | 21.2±9.6 | 10.9±9.4 |
| 48μg群 | 8 | 38.6±19.4 | 35.6±17.4 |
| 72μg群 | 8 | 53.1±30.2 | 66.0±58.1 |
16.2 吸収
16.2.1 食事の影響
本剤の体内動態に及ぼす食事の影響について72μgの[3H]で標識した本剤を用いて健康成人で検討した。その結果、摂食時及び空腹時ともに血漿中に未変化体はほとんど認められなかった。[3H]で標識した本剤を高脂肪食とともに投与したときの放射能のCmaxは、空腹時投与と比較して55%低下したが、AUC∞には変化が見られなかった3)(外国人データ)。
16.3 分布
[3H]で標識した本剤をラットに経口投与したとき、消化管、肝、腎組織等へ分布し、投与後48時間ではいずれの組織においても低濃度であった4)。
16.4 代謝
ヒト及び動物(マウス、ラット、ウサギ、イヌ及びサル)の試験結果から、本剤は15位の還元、α鎖のβ酸化、ω鎖のω酸化によって速やか、かつ広範に代謝を受けることが示された。本剤と同様に薬理作用を有する代謝物(15-ヒドロキシ体)への代謝はカルボニル還元酵素が関与している可能性が示唆され、また、動物実験から、血液中に未変化体は検出されず、検出されるほとんどが非活性の代謝物であることが示された。マスバランス試験(外国人データ)の結果から、ヒトでは主にM3(15-ヒドロキシ体)及びM14(19-カルボキシ-15-ヒドロキシ-2,3,4,5,20-ペンタノル体)が代謝物として認められた。なお、ヒト肝ミクロソームを用いたin vitro試験の結果から、CYP2A6を阻害する可能性が示された5)6)。
16.5 排泄
健康成人に72μgの[3H]で標識した本剤を単回経口投与したとき、総投与放射能の60.7%が投与後24時間後までに尿中に排泄され、投与後168時間までに62.9%が尿中に、31.9%が便中に排泄され、合わせて94.8%が回収された7)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
16.6.2 肝機能障害患者
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(プラセボ対照二重盲検比較試験)
自発排便回数が平均3回/週未満の状態が6ヵ月以上持続している慢性的な便秘症状を有する患者を対象に、プラセボ又は本剤24μgを1日2回4週間経口投与したとき、主要評価項目である「投与第1週における自発排便回数の観察期からの変化量」は以下の表のとおりであり、プラセボ群に対する本剤群の優越性が検証された。また、初回投与開始24時間以内に自発排便があった患者は、プラセボ群30.6%(19/62例)及び本剤群58.1%(36/62例)であり、初回排便までの時間の中央値はプラセボ群約28.8時間及び本剤群約13.1時間であった。
| 投与群 | 観察期 | 投与第1週 | 変化量 | 変化量の群間差[95%信頼区間] | P値 |
| プラセボ群(n=62) | 1.68±0.77 | 2.93±1.82 | 1.26±1.82 | − | P<0.001 |
| 本剤群(n=60) | 1.65±0.78 | 5.37±2.78 | 3.66±2.78 | 2.40[1.55,3.25] |
本剤群の副作用発現頻度は41.9%(26例中62例)であった。主な副作用は、悪心、下痢各14.5%(9/62例)、腹痛、腹部不快感、胸部不快感各3.2%(2/62例)等であった10)。
17.1.2 国内第III相試験(長期投与試験)
自発排便回数が平均3回/週未満の状態が6ヵ月以上持続している慢性的な便秘症状を有する患者209例を対象に本剤24μgを1日2回48週間経口投与したとき、7日あたりの自発排便回数の推移(平均値)は以下の図のとおりであった。なお、本試験では有害事象により45.0%(94/209例)が減量し、16.3%(34/209例)が休薬した。
図 自発排便回数の推移(平均値)
副作用発現頻度は73.2%(209例中153例)であった。主な副作用は、下痢37.3%(78/209例)、悪心27.3%(57/209例)、胸部不快感7.2%(15/209例)、腹痛5.3%(11/209例)、嘔吐4.8%(10/209例)、腹部不快感4.3%(9/209例)、頭痛、腹部膨満各3.3%(7/209例)等であった11)。
17.1.3 海外第III相試験(プラセボ対照二重盲検比較試験)
非がん性疼痛にオピオイドを使用中で、自発排便回数が平均3回/週未満であり、自発排便の25%以上で硬い/非常に硬い便、残便感、自発排便時のいきみが中等度から極めて重度の一つ以上が該当する患者を対象に、プラセボ又は本剤24μgを1日2回12週間経口投与したとき、主要評価項目である「1週間あたりの自然排便回数1回以上増加、かつ9週間以上で1週間あたり3回以上の自然排便がある被験者」は本剤群27.1%(58/214例)、プラセボ群18.9%(41/217例)であり、プラセボ群に対する本剤群の優越性が検証された。
本剤群の副作用発現頻度は28.3%(219例中62例)であった。主な副作用は、下痢9.6%(21/219例)、悪心8.2%(18/219例)、腹痛5.5%(12/219例)等であった12)。
本剤群の副作用発現頻度は28.3%(219例中62例)であった。主な副作用は、下痢9.6%(21/219例)、悪心8.2%(18/219例)、腹痛5.5%(12/219例)等であった12)。
17.3 その他
17.3.1 国内第III相試験(自発排便回数の変化量に基づく同等性の確認)
自発排便回数が平均3回/週未満の状態が6ヵ月以上持続している慢性便秘症の患者を対象に、12μg(試験製剤)群は1回12μgカプセルを2カプセルずつ、24μg(標準製剤)群は1回24μgカプセルを1カプセルずつ、1日2回朝夕食後に7日間投与した。主要評価項目である投与第1週における自発排便回数の観察期からの変化量は以下の表のとおりであり、95%信頼区間は事前に設定した同等性マージンの範囲内であった。
| 投与群 | 変化量 | 群間差[95%信頼区間] |
| 12μgi)群(n=60) | 3.0±3.87 | −0.4[−1.8,1.0] |
| 24μgii)群(n=65) | 3.5±3.51 |
副作用発現頻度は27.4%(135例中37例)であった。主な副作用は、悪心12.6%(17/135例)、下痢11.9%(16/135例)、腹部不快感2.2%(3/135例)等であった13)。
18. 薬効薬理
18.1 作用機序
ルビプロストンは、小腸上皮頂端膜(腸管内腔側)に存在するClC-2クロライドチャネルを活性化し、腸管内への水分分泌を促進して便を軟らかくすることにより、腸管内の輸送を高めて排便を促進する。また、その作用は腸管局所にて発現し、吸収された後速やかに代謝される。
18.2 クロライドイオンチャネルに対する作用
ClC-2クロライドイオンチャネルを発現するヒト腸管上皮由来T84細胞株の単層培養標本において、頂端膜側のCl−輸送を促進し、短絡電流を濃度依存的に増加させた14)。
18.3 小腸内輸送改善作用
モルヒネ誘発腸管内輸送能低下マウスモデルにおいて、1μg/kg以上の投与量で小腸におけるグラファイトマーカーの通過時間を短縮した15)。
18.4 腸液分泌促進作用
18.5 血清中電解質濃度に対する作用
ラットにて腸液分泌を十分に促進する投与量において、血清中のNa+、K+、Cl−濃度には影響が認められなかった18)。
19. 有効成分に関する理化学的知見
19.1. ルビプロストン
22. 包装
<アミティーザカプセル12μg>
100カプセル[10カプセル(PTP)×10]
500カプセル[10カプセル(PTP)×50]
<アミティーザカプセル24μg>
100カプセル[10カプセル(PTP)×10]
500カプセル[10カプセル(PTP)×50]
23. 主要文献
- 社内資料:ラットにおける乳汁排泄(承認年月日:2012.6.29、CTD 2.6.4.6)
- 社内資料:健康成人における血中濃度(第I相臨床試験 単回投与)(承認年月日:2012.6.29、CTD 2.7.6.3)
- 社内資料:健康成人における血中濃度(食事の影響)(承認年月日:2012.6.29、CTD 2.7.6.2)
- 社内資料:ラットにおける組織分布(承認年月日:2012.6.29、CTD 2.6.4.4)
- 社内資料:代謝(承認年月日:2012.6.29、CTD 2.6.4.5)
- 社内資料:マスバランス試験(承認年月日:2012.6.29、CTD 2.7.6.1)
- 社内資料:マスバランス試験(承認年月日:2012.6.29、CTD 2.7.2.2)
- 社内資料:薬物動態試験(腎機能障害患者)(承認年月日:2012.6.29、CTD 2.7.6.5)
- 社内資料:薬物動態試験(肝機能障害患者)(承認年月日:2012.6.29、CTD 2.7.6.6)
- 社内資料:第III相比較試験(承認年月日:2012.6.29、CTD 2.7.6.8)
- 社内資料:第III相長期投与試験(承認年月日:2012.6.29、CTD 2.7.6.14)
- 社内資料:オピオイド誘発性腸管機能不全患者を対象とした海外第III相比較試験(結果概要)
- 社内資料:アミティーザカプセル12μgに関する第III相比較試験
- Cuppoletti J,et al., Am J Physiol Cell Physiol., 287, C1173, (2004) »PubMed
- 社内資料:腸管内輸送への影響(承認年月日:2012.6.29、CTD 2.6.2.2)
- 社内資料:ラットでの腸液分泌に対する影響(承認年月日:2012.6.29、CTD 2.6.2.2)
- 社内資料:ラットの腸管内への水分泌に対する影響(承認年月日:2012.6.29、CTD 2.6.2.2)
- 社内資料:腸液中及び血清中の電解質への影響(承認年月日:2012.6.29、CTD 2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
製品情報問い合わせ先
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
26. 製造販売業者等
26.1 製造販売元
ヴィアトリス製薬合同会社
東京都港区麻布台一丁目3番1号