医薬品情報
| 総称名 | ゾテピン |
|---|---|
| 一般名 | ゾテピン |
| 欧文一般名 | Zotepine |
| 製剤名 | ゾテピン製剤 |
| 薬効分類名 | 統合失調症治療剤 |
| 薬効分類番号 | 1179 |
| ATCコード | N05AX11 |
| KEGG DRUG |
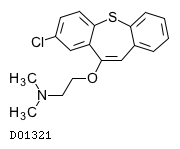
D01321
ゾテピン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年10月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ゾテピン細粒10%「タカタ」 | Zotepine Fine Granules"TAKATA" | 高田製薬 | 1179024C1106 | 42.8円/g | 劇薬, 処方箋医薬品 |
| ゾテピン細粒50%「タカタ」 | Zotepine Fine Granules"TAKATA" | 高田製薬 | 1179024C2080 | 204.5円/g | 劇薬, 処方箋医薬品 |
| ゾテピン錠25mg「タカタ」 (後発品) | Zotepine Tablets"TAKATA" | 高田製薬 | 1179024F1099 | 7.8円/錠 | 劇薬, 処方箋医薬品 |
| ゾテピン錠50mg「タカタ」 | Zotepine Tablets"TAKATA" | 高田製薬 | 1179024F2095 | 23.1円/錠 | 劇薬, 処方箋医薬品 |
| ゾテピン錠100mg「タカタ」 | Zotepine Tablets"TAKATA" | 高田製薬 | 1179024F3083 | 66.3円/錠 | 劇薬, 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
2.1 昏睡状態、循環虚脱状態の患者[これらの状態を悪化させるおそれがある。]
2.2 バルビツール酸誘導体、麻酔剤等の中枢神経抑制剤の強い影響下にある患者[中枢神経抑制剤の作用を延長し増強させる。]
2.3 アドレナリンを投与中の患者(アドレナリンをアナフィラキシーの救急治療、又は歯科領域における浸潤麻酔もしくは伝達麻酔に使用する場合を除く)[10.1参照]
2.4 本剤の成分、フェノチアジン系化合物及びその類似化合物に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
ゾテピンとして、通常成人1日75〜150mgを分割経口投与する。
なお、年齢、症状により適宜増減するが、1日450mgまで増量することができる。
なお、年齢、症状により適宜増減するが、1日450mgまで増量することができる。
8. 重要な基本的注意
8.1 眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないよう注意すること。
8.2 制吐作用を有するため、他の薬剤に基づく中毒、腸閉塞、脳腫瘍等による嘔吐症状を不顕性化することがあるので注意すること。[11.1.3参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 皮質下部の脳障害(脳炎、脳腫瘍、頭部外傷後遺症等)の疑いがある患者
治療上やむを得ないと判断される場合を除き、投与しない。高熱反応があらわれるおそれがあるので、このような場合には全身を氷で冷やすか、又は解熱剤を投与するなど適切な処置を行うこと。
9.1.2 血液障害のある患者
血液障害を悪化させるおそれがある。
9.1.3 褐色細胞腫又はパラガングリオーマ、動脈硬化症あるいは心疾患の疑いのある患者
類似化合物であるフェノチアジン系化合物では血圧の急速な変動がみられることがある。
9.1.4 重症喘息、肺気腫、呼吸器感染症等の患者
類似化合物であるフェノチアジン系化合物では呼吸抑制があらわれることがある。
9.1.5 てんかん等の痙攣性疾患又はこれらの既往歴のある患者及び過去にロボトミーや電撃療法をうけた患者
痙攣閾値を低下させることがある。
9.1.6 高温環境にある患者
高熱反応があらわれることがある。
9.1.7 脱水・栄養不良状態等を伴う身体的疲弊のある患者
悪性症候群(Syndrome malin)が起こりやすい。[11.1.1参照]
9.1.8 不動状態、長期臥床、肥満、脱水状態等の患者
肺塞栓症、静脈血栓症等の血栓塞栓症が報告されている。[11.1.6参照]
9.3 肝機能障害患者
肝機能障害を悪化させるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。動物実験で新生仔死亡率の増加が報告されている。また、妊娠後期に抗精神病薬が投与されている場合、新生児に哺乳障害、傾眠、呼吸障害、振戦、筋緊張低下、易刺激性等の離脱症状(新生児薬物離脱症候群)や錐体外路症状があらわれたとの報告がある。
9.6 授乳婦
投与中は授乳しないことが望ましい。母乳中へ移行することが報告されている。[16.3.1参照]
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら、慎重に投与すること。錐体外路症状等の副作用が起こりやすい。
10. 相互作用
10.1 併用禁忌
| アドレナリン (アナフィラキシーの救急治療、又は歯科領域における浸潤麻酔もしくは伝達麻酔に使用する場合を除く) (ボスミン) [2.3参照] | アドレナリンの作用を逆転させ、重篤な血圧低下を起こすおそれがある。 | アドレナリンはα、β受容体の刺激剤であり、本剤のα受容体遮断作用により、β受容体刺激作用が優位となり、血圧低下作用が増強される。 |
10.2 併用注意
| 中枢神経抑制剤 バルビツール酸誘導体 麻酔剤等 | 相互に中枢神経抑制作用を増強させることがある。 | 本剤及びこれらの薬剤は中枢神経抑制作用を有する。 |
| 降圧剤 | 相互に降圧作用を増強させることがある。 | 本剤及びこれらの薬剤は降圧作用を有する。 |
| 抗コリン作用を有する薬剤 抗コリン性抗パーキンソン剤 三環系抗うつ剤等 | 相互に抗コリン作用を増強させることがある。 | 本剤及びこれらの薬剤は抗コリン作用を有する。 |
| メトクロプラミド ドンペリドン | 内分泌機能異常、錐体外路症状が発現しやすくなる。 | 本剤及びこれらの薬剤は抗ドパミン作用を有するため、併用により抗ドパミン作用が強くあらわれる。 |
| ドパミン作動薬 レボドパ等 | 相互に作用を減弱させることがある。 | 本剤は抗ドパミン作用を有するため、作用が拮抗する。 |
| アルコール 飲酒 | 相互に中枢神経抑制作用を増強させることがある。 | ともに中枢神経抑制作用を有する。 |
| 有機燐殺虫剤 | 相互に作用し、有機燐殺虫剤の毒性を増強させるおそれがあるので、接触しないように注意すること。 | 有機燐殺虫剤の抗コリンエステラーゼ作用を増強し、その毒性を強めるおそれがある。 |
| アドレナリン含有歯科麻酔剤 リドカイン・アドレナリン | 重篤な血圧低下を起こすおそれがある。 | アドレナリンはα、β受容体の刺激剤であり、本剤のα受容体遮断作用により、β受容体刺激作用が優位となり、血圧低下作用が増強されるおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 悪性症候群(Syndrome malin)(0.1%未満)
無動緘黙、強度の筋強剛、嚥下困難、頻脈、血圧の変動、発汗等が発現し、それに引き続き発熱がみられる場合は、投与を中止し、体冷却、水分補給等の全身管理とともに適切な処置を行うこと。本症発症時には、白血球の増加や血清CKの上昇がみられることが多く、また、ミオグロビン尿を伴う腎機能の低下がみられることがある。
なお、高熱が持続し、意識障害、呼吸困難、循環虚脱、脱水症状、急性腎障害へと移行し、死亡した例が報告されている。[9.1.7参照]
なお、高熱が持続し、意識障害、呼吸困難、循環虚脱、脱水症状、急性腎障害へと移行し、死亡した例が報告されている。[9.1.7参照]
11.1.2 心電図異常(0.1〜5%未満)
11.1.3 麻痺性イレウス(0.1%未満)
腸管麻痺(食欲不振、悪心・嘔吐、著しい便秘、腹部の膨満あるいは弛緩及び腸内容物のうっ滞等)を来し、麻痺性イレウスに移行することがあるので、腸管麻痺があらわれた場合には投与を中止すること。なお、この悪心・嘔吐は、本剤の制吐作用により不顕性化することもあるので注意すること。[8.2参照]
11.1.4 痙攣発作(0.1〜5%未満)
11.1.5 無顆粒球症、白血球減少(各0.1%未満)
11.1.6 肺塞栓症、深部静脈血栓症(各0.1%未満)
肺塞栓症、静脈血栓症等の血栓塞栓症が報告されているので、観察を十分に行い、息切れ、胸痛、四肢の疼痛、浮腫等が認められた場合には、投与を中止するなど適切な処置を行うこと。[9.1.8参照]
11.1.7 遅発性ジスキネジア(頻度不明)
長期投与により、ときに口周部等に不随意運動があらわれ、投与中止後も持続することがある。
11.1.8 抗利尿ホルモン不適合分泌症候群(SIADH)(頻度不明)
低ナトリウム血症、低浸透圧血症、尿中ナトリウム排泄量の増加、高張尿、痙攣、意識障害等を伴う抗利尿ホルモン不適合分泌症候群(SIADH)があらわれることがあるので、このような場合には、投与を中止し、水分摂取の制限等適切な処置を行うこと。
発現頻度は、承認時までの臨床試験及び使用成績調査結果に基づいている。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 0.1%未満 | |
| 循環器 | 血圧降下、頻脈 | 不整脈、息苦しさ | |
| 消化器 | 便秘、悪心・嘔吐、食欲不振、腹部不快感 | 下痢、口内炎、食欲亢進、腹部膨満感 | |
| 肝臓 | 肝障害 | ||
| 錐体外路症状 | パーキンソン症候群(手指振戦、流涎、筋強剛、運動減少、歩行障害、膏顔、仮面様顔貌等) | ジスキネジア(構音障害、眼球回転発作、嚥下障害、姿勢異常等)、アカシジア(静坐不能) | |
| 精神神経系 | 眠気、脳波異常 | 不眠、不安・焦燥、不穏・興奮、易刺激、意識障害 | 性欲亢進 |
| 過敏症 | 発疹 | 皮膚そう痒感 | |
| 自律神経系 | 脱力・倦怠感、口渇、めまい、頭痛・頭重、鼻閉、排尿困難、しびれ感、失禁 | 発汗、頻尿 | |
| 内分泌 | 月経異常、乳汁分泌 | ||
| その他 | 血清尿酸低下 | 視覚障害、浮腫 | 発熱、味覚異常、体重増加、体重減少、瞳孔散大 |
13. 過量投与
13.1 症状
傾眠から昏睡までの中枢神経系の抑制、血圧低下、錐体外路症状があらわれる。その他、激越、情緒不安、痙攣、口渇、腸閉塞、心電図変化及び不整脈等があらわれる可能性がある。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本剤による治療中、原因不明の突然死が報告されている。
15.1.2 外国で実施された高齢認知症患者を対象とした17の臨床試験において、非定型抗精神病薬投与群はプラセボ投与群と比較して死亡率が1.6〜1.7倍高かったとの報告がある。また、外国での疫学調査において、定型抗精神病薬も非定型抗精神病薬と同様に死亡率の上昇に関与するとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 生物学的同等性試験
(1)ゾテピン細粒10%「タカタ」
ゾテピン細粒10%「タカタ」とロドピン細粒10%をクロスオーバー法により、健康成人男子15名にそれぞれ0.5g(ゾテピンとして50mg)を空腹時に単回経口投与し、投与前、投与後0.5、1、1.5、2、3、4、6、8、12、24及び36時間に前腕静脈から採血した。液体クロマトグラフィーにより測定したゾテピンの血漿中濃度の推移及びパラメータは次のとおりであり、AUC及びCmaxについて統計的評価を行った結果、両剤の生物学的同等性が確認された1)。
図16-1 血漿中濃度(細粒10%)
| 判定パラメータ | 参考パラメータ | |||
| AUCt(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | |
| ゾテピン細粒10%「タカタ」 | 153.71±21.47 | 17.20±5.16 | 1.9±0.2 | 15.3±2.3 |
| ロドピン細粒10% | 148.18±16.67 | 15.23±2.44 | 2.1±0.2 | 18.5±3.8 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
(2)ゾテピン細粒50%「タカタ」
ゾテピン細粒50%「タカタ」とロドピン細粒50%をクロスオーバー法により、健康成人男子20名にそれぞれ50mg(ゾテピンとして25mg)を空腹時に単回経口投与し、投与前、投与後0.5、1、1.5、2、2.5、3、4、6、8、12、24、48及び72時間に前腕静脈から採血した。LC/MSにより測定したゾテピンの血漿中濃度の推移及びパラメータは次のとおりであり、AUC及びCmaxについて統計的評価を行った結果、判定パラメータの対数値の平均値の差がlog0.90〜log1.11で、かつ、溶出試験で規定する全ての条件で溶出挙動が類似していることから、両剤の生物学的同等性が確認された2)。
図16-2 血漿中濃度(細粒50%)
| 判定パラメータ | 参考パラメータ | |||
| AUCt(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | |
| ゾテピン細粒50%「タカタ」 | 58.37±33.00 | 5.89±3.63 | 1.7±0.4 | 19.3±5.7 |
| ロドピン細粒50% | 55.21±36.77 | 5.91±4.92 | 1.9±0.5 | 18.4±5.3 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
(3)ゾテピン錠25mg「タカタ」
ゾテピン錠25mg「タカタ」とロドピン錠25mgをクロスオーバー法により、健康成人男子18名にそれぞれ2錠(ゾテピンとして50mg)を空腹時に単回経口投与し、投与前、投与後0.5、1、1.5、2、3、4、6、8、12、24及び36時間に前腕静脈から採血した。液体クロマトグラフィーにより測定したゾテピンの血漿中濃度の推移及びパラメータは次のとおりであり、AUC及びCmaxについて統計的評価を行った結果、両剤の生物学的同等性が確認された3)。
図16-3 血漿中濃度(錠25mg)
| 判定パラメータ | 参考パラメータ | |||
| AUCt(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | |
| ゾテピン錠25mg「タカタ」 | 65.53±13.12 | 6.10±1.37 | 4.1±0.5 | 17.6±3.6 |
| ロドピン錠25mg | 62.71±12.38 | 6.44±1.45 | 4.1±0.6 | 19.4±7.4 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
(4)ゾテピン錠50mg「タカタ」
ゾテピン錠50mg「タカタ」とロドピン錠50mgをクロスオーバー法により、健康成人男子16名にそれぞれ1錠(ゾテピンとして50mg)を空腹時に単回経口投与し、投与前、投与後1、2、3、4、5、6、7、8、12、24及び36時間に前腕静脈から採血した。液体クロマトグラフィーにより測定したゾテピンの血漿中濃度の推移及びパラメータは次のとおりであり、AUC及びCmaxについて統計的評価を行った結果、両剤の生物学的同等性が確認された4)。
図16-4 血漿中濃度(錠50mg)
| 判定パラメータ | 参考パラメータ | |||
| AUCt(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | |
| ゾテピン錠50mg「タカタ」 | 119.48±26.26 | 9.76±2.77 | 5.0±0.3 | 16.8±2.0 |
| ロドピン錠50mg | 117.25±22.59 | 9.41±2.20 | 4.4±0.4 | 15.9±1.5 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
16.8 その他
ゾテピン錠100mg「タカタ」はゾテピン錠50mg「タカタ」と含量が異なる製剤として開発されたことから、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン」に基づき、溶出挙動を比較したところ同等と判断され、両剤は生物学的に同等とみなされた6)。
18. 薬効薬理
18.1 作用機序
ゾテピンはドパミンD2受容体よりもセロトニン(5-HT)2A受容体に対する親和性が相対的に高い。さらに、ドパミンD1、アドレナリンα1、α2、ムスカリン性アセチルコリンM1、ヒスタミンH1受容体などにも非較的高い親和性を有している7)。
19. 有効成分に関する理化学的知見
19.1. ゾテピン
22. 包装
<ゾテピン細粒10%「タカタ」>
500g[プラスチック瓶、バラ、乾燥剤入り]
<ゾテピン細粒50%「タカタ」>
100g[プラスチック瓶、バラ、乾燥剤入り]
<ゾテピン錠25mg「タカタ」>
100錠[10錠(PTP)×10]
500錠[プラスチック瓶、バラ]
<ゾテピン錠50mg「タカタ」>
100錠[10錠(PTP)×10]
500錠[プラスチック瓶、バラ]
<ゾテピン錠100mg「タカタ」>
100錠[10錠(PTP)×10]
100錠[プラスチック瓶、バラ]
23. 主要文献
- 社内資料:生物学的同等性試験(ゾテピン細粒10%「タカタ」)
- 社内資料:生物学的同等性試験(ゾテピン細粒50%「タカタ」)
- 社内資料:生物学的同等性試験(ゾテピン錠25mg「タカタ」)
- 社内資料:生物学的同等性試験(ゾテピン錠50mg「タカタ」)
- 坂本宏 他, 北陸神経精神医学雑誌, 10 (1-2), 65, (1996)
- 社内資料:生物学的同等性試験及び溶出性試験(ゾテピン錠100mg「タカタ」)
- 黒木俊秀, Pharma Medica, 17 (8), 131-136, (1999)
24. 文献請求先及び問い合わせ先
文献請求先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-838-2121
製品情報問い合わせ先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-838-2121
26. 製造販売業者等
26.1 製造販売元
高田製薬株式会社
さいたま市西区宮前町203番地1