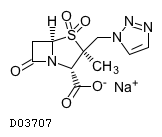
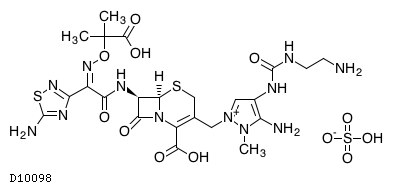
医薬品情報
| 総称名 | ザバクサ |
|---|---|
| 一般名 | タゾバクタムナトリウム セフトロザン硫酸塩 |
| 欧文一般名 | Tazobactam Sodium Ceftolozane Sulfate |
| 製剤名 | 注射用タゾバクタムナトリウム・セフトロザン硫酸塩 |
| 薬効分類名 | β-ラクタマーゼ阻害剤配合抗生物質製剤 |
| 薬効分類番号 | 6139 |
| ATCコード | J01DI54 |
| KEGG DRUG |
D10577
セフトロザン硫酸塩・タゾバクタムナトリウム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年11月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ザバクサ配合点滴静注用 | ZERBAXA Combination for Intravenous Drip Infusion | MSD | 6139506D1020 | 5967円/瓶 | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分又はセフェム系抗生物質に対し過敏症の既往歴のある患者
2.2 他のβ-ラクタム系抗生物質(ペニシリン系、カルバペネム系等)に対し重篤な過敏症(アナフィラキシー、重度の皮膚反応等)の既往歴のある患者[9.1.1参照]
4. 効能または効果
5. 効能または効果に関連する注意
<効能共通>
5.1 本剤の使用に際しては、β-ラクタマーゼの関与が考えられ、本剤に感性の原因菌による感染症である場合に投与すること。
<肺炎>
5.2 臨床試験の対象が院内肺炎患者であったことを踏まえ、適切な患者に投与すること。[17.1.5参照]
6. 用法及び用量
<膀胱炎、腎盂腎炎、腹膜炎、腹腔内膿瘍、胆嚢炎、肝膿瘍>
通常、成人には1回1.5g(タゾバクタムとして0.5g/セフトロザンとして1g)を1日3回60分かけて点滴静注する。
なお、腹膜炎、腹腔内膿瘍、胆嚢炎、肝膿瘍に対しては、メトロニダゾール注射液と併用すること。
なお、腹膜炎、腹腔内膿瘍、胆嚢炎、肝膿瘍に対しては、メトロニダゾール注射液と併用すること。
<敗血症、肺炎>
通常、成人には1回3g(タゾバクタムとして1g/セフトロザンとして2g)を1日3回60分かけて点滴静注する。
7. 用法及び用量に関連する注意
<効能共通>
7.1 腎機能障害のある患者(CLCRが50mL/min以下)に対しては下表を参考に本剤の用量を調節すること。[8.3、9.2、9.8、16.6.1参照]
| クレアチニンクリアランス(CLCR)* | 本剤投与量** |
| 30〜50mL/min | 1回750mg1)を1日3回投与 |
| 15〜29mL/min | 1回375mg2)を1日3回投与 |
| 血液透析中の腎不全患者§ | 1回150mg3)を1日3回投与。ただし、初回のみ750mg1)とすること(血液透析実施日は透析終了後速やかに投与)。 |
| クレアチニンクリアランス(CLCR)* | 本剤投与量** |
| 30〜50mL/min | 1回1.5g1)を1日3回投与 |
| 15〜29mL/min | 1回750mg2)を1日3回投与 |
| 血液透析中の腎不全患者§ | 1回450mg3)を1日3回投与。ただし、初回のみ2.25g4)とすること(血液透析実施日は透析終了後速やかに投与)。 |
* Cockcroft-Gault式により推定したCLCR
** いずれの用量も60分かけて投与する。
§ CLCRが15mL/min未満で血液透析をしていない患者における臨床推奨用量の根拠となるデータは得られていない。
<腹膜炎、腹腔内膿瘍、胆嚢炎、肝膿瘍>
<敗血症、肺炎>
7.3 本剤の適応菌種等を踏まえ、必要に応じてグラム陽性菌に抗菌活性を有する適切な薬剤を併用して治療を行うこと。[17.1.5参照]
8. 重要な基本的注意
8.1 本剤によるショック、アナフィラキシーの発生を確実に予知できる方法がないので、次の措置をとること。[11.1.1参照]
8.1.1 事前に既往歴等について十分な問診を行うこと。なお、抗生物質等によるアレルギー歴は必ず確認すること。
8.1.2 投与に際しては、必ずショック等に対する救急処置のとれる準備をしておくこと。
8.1.3 投与開始から投与終了後まで、患者を安静の状態に保たせ、十分な観察を行うこと。特に、投与開始直後は注意深く観察すること。
8.2 本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 セフェム系以外のβ-ラクタム系抗生物質(ペニシリン系、カルバペネム系等)に対し過敏症の既往歴のある患者(ただし、セフェム系以外のβ-ラクタム系抗生物質に対し重篤な過敏症の既往歴のある患者には投与しないこと)
慎重に投与すること。本剤に対しアナフィラキシーがあらわれた場合は、投与を中止し、適切な処置を行うこと。交差反応性が認められている。[2.2参照]
9.2 腎機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。セフトロザンが動物において胎盤を通過するかどうかは不明である。セフトロザンの動物実験(ラット)において、妊娠及び授乳期間中に300mg/kg/日[本剤3g(タゾバクタム1g、セフトロザン2g)を60分かけて点滴静注で8時間ごとに反復投与した際のセフトロザンの臨床曝露量を下回る用量]以上を投与したとき、生後60日の出生児に聴覚性驚愕反応の低下が認められた。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。タゾバクタム及びセフトロザンがヒト乳汁中へ移行するかは不明である。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
10. 相互作用
10.2 併用注意
| プロベネシド | タゾバクタムの半減期が延長し、タゾバクタムの血漿中濃度を上昇させるおそれがある。 | プロベネシドが腎尿細管分泌を阻害することにより、タゾバクタムの排泄速度を低下させると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー等の重篤な過敏症反応があらわれることがある。[8.1参照]
11.1.2 クロストリジウム・ディフィシレ大腸炎(0.4%)
腹痛、頻回の下痢があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.3 急性腎障害(0.1%)[8.3参照]
11.1.4 脳出血(頻度不明)
11.2 その他の副作用
| 1%以上 | 頻度不明 | |
| 感染症及び寄生虫症 | カンジダ症(中咽頭カンジダ症及び外陰部腟カンジダ症を含む)、真菌性尿路感染、クロストリジウム・ディフィシレ感染 | |
| 血液及びリンパ系障害 | 貧血、ヘモグロビン減少、鉄欠乏性貧血、血小板増加症 | |
| 代謝及び栄養障害 | 低カリウム血症、高血糖、低マグネシウム血症、低リン酸血症 | |
| 精神障害 | 不安、不眠症 | |
| 神経系障害 | 頭痛 | 浮動性めまい |
| 心臓障害 | 心房細動、頻脈、狭心症 | |
| 血管障害 | 低血圧 | |
| 呼吸器、胸郭及び縦隔障害 | 呼吸困難 | |
| 胃腸障害 | 下痢、悪心 | 腹痛、便秘、嘔吐、胃炎、腹部膨満、消化不良、鼓腸、麻痺性イレウス |
| 皮膚及び皮下組織障害 | 発疹、全身性皮疹、斑状丘疹状皮疹、そう痒性皮疹、斑状皮疹、エリテマトーデス皮疹、蕁麻疹 | |
| 一般・全身障害及び投与部位の状態 | 注入部位紅斑、注入部位浮腫、注入部位硬結、注入部位疼痛、注入部位静脈炎、注入部位そう痒感、注入部位血栓、注入部位感染、注入部位発疹、発熱、体温上昇、高熱 | |
| 臨床検査 | AST増加、ALT増加 | 血中Al-P増加、γ-GTP増加、肝機能検査異常、トランスアミナーゼ上昇、クロストリジウム検査陽性 |
12. 臨床検査結果に及ぼす影響
直接クームス試験陽性を呈することがある。
13. 過量投与
本剤は血液透析により体内から除去される。本剤750mg(タゾバクタム250mg、セフトロザン500mg)を末期腎不全患者に投与した試験では、タゾバクタムの約56%、タゾバクタム代謝物M1の約51%、セフトロザンの約66%が透析により除去された1)。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤1バイアルにつき10mLの注射用水又は生理食塩液を加え、ゆっくりと振り混ぜて溶解する(最終容量約11.4mL)。この溶解液を直接投与しないこと。
14.1.2 溶解後速やかに、溶解液入りバイアルから全量(用量調節をする場合は必要量)を取り、生理食塩液又は5%ブドウ糖注射液100mLの点滴バッグに注入し、希釈する。
14.1.3 本剤は保存剤を含まない。調製後は25℃以下では24時間以内、2〜8℃では4日以内に使用し、凍結させないこと。
14.1.4 他の薬剤との混合は避けること。配合変化のデータは限られている。
14.1.5 本剤の使用前には目視で粒子状物質及び色調の変化がないか確認すること。希釈後の液は無色〜微黄色澄明である。溶液に粒子状物質や変色があった場合は使用しないこと。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人健康成人に本剤を60分かけて点滴静注で単回投与した際のタゾバクタム及びセフトロザンの薬物動態パラメータを表1に示す。タゾバクタム及びセフトロザンのCmax及びAUC0-∞は用量に比例して増加した2)。
| タゾバクタム | セフトロザン | |||
| 用量 | 1.5g* | 3.0g** | 1.5g* | 3.0g** |
| 例数 | 10 | 9 | 10 | 9 |
| Cmax(μg/mL) | 16.9(14.7) | 32.7(12.2) | 71.1(14.3) | 132(8.1) |
| AUC0-∞(μg・hr/mL) | 22.0(22.2) | 41.5(14.1) | 154(12.6) | 292(11.9) |
| t1/2(hr) | 0.584(13.8) | 0.581(6.0) | 1.83(8.3) | 1.81(8.4) |
クレアチニンクリアランスが180mL/min以上の重症患者(10例)に本剤3gを60分かけて点滴静注で単回投与した際のタゾバクタム及びセフトロザンの薬物動態パラメータを表2に示す。遊離型タゾバクタムの血漿中濃度は8時間の投与間隔の60%にわたって1μg/mL超を維持していた。遊離型セフトロザンの血漿中濃度は8時間の投与間隔の70%にわたって8μg/mL超を維持していた3)(外国人データ)。
| タゾバクタム | セフトロザン | |
| 例数 | 10 | 10 |
| Cmax(μg/mL) | 17.4(13.5,22.5) | 68.9(55.0,86.5) |
| AUC0-∞(μg・hr/mL) | 34.8(21.7,55.9)* | 223(152,327) |
| t1/2(hr) | 1.47(43.5)** | 2.59(51.1)** |
16.1.2 反復投与
国内第III相試験において日本人の複雑性尿路感染症患者及び複雑性腹腔内感染症患者に本剤1.5gを60分かけて点滴静注で8時間ごとに反復投与した際の、母集団薬物動態解析に基づくタゾバクタム及びセフトロザンの定常状態時の薬物動態パラメータを表3に示す4)。
国際共同第III相試験において日本人を含む人工呼吸器を装着している院内肺炎患者に本剤3gを60分かけて点滴静注で8時間ごとに反復投与した際の、母集団薬物動態解析に基づくタゾバクタム及びセフトロザンの定常状態時の薬物動態パラメータを表4に示す5)。
国際共同第III相試験において日本人を含む人工呼吸器を装着している院内肺炎患者に本剤3gを60分かけて点滴静注で8時間ごとに反復投与した際の、母集団薬物動態解析に基づくタゾバクタム及びセフトロザンの定常状態時の薬物動態パラメータを表4に示す5)。
| 複雑性尿路感染症患者 | 複雑性腹腔内感染症患者 | |||
| タゾバクタム | セフトロザン | タゾバクタム | セフトロザン | |
| 例数 | 103 | 103 | 97 | 97 |
| Cmax(μg/mL) | 18.7(36.5) | 72.7(32.8) | 17.8(53.6) | 63.0(47.0) |
| AUCtau,ss(μg・hr/mL) | 32.7(42.1) | 215(33.0) | 31.1(68.8) | 179(49.2) |
| t1/2(hr) | 1.34(22.3) | 2.68(28.3) | 1.35(31.4) | 2.40(28.1) |
| タゾバクタム | セフトロザン | |
| 例数 | 247 | 247 |
| Cmax(μg/mL) | 24.2(41.6) | 96.1(43.3) |
| AUCtau,ss(μg・hr/mL) | 56.1(73.7) | 341(55.2) |
| t1/2(hr) | 2.89(40.0) | 3.48(46.2) |
16.3 分布
ヒトでの血漿蛋白結合率はタゾバクタムが約30%、セフトロザンが約16%〜21%である。健康成人51例に本剤1.5gを単回静脈内投与したとき、定常状態における分布容積の平均値(変動係数%)はタゾバクタムで18.2L(25%)、セフトロザンで13.5L(21%)であり、細胞外液量と同程度であった6)。肺炎患者(22例)に本剤3g(又はCLCRに基づいて調節した用量)を60分かけて8時間ごとに点滴静注したとき、肺上皮被覆液(ELF)中のタゾバクタム及びセフトロザンの濃度は投与間隔を通して、それぞれ1μg/mL超及び8μg/mL超であった。非結合型薬物のAUCのELF/血漿比はタゾバクタムで約0.62、セフトロザンで約0.50であった3)(外国人データ)。
16.4 代謝
16.5 排泄
タゾバクタム、タゾバクタム代謝物M1及びセフトロザンは腎臓を介して排泄される。本剤1.5gを健康成人男性に単回静脈内投与したとき、タゾバクタムは投与量の80%超が未変化体として排泄され、残りは代謝物M1として排泄された。セフトロザンは投与量の95%超が未変化体として尿中に排泄された。単回投与後のセフトロザンの腎クリアランス(3.41〜6.69L/hr)は全身血漿クリアランス(4.10〜6.73L/hr)及び非結合型セフトロザンの糸球体ろ過量と同程度であることから、セフトロザンは腎臓の糸球体ろ過により排泄されると考えられた。腎機能が正常な健康成人における終末相消失半減期の平均値は、タゾバクタムが約1時間、セフトロザンが約2〜3時間であった10)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害者
軽度、中等度及び重度の腎機能障害者では腎機能正常者と比較し、タゾバクタムの用量補正したAUCの幾何平均がそれぞれ約1.3倍、2倍及び4倍に、セフトロザンの用量補正したAUCの幾何平均がそれぞれ約1.3倍、2.5倍及び5倍に増加した1)11)。また、タゾバクタム及びセフトロザンの投与量の約2/3が血液透析により除去される1)(外国人データ)。
軽度、中等度及び重度の腎機能障害者並びに腎機能正常者に本剤を60分かけて点滴静注で単回投与した際のタゾバクタム及びセフトロザンの薬物動態パラメータを表5に示す。[7.1、9.2、16.1.2参照]
軽度、中等度及び重度の腎機能障害者並びに腎機能正常者に本剤を60分かけて点滴静注で単回投与した際のタゾバクタム及びセフトロザンの薬物動態パラメータを表5に示す。[7.1、9.2、16.1.2参照]
| 腎機能障害の程度 | 用量 | タゾバクタム | セフトロザン | |||
| Cmax(μg/mL) | AUC0-∞(μg・hr/mL) | Cmax(μg/mL) | AUC0-∞(μg・hr/mL) | |||
| 軽度(CLCR 60〜89mL/min) (6例) | 1.5g | 22.1(15.9) | 34.8(13.5) | 98.7(24.7) | 307(10.9) | |
| 正常(CLCR 90mL/min以上) (5例)* | 1.5g | 16.4(9.3) | 27.0(17.3) | 76.0(13.3) | 244(20.5) | |
| 中等度(CLCR 30〜59mL/min) (7例) | 1.5g | 26.4(6.9) | 65.1(20.9) | 85.0(25.2) | 556(37.8) | |
| 正常(CLCR 90mL/min以上) (6例)** | 1.5g | 20.0(27.9) | 32.8(15.8) | 76.1(51.5) | 224(25.7) | |
| 重度(CLCR 30mL/min未満) (6例) | 750mg | 15.2§(22.2) | 52.4§(26.5) | 49.9§(27.8) | 537§(23.1) | |
16.6.2 肝機能障害者
タゾバクタム及びセフトロザンは肝臓で代謝されず、本剤の消失は肝機能障害の影響を受けないと考えられる。
16.7 薬物相互作用
16.7.1 In vitro試験
タゾバクタムは有機アニオントランスポーター(OAT1及びOAT3)の基質である。また、タゾバクタムはヒトOAT1及びOAT3を阻害し、そのIC50値はそれぞれ118μg/mL及び147μg/mLであった。
16.7.2 臨床薬物相互作用試験
タゾバクタム及びセフトロザンがOAT1及びOAT3の基質(フロセミド)、CYP1A2の基質(カフェイン)並びにCYP3A4の基質(ミダゾラム)の薬物動態に及ぼす影響を表6に示す9)(外国人データ)。
| 併用薬 | 用量・用法 | 例数 | 併用薬の薬物動態パラメータの幾何平均の比 併用時/非併用時 (90%信頼区間) | ||
| 併用薬 | 本剤 | Cmax | AUC0-∞ | ||
| フロセミド | 20mg単回経口* | 1.5g静注8時間ごと | 16‖ | 0.83 (0.63,1.10) | 0.87 (0.73,1.04) |
| カフェイン | 200mg単回経口** | 1.5g静注8時間ごと | 16 | 0.97 (0.91,1.04) | 1.10 (1.05,1.16) |
| 200mg単回経口§ | 16 | 1.00 (0.93,1.06) | 1.06 (1.01,1.12) | ||
| ミダゾラム | 2mg単回経口** | 1.5g静注8時間ごと | 16 | 0.99 (0.92,1.07) | 1.07 (1.02,1.12) |
| 2mg単回経口§ | 16 | 1.15 (1.06,1.23) | 1.23 (1.17,1.29) | ||
17. 臨床成績
17.1 有効性及び安全性に関する試験
<膀胱炎、腎盂腎炎>
17.1.1 国内第III相試験(014試験)
腎盂腎炎又は複雑性膀胱炎患者を対象に、本剤1.5gを1日3回、7日間点滴静注したときの有効性及び安全性を検討することを目的として、非盲検非対照試験を実施した。
疾患別の有効率(投与終了後7日目の細菌学的効果)を表1に示す。また、原因菌別細菌学的効果を表2に示す12)。
投与終了後7日目の敗血症に対する臨床効果(Microbiologically Evaluable集団)は57.1%(8/14例)であり、細菌学的効果(Microbiologically Evaluable集団)は100%(13/13例)であった13)。
疾患別の有効率(投与終了後7日目の細菌学的効果)を表1に示す。また、原因菌別細菌学的効果を表2に示す12)。
投与終了後7日目の敗血症に対する臨床効果(Microbiologically Evaluable集団)は57.1%(8/14例)であり、細菌学的効果(Microbiologically Evaluable集団)は100%(13/13例)であった13)。
| 尿路感染症 | 細菌学的効果 | ||
| 全体 | 72/95(75.8) | ||
| 複雑性膀胱炎 | 21/26(80.8) | ||
| 腎盂腎炎 | 51/69(73.9) | ||
| 単純性腎盂腎炎 | 37/42(88.1) | ||
| 複雑性腎盂腎炎 | 14/27(51.9) | ||
| 尿路感染症 | |
| 大腸菌 | 64/81(79.0) |
| シトロバクター属 | 1/1 |
| クレブシエラ属 | 3/8(37.5) |
| エンテロバクター属 | 1/2 |
| プロテウス属 | 5/5(100) |
| 緑膿菌 | 1/1 |
本剤の投与を受けた114例中20例(17.5%)に副作用が認められた。主な副作用は下痢6例(5.3%)、ALT増加6例(5.3%)、AST増加4例(3.5%)、γ-GTP増加2例(1.8%)、肝機能異常2例(1.8%)であった。
17.1.2 海外第III相試験(10-04/05試験)
腎盂腎炎又は複雑性膀胱炎患者を対象に、本剤1.5gを1日3回、7日間点滴静注したときの有効性及び安全性を検討することを目的として、レボフロキサシン注射液を対照とした無作為化二重盲検並行群間比較試験を実施した。投与終了後7日目の細菌学的効果(Microbiological modified intent-to-treat集団)は、本剤群79.0%(313/396例)及び対照群70.1%(281/401例)であった14)。
本剤の投与を受けた530例中55例(10.4%)に副作用が認められた。主な副作用は頭痛10例(1.9%)、悪心7例(1.3%)、AST増加7例(1.3%)、ALT増加6例(1.1%)であった。
本剤の投与を受けた530例中55例(10.4%)に副作用が認められた。主な副作用は頭痛10例(1.9%)、悪心7例(1.3%)、AST増加7例(1.3%)、ALT増加6例(1.1%)であった。
<腹膜炎、腹腔内膿瘍、胆嚢炎、肝膿瘍>
17.1.3 国内第III相試験(013試験)
胆嚢炎、肝膿瘍、腹腔内膿瘍又は腹膜炎患者を対象に、本剤1.5g及びメトロニダゾール注射液0.5gを、1日3回、4〜14日間点滴静注したときの有効性及び安全性を検討することを目的として、非盲検非対照試験を実施した。
疾患別の有効率(投与開始後28日目の臨床効果)を表3に示す。また、原因菌別細菌学的効果を表4に示す15)。[7.2参照]
疾患別の有効率(投与開始後28日目の臨床効果)を表3に示す。また、原因菌別細菌学的効果を表4に示す15)。[7.2参照]
| 腹腔内感染症 | 臨床効果 | |
| 全体 | 87/100(87.0) | |
| 胆嚢炎 | 27/30(90.0) | |
| 肝膿瘍 | 8/8(100) | |
| 腹腔内膿瘍 | 61/68(89.7) | |
| 腹膜炎 | 58/67(86.6) | |
| 腹腔内感染症 | |
| レンサ球菌属 | 24/26(92.3) |
| 大腸菌 | 38/43(88.4) |
| シトロバクター属 | 6/6(100) |
| クレブシエラ属 | 17/18(94.4) |
| エンテロバクター属 | 3/4(75.0) |
| プロテウス属 | 1/1 |
| 緑膿菌 | 8/9(88.9) |
本剤の投与を受けた100例中19例(19.0%)に副作用が認められた。主な副作用はAST増加11例(11.0%)、ALT増加9例(9.0%)、下痢3例(3.0%)、悪心2例(2.0%)であった。
17.1.4 海外第III相試験(10-08/09試験)
<敗血症、肺炎>
17.1.5 国際共同第III相試験(008試験)
人工呼吸器を装着している院内肺炎患者726例(日本人13例、うち本剤投与5例を含む)を対象に、本剤3gを1日3回、8〜14日間点滴静注したときの有効性及び安全性を検討することを目的として、メロペネムを対照とした無作為化二重盲検並行群間比較試験を実施した。本試験では、治験薬投与開始時からベースライン時の下気道検体の培養結果が得られるまでの期間は、すべての被験者に対してグラム陽性菌に対する経験的治療(リネゾリド又は代替抗菌薬の投与)を行うことが規定されていた。
投与終了後7〜14日目の臨床効果(Intent-to-treat集団)は、本剤群54.4%(197/362例)及び対照群53.3%(194/364例)であり、投与開始後28日の全死亡率(Intent-to-treat集団)は、本剤群24.0%(87/362例)及び対照群25.3%(92/364例)であった。原因菌別細菌学的効果を表5に示す。
投与終了後7〜14日目の敗血症に対する臨床効果(敗血症評価対象集団)は本剤群24.6%(15/61例)、対照群17.9%(7/39例)であり、細菌学的効果(敗血症評価対象集団)は本剤群49.2%(30/61例)、対照群41.0%(16/39例)であった17)。[5.2、7.3参照]
投与終了後7〜14日目の臨床効果(Intent-to-treat集団)は、本剤群54.4%(197/362例)及び対照群53.3%(194/364例)であり、投与開始後28日の全死亡率(Intent-to-treat集団)は、本剤群24.0%(87/362例)及び対照群25.3%(92/364例)であった。原因菌別細菌学的効果を表5に示す。
投与終了後7〜14日目の敗血症に対する臨床効果(敗血症評価対象集団)は本剤群24.6%(15/61例)、対照群17.9%(7/39例)であり、細菌学的効果(敗血症評価対象集団)は本剤群49.2%(30/61例)、対照群41.0%(16/39例)であった17)。[5.2、7.3参照]
| 細菌学的効果 | |
| 大腸菌 | 43/51(84.3) |
| シトロバクター属 | 7/8(87.5) |
| クレブシエラ属 | 80/106(75.5) |
| エンテロバクター属 | 12/18(66.7) |
| セラチア属 | 12/19(63.2) |
| プロテウス属 | 21/27(77.8) |
| インフルエンザ菌 | 20/22(90.9) |
| 緑膿菌 | 47/63(74.6) |
本剤の投与を受けた361例中38例(10.5%)に副作用が認められた。主な副作用は下痢4例(1.1%)、クロストリジウム・ディフィシレ大腸炎4例(1.1%)、肝酵素上昇4例(1.1%)、肝機能検査異常4例(1.1%)であった。
18. 薬効薬理
18.1 作用機序
タゾバクタムは多くのAmblerクラスAのβ-ラクタマーゼ(CTX-M、SHV、TEM)に対して阻害作用を示すことによりセフトロザンが加水分解されることを防ぐ。セフトロザンはセファロスポリン系に属する抗菌薬で、細菌のペニシリン結合蛋白質に作用し、細胞壁合成を阻害して殺菌作用を示す18)。本剤は、基質特異性拡張型β-ラクタマーゼや他のタイプのβ-ラクタマーゼ(TEM、SHV、CTX-M、OXA)産生の腸内細菌科細菌に対して抗菌活性を示し、また、染色体性AmpC産生、菌体外膜蛋白質のポーリン(OprD)欠損あるいは排出ポンプ(MexXY、MexAB)の亢進した緑膿菌に対しても抗菌活性を示す19)。
18.2 抗菌作用
本剤は、レンサ球菌属、腸内細菌科細菌(大腸菌、シトロバクター属、クレブシエラ属、エンテロバクター属、セラチア属、プロテウス属等)、インフルエンザ菌、緑膿菌に対して抗菌活性を示す20)。
19. 有効成分に関する理化学的知見
19.1. タゾバクタムナトリウム
19.2. セフトロザン硫酸塩
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
1バイアル×10
23. 主要文献
- 社内資料:重度腎機能障害者対象海外臨床試験(2019年1月8日承認、CTD 2.7.2.2、CTD 2.7.2.3)
- 社内資料:日本人健康成人対象海外単回投与試験(2019年1月8日承認、CTD 2.7.2.2)
- 社内資料:肺炎患者対象肺移行性試験(2019年12月20日承認、CTD 2.7.2.2)
- 社内資料:日本人患者対象国内反復投与試験(2019年1月8日承認、CTD 2.7.2.2)
- 社内資料:肺炎患者の母集団薬物動態解析(2019年12月20日承認、CTD 2.7.2.3)
- 社内資料:健康成人対象海外単回投与試験(2019年1月8日承認、CTD 2.7.6.2)
- Halstenson CE,et al., J Clin Pharmacol., 34, 1208-17, (1994) »PubMed
- Sorgel F,et al., J Antimicrob Chemother., 31 (Suppl.A), 39-60, (1993)
- 社内資料:薬物相互作用試験(2019年1月8日承認、CTD 2.7.6.2)
- 社内資料:健康成人対象海外試験の単回投与時の薬物動態の検討(2019年1月8日承認、CTD 2.7.2.3)
- 社内資料:軽度及び中等度腎機能障害者対象海外臨床試験(2019年1月8日承認、CTD 2.7.2.3)
- 社内資料:国内第III相臨床試験(014試験)(2019年1月8日承認、CTD 2.7.6.3)
- 社内資料:国内第III相臨床試験(014試験)(2019年1月8日承認、CTD 2.7.3.3)
- 社内資料:海外第III相臨床試験(10-04/05試験)(2019年1月8日承認、CTD 2.7.6.3)
- 社内資料:国内第III相臨床試験(013試験)(2019年1月8日承認、CTD 2.7.6.3)
- 社内資料:海外第III相臨床試験(10-08/09試験)(2019年1月8日承認、CTD 2.7.6.3)
- 社内資料:国際共同第III相試験(008試験)(2019年12月20日承認、CTD 2.7.6.3)
- Moya B,et al., Antimicrob Agents Chemother., 54, 3933-7, (2010) »PubMed
- Takeda S,et al., Antimicrob Agents Chemother., 51, 826-30, (2007) »PubMed
- 日高裕介,他, 日本化学療法学会雑誌, 66, 567-77, (2018)
24. 文献請求先及び問い合わせ先
文献請求先
MSD株式会社
MSDカスタマーサポートセンター
東京都千代田区九段北1-13-12
電話:医療関係者の方:フリーダイヤル0120-024-961
製品情報問い合わせ先
MSD株式会社
MSDカスタマーサポートセンター
東京都千代田区九段北1-13-12
電話:医療関係者の方:フリーダイヤル0120-024-961
26. 製造販売業者等
26.1 製造販売元
MSD株式会社
東京都千代田区九段北1-13-12