医薬品情報
| 総称名 | デムサー |
|---|---|
| 一般名 | メチロシン |
| 欧文一般名 | Metirosine |
| 製剤名 | メチロシンカプセル |
| 薬効分類名 | チロシン水酸化酵素阻害剤 |
| 薬効分類番号 | 2190 |
| ATCコード | C02KB01 |
| KEGG DRUG |
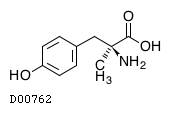
D00762
メチロシン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年7月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| デムサーカプセル250mg | DEMSER Capsules | 小野薬品工業 | 2190038M1024 | 5961.9円/カプセル | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 重度腎機能障害(eGFR<30mL/分)のある患者[9.2.1参照]
4. 効能または効果
褐色細胞腫のカテコールアミン分泌過剰状態の改善
5. 効能または効果に関連する注意
本剤は、以下のいずれも満たす場合に使用すること。
・既存の交感神経受容体遮断薬による治療では十分な治療効果が得られていない。
・外科手術前の処置、外科手術が適応とならない患者の管理、悪性褐色細胞腫患者の慢性的治療を目的とする。
6. 用法及び用量
通常、成人及び12歳以上の小児にはメチロシンとして1日500mgから経口投与を開始する。
効果不十分な場合は、経過を十分に観察しながら3日間以上の間隔をおいて1日250mg又は500mgずつ漸増し、患者の尿中カテコールアミン量及び症状の十分な観察のもと、適宜増減する。
ただし、1日最高用量は4,000mg、1回最高用量は1,000mg、投与間隔は4時間以上とし、1日500mgは1日2回、1日750mgは1日3回、1日1,000mg以上は1日4回に分割する。
効果不十分な場合は、経過を十分に観察しながら3日間以上の間隔をおいて1日250mg又は500mgずつ漸増し、患者の尿中カテコールアミン量及び症状の十分な観察のもと、適宜増減する。
ただし、1日最高用量は4,000mg、1回最高用量は1,000mg、投与間隔は4時間以上とし、1日500mgは1日2回、1日750mgは1日3回、1日1,000mg以上は1日4回に分割する。
7. 用法及び用量に関連する注意
7.1 本剤は原則として交感神経受容体遮断薬と併用して使用すること。[17.1.1参照]
7.2 本剤の開始時及び用量調節時にカテコールアミンの指標である尿中のメタネフリン量、ノルメタネフリン量を測定し、投与開始前の測定値から50%以上減少する投与量を目安として維持用量を決定する。なお、維持用量は、尿中のアドレナリン、ノルアドレナリン、バニリルマンデル酸の測定値、血圧、患者の自覚症状等も参考に、総合的に判断して決定すること。また、本剤の開始時及び用量調節時は特に慎重に患者の状態を観察し、副作用の発現等に注意すること。[8.1参照]
7.3 尿中のメタネフリン量、ノルメタネフリン量は、適切に採取された24時間蓄尿検体を用いる等、精度の高い評価方法により測定すること。[17.1.1参照]
7.4 本剤は主に腎臓で排泄されるため、中等度腎機能障害(eGFR≧30mL/分、<60mL/分)のある患者では、3日間以上の間隔をおいて1日250mgずつ慎重に漸増すること。[8.6、9.2.2、16.6.1参照]
7.6 4日間以上休薬した後、投与を再開する場合には、「用法及び用量」の項に従って1日500mg以下から開始し、休薬前の本剤の投与量も考慮したうえで、段階的に増量すること。
7.7 国内臨床試験では日本人に1日2,500mgを超えて使用した経験はない。[17.1.1参照]
8. 重要な基本的注意
8.1 本剤はカテコールアミンの低下作用を有するため、血圧低下があらわれることがある。本剤投与中は用量調節時等、定期的に尿中カテコールアミン量を測定するとともに血圧測定を行うこと。また、血圧低下のおそれがある場合には、交感神経受容体遮断薬、その他の降圧剤又は本剤の減量等の処置を考慮すること。[7.2参照]
8.3 本剤を成分とする結晶尿があらわれることがあるので、1日1Lを目安に積極的な水分摂取を行うよう患者に指導し、定期的に尿検査を実施すること。本剤の1日量が2,000mgを超える場合は1日の排尿量が2L以上になるよう患者に指導すること。本剤による結晶尿があらわれた場合には、水分摂取量をさらに増やすこと。[11.1.5参照]
8.4 褐色細胞腫の手術前における本剤の臨床試験での使用経験は限られており、緊急手術前の使用経験がない。本剤を投与しても手術操作に伴う高血圧クリーゼ又は不整脈があらわれることがあるため、注意すること。
8.5 本剤の投与中止後に睡眠障害(不眠症、過覚醒、活力増進、精神運動亢進)があらわれることがあるので、これらの症状の発現に注意すること。
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.2.1 重度の腎機能障害患者(eGFR<30mL/分)
投与しないこと。使用経験がなく、本剤の血中濃度が著しく上昇するおそれがある。[2.2参照]
9.4 生殖能を有する者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
本剤を用いた生殖発生毒性試験は実施されていないが、作用機序から胎児に影響を及ぼす可能性がある。[9.4参照]
本剤を用いた生殖発生毒性試験は実施されていないが、作用機序から胎児に影響を及ぼす可能性がある。[9.4参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
低出生体重児、新生児、乳児、幼児又は12歳未満の小児を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を十分に観察しながら慎重に投与すること。一般に生理機能が低下している。[7.5参照]
10. 相互作用
10.2 併用注意
| 降圧剤 | 血圧低下を起こすおそれがあるので、減量するなど注意すること。 | 相互に降圧作用を増強することがある。 |
| アルコール (飲酒) | 鎮静作用を増強するおそれがある。 | 相互に中枢神経抑制作用を増強するおそれがある。 |
| 中枢神経系抑制剤 (睡眠剤、麻酔剤、鎮静剤等) | 鎮静作用を増強するおそれがある。 | 相互に中枢神経抑制作用を増強するおそれがある。 |
| フェノチアジン系抗精神病薬 クロルプロマジン、レボメプロマジン、ペルフェナジン、フルフェナジン、プロクロルペラジン、プロペリシアジン ハロペリドール | 錐体外路障害を増強するおそれがある。 | 相互に錐体外路障害を増強するおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 鎮静(12.5%)、傾眠(81.3%)[8.2参照]
11.1.2 精神障害
不安、不眠症、うつ病(いずれも6.3%)、幻覚、失見当識、錯乱状態(いずれも頻度不明)等の精神障害があらわれることがある。
11.1.3 錐体外路障害
流涎、会話障害、開口障害、パーキンソニズム(いずれも頻度不明)、振戦、運動緩慢、表情減少(いずれも6.3%)等の錐体外路障害があらわれることがある。[8.2参照]
11.1.4 下痢、軟便
下痢、軟便(いずれも6.3%)があらわれることがあり重症化する可能性がある。
11.1.5 結晶尿
本剤を成分とする結晶尿があらわれ、排尿障害、血尿(いずれも頻度不明)の症状があらわれることがある。結晶尿があらわれた場合には、十分な水分摂取を指示するとともに、本剤の減量、休薬又は投与中止等を考慮すること。[8.3参照]
11.2 その他の副作用
| 10%以上 | 10%未満 | 頻度不明 | |
| 血液及びリンパ系障害 | 貧血 | 好酸球増加症、血小板減少症、血小板増加症 | |
| 心臓障害 | 徐脈 | ||
| 胃腸障害 | 嘔吐 | 悪心、腹痛、唾液欠乏、口内乾燥 | |
| 全身障害 | 発熱 | 末梢性浮腫 | |
| 代謝及び栄養障害 | 食欲減退、アシドーシス、低カリウム血症 | ||
| 神経系障害 | 体位性めまい、浮動性めまい | 過覚醒、頭痛 | |
| 呼吸器、胸郭及び縦隔障害 | 鼻閉、咽頭浮腫 | ||
| 皮膚及び皮下組織障害 | 蕁麻疹 | ||
| 血管障害 | 高血圧クリーゼ、起立性低血圧 | ||
| その他 | 乳房腫脹、乳汁漏出症、勃起不全、射精不能 | ||
| 臨床検査 | 体重増加 | 血中CK増加、血中コレステロール増加、血中トリグリセリド増加、尿中蛋白陽性、血圧低下 | AST増加 |
12. 臨床検査結果に及ぼす影響
12.1 本剤のカテコールアミン合成阻害作用による代謝経路の変化により、血漿中のドーパミンはほとんど変化しないが、尿中のドーパミンの高値が認められることがある1)。
15. その他の注意
15.2 非臨床試験に基づく情報
本剤のがん原性試験は実施されていない。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人の健康成人に本剤250、500又は1,000mgを空腹時単回経口投与注)したときの血漿中濃度推移及び薬物動態パラメータを以下に示す。250〜1,000mgの投与量範囲においてTmax及びT1/2はいずれの投与量でも同程度であり、Cmax及びAUC0-∞は用量比未満の増加であった4)。
| 投与量 | Cmax(ng/mL) | Tmax(hr) | AUC0-36hr(ng・hr/mL) | AUC0-∞(ng・hr/mL) | T1/2(hr) | CL/F(L/hr) |
| 250mg (n=6) | 11300±1610 | 1.25(0.667,2.00) | 57600±9170 | 60100±9930 | 8.71±0.797 | 4.26±0.680 |
| 500mg (n=6) | 17100±2570 | 2.00(1.50,3.00) | 99300±9420 | 104000±10400 | 9.07±0.367 | 4.84±0.440 |
| 1000mg (n=6) | 30700±4900 | 1.50(1.00,2.00) | 169000±32300 | 179000±35800 | 9.76±1.19 | 5.77±1.16 |
16.1.2 反復投与
健康成人6例に本剤1,000mgを1日1回4日間空腹時反復経口投与注)したときの血漿中濃度は投与3日目までに定常状態に達した5)(外国人データ)。
16.1.3 褐色細胞腫患者
日本人の正常腎機能(eGFR≧90mL/分)、軽度腎機能障害(eGFR≧60mL/分、<90mL/分)又は中等度腎機能障害(eGFR≧30mL/分、<60mL/分)を有する褐色細胞腫患者に本剤250mgを単回経口投与注)したときの薬物動態パラメータ、本剤投与1〜3日目に1日500mg、4〜6日目に1日1,000mg(正常腎機能及び軽度腎機能障害)又は1日750mg(中等度腎機能障害)を反復経口投与した後、7日目に250mgを投与したときの薬物動態パラメータを以下に示す6)。
| 投与量 | 腎機能 | Cmax(ng/mL) | Tmax(hr) | AUC4hr(ng・hr/mL) |
| 250mg単回投与 | 正常 (n=5) | 6310±2140 | 1.00(0.667,4.00) | 13900±4600 |
| 軽度 (n=6) | 7500±2010 | 1.24(0.967,1.97) | 18500±6090 | |
| 中等度 (n=5) | 7880±1730 | 1.47(1.00,1.97) | 21000±2490 | |
| 反復投与後の250mg投与 | 正常 (n=4) | 10400±1230 | 1.00(0.700,1.03) | 26700±3920 |
| 軽度 (n=5) | 11500±1860 | 1.03(0.667,2.58) | 32400±6940 | |
| 中等度 (n=2) | 10100,14500 | 1.02,3.00 | 34600,44000 |
(注)
すべての被験者に朝投与として本剤250mgが経口投与された。
2例のデータのみ得られたパラメータに関しては個別値を示した。
16.2 吸収
16.2.1 食事の影響
健康成人4例に本剤500mgを空腹及び食後条件下で単回経口投与したとき、空腹時投与と比較して食後投与でTmaxが約1時間遅延した。食後投与に対する空腹時投与の幾何平均値の比(90%信頼区間)は、Cmax、AUClast及びAUC0-∞でそれぞれ114.55(85.69〜153.13)、102.34(84.42〜124.06)及び98.23(87.62〜110.13)%であった。食事の摂取は本剤の薬物動態に顕著な影響を及ぼさなかった5)(外国人データ)。
16.3 分布
メチロシン(150〜1,500μmol/L)のヒト血漿中蛋白結合率は0.5〜1.2%であった(in vitro)。
16.4 代謝
本剤はほとんど代謝を受けない7)。
16.5 排泄
日本人の健康成人18例に本剤を250〜1,000mgの用量で単回経口投与注)したとき、投与後36時間までに投与量の73.9〜91.2%が尿中に未変化体として排泄された4)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
日本人の腎機能障害男性又は腎機能正常男性に本剤250mgを空腹時単回経口投与注)したときの、腎機能正常男性に対する軽度腎機能障害男性及び中等度腎機能障害男性の薬物動態パラメータ(Cmax、AUC0-∞及びT1/2)の幾何平均値の比(90%信頼区間)を以下に示す。腎機能正常男性に比べて中等度腎機能障害男性では曝露量が上昇した4)。[7.4、8.6、9.2.2参照]
| n | Cmax(ng/mL) | AUC0-∞(ng・hr/mL) | T1/2(hr) | |
| 軽度/正常 | 6/6 | 0.90(0.66,1.23) | 1.00(0.82,1.21) | 1.04(0.95,1.13) |
| 中等度/正常 | 6/6 | 1.14(0.84,1.55) | 1.40(1.15,1.70) | 1.23(1.13,1.34) |
注)本剤の承認された用法及び用量は「通常、成人及び12歳以上の小児にはメチロシンとして1日500mgから経口投与を開始する。」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第I/II相試験
成人及び12歳以上の小児で、交感神経受容体遮断薬の治療の効果が不十分な褐色細胞腫患者16例を対象に、本剤を12週間又は手術実施の前日まで投与した。なお、本剤の投与開始時には全ての患者でα1遮断薬が投与されていた。主要評価項目である24時間蓄尿における尿中メタネフリン又はノルメタネフリンがベースラインから50%以上減少した患者割合は5/16例(31.3%)であり、その内訳は、慢性例として12週間投与した患者では3/13例(23.1%)、手術例として手術前日まで投与した患者では2/3例(66.7%)であった。12週間又は手術前日まで投与したときの尿中のメタネフリン、ノルメタネフリンのベースライン及び最終評価時の値、並びにベースラインからの変化率は以下のとおりであった。また、安全性評価対象となった16例中16例(100%)に副作用(臨床検査値の異常を含む)が認められた。主な副作用は、傾眠13例(81.3%)、鎮静2例(12.5%)、嘔吐2例(12.5%)、体重増加2例(12.5%)であった6)8)。
| 全例 | 慢性例 | 手術例 | |
| 尿中メタネフリン(平均値±標準偏差、mg/日) | |||
| ベースライン | 4.21±12.8 (16例) | 4.56±14.3 (13例) | 2.71±3.17 (3例) |
| 最終評価時 | 0.457±0.641 (12例) | 0.264±0.339 (9例) | 1.03±1.07 (3例) |
| 尿中メタネフリンの変化率(%) | |||
| 平均値±標準偏差 | −46.8±24.3 (12例) | −47.0±25.8 (9例) | −46.1±24.4 (3例) |
| 中央値 | −52.4 (12例) | −51.5 (9例) | −54.9 (3例) |
| 最小〜最大 | −76.5〜10.0 | −76.5〜10.0 | −64.8〜−18.5 |
| 尿中ノルメタネフリン(平均値±標準偏差、mg/日) | |||
| ベースライン | 16.4±29.9 (16例) | 19.9±32.4 (13例) | 1.02±0.701 (3例) |
| 最終評価時 | 9.38±22.3 (12例) | 12.3±25.4 (9例) | 0.477±0.282 (3例) |
| 尿中ノルメタネフリンの変化率(%) | |||
| 平均値±標準偏差 | −42.3±17.5 (12例) | −39.1±17.6 (9例) | −52.0±16.2 (3例) |
| 中央値 | −40.3 (12例) | −36.3 (9例) | −60.3 (3例) |
| 最小〜最大 | −66.3〜−18.3 | −66.3〜−18.3 | −62.5〜−33.3 |
18. 薬効薬理
18.1 作用機序
18.2 薬理作用
19. 有効成分に関する理化学的知見
19.1. メチロシン
20. 取扱い上の注意
無包装状態の本剤を高温・高湿度(30℃/75%)の条件下で保存したとき、外観変化が認められているので、開封後は高温、多湿を避けて保存すること。
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
22. 包装
28カプセル[瓶、バラ]
23. 主要文献
- Kuchel O.et al., J.Lab.Clin.Med., 115, 449-453, (1990)
- Engelman K.et al., Circulation Research, 18, I-104-I-109, (1966)
- Pyorala K.et al., Ann.Med.Int.fenn., 57, 65-73, (1968)
- 小野薬品工業:国内第I相試験成績(社内資料;2019年1月8日承認、CTD2.7.6.1)
- 小野薬品工業:海外第I相試験成績(社内資料;2019年1月8日承認、CTD2.7.6.2)
- 小野薬品工業:国内第I/II相試験成績(社内資料;2019年1月8日承認、CTD2.7.6.3)
- Engelman K.et al., J.Clin.Invest., 47, 568-576, (1968)
- Naruse M.et al., Endocr.J., 65, 359-371, (2018)
- 小野薬品工業:メチロシンのチロシン水酸化酵素阻害(社内資料;2019年1月8日承認、CTD2.6.2.2)
- 小野薬品工業:メチロシンのin vivoカテコールアミン含量減少作用(社内資料;2019年1月8日承認、CTD2.6.2.2)
- 小野薬品工業:メチロシンの循環器に対する作用(社内資料;2019年1月8日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
小野薬品工業株式会社
くすり相談室
〒541-8564
大阪市中央区久太郎町1丁目8番2号
電話:0120-626-190
製品情報問い合わせ先
小野薬品工業株式会社
くすり相談室
〒541-8564
大阪市中央区久太郎町1丁目8番2号
電話:0120-626-190
26. 製造販売業者等
26.1 製造販売
小野薬品工業株式会社
大阪市中央区久太郎町1丁目8番2号