医薬品情報
| 総称名 | ビムパット |
|---|---|
| 一般名 | ラコサミド |
| 欧文一般名 | Lacosamide |
| 製剤名 | ラコサミドドライシロップ |
| 薬効分類名 | 抗てんかん剤 |
| 薬効分類番号 | 1139 |
| ATCコード | N03AX18 |
| KEGG DRUG |
D07299
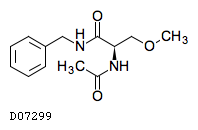
ラコサミド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2020年11月 改訂(第4版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ビムパットドライシロップ10% | VIMPAT DRY SYRUP 10% | ユーシービージャパン | 1139015R1023 | 391円/g | 劇薬, 処方箋医薬品注) |
2. 禁忌
4. 効能または効果
○てんかん患者の部分発作(二次性全般化発作を含む)
○他の抗てんかん薬で十分な効果が認められないてんかん患者の強直間代発作に対する抗てんかん薬との併用療法
6. 用法及び用量
成人
通常、成人にはラコサミドとして1日100mg(ドライシロップとして1g)より投与を開始し、その後1週間以上の間隔をあけて増量し、維持用量を1日200mg(ドライシロップとして2g)とするが、いずれも1日2回に分けて用時懸濁して経口投与する。なお、症状により1日400mg(ドライシロップとして4g)を超えない範囲で適宜増減するが、増量は1週間以上の間隔をあけて1日用量として100mg(ドライシロップとして1g)以下ずつ行うこと。
小児
通常、4歳以上の小児にはラコサミドとして1日2mg/kg(ドライシロップとして20mg/kg)より投与を開始し、その後1週間以上の間隔をあけて1日用量として2mg/kg(ドライシロップとして20mg/kg)ずつ増量し、維持用量を体重30kg未満の小児には1日6mg/kg(ドライシロップとして60mg/kg)、体重30kg以上50kg未満の小児には1日4mg/kg(ドライシロップとして40mg/kg)とする。いずれも1日2回に分けて用時懸濁して経口投与する。なお、症状により体重30kg未満の小児には1日12mg/kg(ドライシロップとして120mg/kg)、体重30kg以上50kg未満の小児には1日8mg/kg(ドライシロップとして80mg/kg)を超えない範囲で適宜増減するが、増量は1週間以上の間隔をあけて1日用量として2mg/kg(ドライシロップとして20mg/kg)以下ずつ行うこと。ただし、体重50kg以上の小児では、成人と同じ用法・用量を用いること。
7. 用法及び用量に関連する注意
<効能共通>
7.1 クレアチニンクリアランスが30mL/min以下の重度及び末期腎機能障害のある患者には、成人は1日最高用量を300mg、小児は1日最高用量を25%減量とするなど慎重に投与すること。また、血液透析を受けている患者では、1日用量に加えて、血液透析後に最大で1回用量の半量の追加投与を考慮すること。[9.2.1、9.2.2、16.1.2、16.6.1、16.6.2参照]
7.2 軽度又は中等度の肝機能障害のある患者(Child-Pugh分類A及びB)には、成人は1日最高用量を300mg、小児は1日最高用量を25%減量とするなど慎重に投与すること。[9.3.2、16.6.3参照]
7.3 本剤の1日最高用量は体重30kg未満の小児では1日12mg/kg、体重30kg以上50kg未満の小児では1日8mg/kgである。本剤を1日8mg/kgを超えて投与している体重30kg未満の小児が、成長に伴い安定的に体重が30kg以上となった場合には、患者の状態を十分に観察し、効果及び副作用の発現を考慮したうえで、適切な用量を検討すること。なお、急激な減量は避けること。
<強直間代発作>
7.4 本剤を強直間代発作に対して使用する場合には、他の抗てんかん薬と併用すること。[臨床試験において、強直間代発作に対する本剤単独投与での使用経験はない。]
8. 重要な基本的注意
8.1 連用中における投与量の急激な減量ないし投与中止により、てんかん発作の増悪又はてんかん重積状態があらわれることがあるので、投与を中止する場合には、少なくとも1週間以上かけて徐々に減量するなど慎重に行うこと。
8.2 浮動性めまい、霧視、眠気、注意力・集中力・反射運動能力等の低下が起こることがあるので、本剤投与中の患者には自動車の運転等、危険を伴う機械の操作に従事させないよう注意すること。
8.3 PR間隔の延長があらわれることがあるので、本剤の投与中は第二度以上の房室ブロック等に関連する症状(頻脈、脈拍数減少、脈拍不整、頭部ふらふら感、失神、動悸、息切れ等)の発現に注意すること。本剤の投与中にそのような症状があらわれた場合には、医師の診察を受けるよう患者及びその家族等に指導すること。心伝導障害や重度の心疾患(心筋梗塞又は心不全等)の既往のある患者、ナトリウムチャネル異常(ブルガダ症候群等)のある患者、PR間隔の延長を起こすおそれのある薬剤を併用している患者等では、本剤投与開始時及び本剤投与中は心電図検査を行うなど、患者の状態及び病態の変化を注意深く観察すること。[9.1.1、10.2、11.1.1参照]
8.6 複視、霧視等の眼障害が生じる可能性があるので、診察時に、眼障害について問診を行う等注意し、異常が認められた場合には適切な処置を行うこと。[15.2.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心伝導障害や重度の心疾患(心筋梗塞又は心不全等)の既往のある患者、ナトリウムチャネル異常(ブルガダ症候群等)のある患者
9.2 腎機能障害患者
9.3 肝機能障害患者
9.3.1 重度の肝機能障害のある患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
ラットにおいて胎児移行性が認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
ヒト乳汁中へ移行することが報告されている。
9.7 小児等
9.7.1 低出生体重児、新生児、乳児又は4歳未満の幼児に対する臨床試験は実施していない。
9.7.2 小児患者の部分発作に対する単剤療法に関する臨床試験は国内・海外ともに行われていない。
9.8 高齢者
一般に高齢者では生理機能が低下している。[16.6.4参照]
10. 相互作用
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 房室ブロック、徐脈、失神(いずれも1%未満)
11.1.2 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
発熱、紅斑、水疱・びらん、そう痒、咽頭痛、眼充血、口内炎等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.3 薬剤性過敏症症候群(頻度不明)
初期症状として発疹、発熱がみられ、更に肝機能障害、リンパ節腫脹、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。なお、ヒトヘルペスウイルス6(HHV-6)等のウイルスの再活性化を伴うことが多く、投与中止後も発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること1)。
11.1.4 無顆粒球症(頻度不明)
11.2 その他の副作用
| 3%以上 | 1〜3%未満 | 1%未満 | 頻度不明 | |
| 精神神経系 | 浮動性めまい(17.8%)、頭痛、傾眠 | 記憶障害、振戦、運動失調 | うつ病、幻覚、攻撃性、激越、感覚鈍麻、錯感覚、認知障害、異常行動、錯乱状態、注意力障害、平衡障害、不眠症、眼振、構語障害、嗜眠、協調運動異常、ミオクローヌス性てんかん | 精神病性障害、多幸気分 |
| 眼 | 複視、霧視 | |||
| 血液 | 白血球数減少 | |||
| 消化器 | 悪心、嘔吐 | 下痢 | 消化不良、口内乾燥、鼓腸、便秘 | |
| 循環器 | 心房細動 | 心房粗動 | ||
| 肝臓 | 肝機能異常 | |||
| 代謝及び栄養 | 食欲減退 | |||
| 皮膚 | 発疹、蕁麻疹、そう痒症 | 血管浮腫 | ||
| 免疫系 | 薬物過敏症 | |||
| 筋骨格系 | 筋痙縮 | |||
| 感覚器 | 回転性めまい | 耳鳴 | ||
| その他 | 疲労 | 歩行障害、易刺激性 | 転倒、挫傷、裂傷、鼻咽頭炎、発熱、無力症、酩酊感 | 咽頭炎 |
13. 過量投与
13.1 症状
過量投与(最大12000mg)により認められた主な症状は、浮動性めまい、悪心、発作(全般性強直間代発作、てんかん重積状態)、心伝導障害、ショック及び昏睡であった。また、ラコサミド7000mgを一度に服用した例で死亡が報告されている。
13.2 処置
本剤は血液透析により除去可能であり、発現している症状の程度に応じて血液透析の実施を考慮すること。[16.6.2参照]
15. その他の注意
15.1 臨床使用に基づく情報
15.2 非臨床試験に基づく情報
15.2.1 非臨床薬物動態試験において、ラコサミドはラットの水晶体に投与後35日目まで分布したが、ラットの26週間及び104週間反復投与毒性試験で眼に異常は認められず、イヌの52週間反復投与毒性試験において水晶体の変化は認められなかった。複視、霧視等の眼に関する副作用の発現率はプラセボ群より高く、16週間投与の日中共同第III相試験のプラセボ群では1.6%に対し、本剤200mg/日群で4.9%、400mg/日群で12.2%、長期投与では5.5%であり、海外第III相試験(併合成績)のプラセボ群では4.4%に対し、本剤200mg/日群で8.9%、400mg/日群で18.0%、600mg/日群で30.5%であった。[8.6参照]
15.2.2 欠神発作モデルであるWAG/Rijラット(3、10及び30mg/kgを腹腔内投与)及びストラスブール遺伝性欠神てんかんラット(15.6及び31.2mg/kgを腹腔内投与)において、欠神発作の増悪が認められた。
16. 薬物動態
16.1 血中濃度
16.1.1 成人
(1)単回投与
健康成人男性18例にラコサミド100、200、400mgを空腹時に単回経口投与したとき、投与後0.5〜4時間でCmaxに達し、t1/2は約14時間であった。AUC及びCmaxは投与量に比例して増加した2)。
| 投与量 | 100mg | 200mg | 400mg |
| 例数 | 12 | 11 | 12 |
| AUC0-∞(μg・h/mL) | 57.0[20.4] | 116.4[18.2] | 219.1[16.1] |
| AUC0-t(μg・h/mL) | 55.0[18.7] | 112.1[17.1] | 212.5[15.0] |
| Cmax(μg/mL) | 2.96[15.2] | 5.84[25.0] | 11.8[15.4] |
| tmax(h) | 1.00(0.50-4.00) | 1.00(0.25-1.50) | 1.00(0.50-4.00) |
| t1/2(h) | 14.0[20.2] | 14.6[13.0] | 13.7[15.3] |
| CL/F(L/h) | 1.75[20.4] | 1.72[18.2] | 1.83[16.1] |
| Vd/F(L) | 35.5[13.4] | 36.3[13.0] | 36.2[12.8] |
(2)反復投与
健康成人男性5例にラコサミド200mg/回を1日2回7日間反復経口投与したとき、血漿中ラコサミド濃度は投与開始から3日後に定常状態に到達した。AUC0-12hの累積係数は2.4であった3)(外国人データ)。
16.1.2 小児
非盲検3試験及び二重盲検1試験において6ヵ月注1)から17歳までの小児てんかん患者414例(日本人46例を含む)から得られた血漿中ラコサミド濃度を用いて母集団薬物動態解析を行い、小児におけるラコサミドの薬物動態パラメータを推定した。本解析におけるラコサミドの投与量は2〜18mg/kg/日を1日2回投与(体重50kg以上の小児での最高用量は600mg/日注2))であった。見かけの分布容積(Vd/F)は0.71L/kg、見かけの全身クリアランス(CL/F)は体重及び年齢に依存し、体重15kgの4歳児で0.88L/h(0.058L/h/kg)、体重25kgの8歳児で1.18L/h(0.047L/h/kg)、体重40kgの12歳児で1.60L/h(0.040L/h/kg)、体重50kgの16歳児で1.83L/h(0.037L/h/kg)と推定された4)。[7.1参照]
注1)本剤は4歳以上の小児に対して適用を有している。
注2)本剤の承認された1日最高用量は、成人及び体重50kg以上の小児には400mg、体重30kg以上50kg未満の小児には8mg/kg、体重30kg未満の小児には12mg/kgである。
16.1.3 生物学的同等性
健康成人男性24例にラコサミド100mg(ドライシロップ10%を1g又は100mg錠を1錠)を空腹時単回投与したとき、ラコサミドの血漿中濃度推移及び薬物動態パラメータは以下のとおりであった。ドライシロップ10%と100mg錠の生物学的同等性が確認された5)。
| 薬物動態パラメータ | ドライシロップ10%(例数=24) | 100mg錠(例数=24) | 幾何平均の比a)(90%信頼区間) |
| Cmax(μg/mL) | 4.46[23.5] | 4.24[29.5] | 1.05(0.93-1.19) |
| AUC0-t(μg・h/mL) | 56.2[14.7] | 56.0[15.7] | 1.00(0.99-1.02) |
| tmax(h) | 0.25(0.25-0.75) | 0.50(0.25-3.00) | − |
16.2 吸収
16.2.1 食事の影響
健康成人男性24例にラコサミド300mgを空腹時又は食後に単回経口投与したとき、食事はラコサミドのAUC0-t及びCmaxに影響を及ぼさなかった6)(外国人データ)。
16.2.2 バイオアベイラビリティ
健康成人24例にラコサミド200mgを30及び60分間で単回点滴静脈内投与又は単回経口投与したとき、ラコサミドのAUC0-t及びCmaxは同程度であり、ラコサミド錠の絶対バイオアベイラビリティはほぼ100%であった7)。
16.3 分布
健康成人24例にラコサミド200mgを30分間で単回点滴静脈内投与したとき、分布容積(Vd)は31.1Lであり、ラコサミド200mgを単回経口投与したとき、見かけの分布容積(Vd/F)は32.8Lであった。
in vitro(ラコサミド1.5〜60μg/mL)及びex vivo(ラコサミド0.7〜5.5μg/mL)試験の結果、ラコサミドの血漿蛋白結合率は15%未満であった7)。
16.4 代謝
ラコサミドは腎排泄及び代謝により体内から消失した。
in vitro試験の結果、薬理学的に不活性な主代謝物であるO-脱メチル体生成に主に寄与するCYP分子種は、CYP3A4、CYP2C9及びCYP2C19であった。
16.5 排泄
16.5.1 健康成人男性各5例に[14C]-ラコサミド100mg(40μCi)を単回経口投与及び1時間で単回点滴静脈内投与したとき、投与後168時間までに、尿中に投与量の94%及び97%が排泄され、糞中への排泄は0.5%未満であった。尿中へはラコサミド(約30〜40%)、O-脱メチル体(約30%)、極性画分(約20%)及び他の微量な代謝物(0.5〜2%)として排泄された8)(外国人データ)。
16.5.2 健康成人男性にラコサミド100〜400mgを単回経口投与したとき、投与72時間後までの尿中排泄率は、ラコサミド29〜33%、O-脱メチル体10〜15%であった。血漿中O-脱メチル体のAUC0-tは血漿中ラコサミドの約10%であった2)。
16.5.3 健康成人にラコサミド200mgを30分間で単回点滴静脈内投与したとき、全身クリアランス(CL)は1.78L/hであり、ラコサミド200mgを単回経口投与したとき、見かけの全身クリアランス(CL/F)は1.84L/hであった7)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能の程度の異なる成人被験者にラコサミド100mgを単回経口投与したとき、AUC0-tは腎機能正常者(CLCR:≧80mL/min)と比較して、軽度低下者(CLCR:50〜<80mL/min)では27%、中等度低下者(CLCR:30〜<50mL/min)で22%、重度低下者(CLCR:<30mL/min)で59%高く、Cmaxは軽度から重度の腎機能低下者で10〜14%高かった。軽度から重度の腎機能低下者におけるO-脱メチル体のAUC0-tは腎機能正常者の1.5〜4.6倍であった9)(外国人データ)。[7.1、9.2.1参照]
| 腎機能 | 正常 | 軽度低下 | 中等度低下 | 重度低下 |
| 例数 | 8 | 8 | 8 | 8 |
| CLCR(mL/min) | ≧80 | 50〜<80 | 30〜<50 | <30 |
| AUC0-t(μg・h/mL) | 47.0[20.8] | 59.6[17.5] | 57.6[19.0] | 74.8[26.9] |
| Cmax(μg/mL) | 2.69[35.0] | 2.95[20.7] | 3.06[10.0] | 3.02[23.3] |
| tmax(h) | 1.0(0.5-2.0) | 0.5(0.5-1.0) | 0.5(0.5-1.0) | 1.0(0.5-1.5) |
| t1/2(h) | 13.2[17.6] | 18.2[18.7] | 15.4[18.9] | 18.3[27.8] |
| CL/F(L/h) | 2.13[20.8] | 1.68[17.5] | 1.74[19.0] | 1.34[26.9] |
| CLR(L/h) | 0.590[37.9] | 0.354[51.3] | 0.277a)[24.4] | 0.143[31.8] |
16.6.2 血液透析を受けている末期腎機能障害患者
血液透析を受けている末期腎機能障害の成人被験者に、非透析時及び透析開始2.5時間前にラコサミド100mgを単回経口投与したとき、非透析時に比べ4時間の透析実施時ではラコサミドのAUC0-tは46%減少し、透析による除去効率はラコサミド57%、O-脱メチル体53%であり、透析クリアランスはラコサミド140mL/min(8.40L/h)、O-脱メチル体149mL/min(8.94L/h)であった9)(外国人データ)。[7.1、9.2.2、13.2参照]
| 血液透析 | 非透析時 | 4時間透析時 |
| 例数 | 8 | 8 |
| ラコサミド | ||
| AUC0-t(μg・h/mL) | 43.2[20.2] | 23.2[15.1] |
| Cmax(μg/mL) | 3.18[22.4] | 2.79[22.1] |
| tmax(h) | 0.50(0.5-4.0) | 0.75(0.5-2.0) |
| t1/2(h) | 19.5[19.4] | 19.2[26.8] |
| O-脱メチル体 | ||
| AUC0-t(μg・h/mL) | 6.63[74.3] | 3.43[68.5] |
| Cmax(μg/mL) | 0.48[69.5] | 0.22[69.1] |
16.6.3 肝機能障害患者
肝機能が中等度に低下した成人(Child-Pugh分類B)にラコサミド100mg/回を1日2回5日間反復経口投与したとき、健康成人に比べてラコサミドの定常状態のAUC0-12h及びCmaxはそれぞれ61%及び50%高かった。また、体重で基準化した定常状態のAUC0-12h及びCmaxはそれぞれ47%及び37%高かった。重度肝機能障害患者(Child-Pugh分類C)での薬物動態は検討していない10)(外国人データ)。[2.2、7.2、9.3.1、9.3.2参照]
| 肝機能 | 正常 | Child-Pugh分類B |
| 例数 | 8 | 8 |
| AUC0-12h(μg・h/mL) | 53.3[17.3] | 85.9[21.7] |
| Cmax(μg/mL) | 5.83[13.3] | 8.75[18.7] |
| tmax(h) | 1.5(0.5-2.0) | 1.5(0.5-2.0) |
| t1/2(h) | 14.8[19.7] | 24.1[23.5] |
16.6.4 高齢者
16.6.5 CYP2C19遺伝子多型
日本人及び中国人健康成人男性各18例を、CYP2C19遺伝子型に基づく代謝能分類により、急速代謝能者(UM:CYP2C19*1/*17)1例、高代謝能者(EM:CYP2C19*1/*1)17例、中間代謝能者(IM:CYP2C19*1/*2、CYP2C19*1/*3)10例、及び低代謝能者(PM:CYP2C19*2/*2、CYP2C19*2/*3)8例に分け、この集団にラコサミド100〜400mgを単回経口投与したとき、ラコサミドの投与量及び体重で基準化したAUC0-∞は、EMに比べてPMで24%、IMで10%高かった2)。
16.7 薬物相互作用
16.7.1 薬物相互作用試験
ラコサミドは、治療血漿中濃度域でCYP1A2、2B6、2C9、2C19及び3A4に対して誘導作用を示さず、CYP1A1、1A2、2A6、2B6、2C8、2C9、2D6、2E1、3A4及び3A5に対して阻害作用を示さなかったが、CYP2C19に対する阻害作用が示唆された。
ラコサミドは、P-糖蛋白質の典型的な基質ではなく、P-糖蛋白質に対して阻害作用を示さなかった(in vitro)。
16.7.2 臨床薬物相互作用試験
(1)カルバマゼピン
健康成人男性19例に、ラコサミド(200mg/回、1日2回)の定常状態において、強いCYP3A誘導薬及び中程度のCYP2C9誘導薬であるカルバマゼピン(200mg/回、1日2回)を併用反復経口投与したとき、カルバマゼピンはラコサミドの定常状態のAUC0-12h及びCmaxに影響を及ぼさなかった。健康成人男性18例に、カルバマゼピン(200mg/回、1日2回)の定常状態において、ラコサミド(200mg/回、1日2回)を併用反復経口投与したとき、ラコサミドはカルバマゼピンの定常状態のAUC0-12h及びCmaxに影響を及ぼさなかった12)(外国人データ)。
(2)オメプラゾール
健康成人男性34例に、ラコサミド(300mg)の単回経口投与において、弱いCYP2C19阻害薬であるオメプラゾール(40mg/回、1日1回)を併用反復経口投与したとき、オメプラゾールはラコサミドのAUC0-t及びCmaxに影響を及ぼさなかった。CYP2C19基質であるオメプラゾール(40mg)の単回経口投与において、ラコサミド(300mg/回、1日2回)を併用反復経口投与したとき、ラコサミドはオメプラゾールのAUC0-t及びCmaxに影響を及ぼさなかった13)(外国人データ)。
(3)ミダゾラム
健康成人男性33例に、CYP3A基質であるミダゾラム(7.5mg)の単回経口投与において、ラコサミド(200mg/回、1日2回)を併用反復経口投与したとき、ラコサミドはミダゾラムのCmaxを30%増加させたがAUC0-tに影響を及ぼさなかった14)(外国人データ)。
(4)ワルファリン
健康成人男性16例に、S-ワルファリンがCYP2C9基質であるワルファリン(25mg)の単回経口投与において、ラコサミド(200mg/回、1日2回)を併用反復経口投与したとき、ラコサミドはS及びR-ワルファリンのAUC0-t及びCmaxに影響を及ぼさず、プロトロンビン時間及びプロトロンビン時間の国際標準比(INR)の最大値及びAUC0-168hに影響を及ぼさなかった15)(外国人データ)。
16.7.3 母集団薬物動態解析
17. 臨床成績
17.1 有効性及び安全性に関する試験
<部分発作(二次性全般化発作を含む)>
17.1.1 国際共同第III相試験(単剤療法、成人)
新規に又は最近てんかんと診断された部分発作(二次性全般化発作を含む)又は未分類の全般性強直間代発作を有する16歳以上の患者を対象として、本剤200〜600mg/日注1)又はカルバマゼピン徐放錠(CBZ-CR)400〜1200mg/日注2)を単剤にて経口投与したとき、主要評価項目であるKaplan-Meier法により推定した最終評価用量における6ヵ月間発作消失率は下表のとおりであり、群間差の95%信頼区間の下限値は予め設定された非劣性限界値(−12%)を上回ったこと、CBZ-CR群の6ヵ月間発作消失率に対する群間差の95%信頼区間の下限値の比(相対差)は予め、設定した非劣性限界値(−20%)を上回ったことから、CBZ-CRに対する本剤の非劣性が確認された17)。
| 解析対象集団 | 投与群 | 例数 | 発作が消失した患者数(割合(%)) | 発作消失率(%)[95%信頼区間]a) | 群間差(%)[95%信頼区間]a)b) | 相対差(%)c) |
| FASd) | 本剤群 | 444f) | 327(73.6) | 89.8[86.8,92.8] | −1.3[−5.5,2.8] | −6.0 |
| CBZ-CR群 | 442g) | 308(69.7) | 91.1[88.2,94.0] | |||
| PPSe) | 本剤群 | 408h) | 307(75.2) | 91.5[88.6,94.3] | −1.3[−5.3,2.7] | −5.7 |
| CBZ-CR群 | 397i) | 285(71.8) | 92.8[90.0,95.5] |
なお、事後解析結果による本剤群で400mg/日超への増量が必要となった患者を効果不十分例として扱った場合のFASにおける発作が消失した患者数(割合(%))は308注3)/444例(69.4%)であり、Kaplan-Meier法により推定した発作消失率[95%信頼区間]は84.1%[80.5,87.6]であった。
副作用発現頻度は、本剤群で37.2%(165/444例)であった。主な副作用は、浮動性めまい7.9%(35/444例)、疲労5.6%(25/444例)、傾眠4.5%(20/444例)であった。
副作用発現頻度は、本剤群で37.2%(165/444例)であった。主な副作用は、浮動性めまい7.9%(35/444例)、疲労5.6%(25/444例)、傾眠4.5%(20/444例)であった。
注1)本剤の承認された1日最高用量は400mgである。
注2)カルバマゼピン徐放錠は本邦では承認されていない。
注3)200〜400mg/日投与で発作が消失した患者数。
17.1.2 国内第III相試験(単剤療法、成人)
1剤の既存の抗てんかん薬を投与している16歳以上の部分発作を有するてんかん患者を対象として、本剤200〜600mg/日注4)経口投与による単剤療法へ切り替えたとき、6ヵ月間発作消失患者の割合は46.2%(6/13例)であった。なお、事後解析として400mg/日超への増量が必要となった患者を効果不十分例として扱った場合の、6ヵ月間発作消失患者の割合は30.8%(4/13例)であった18)。
副作用発現頻度は、84.2%(16/19例)であった。主な副作用は、浮動性めまい42.1%(8/19例)、傾眠31.6%(6/19例)、回転性めまい、悪心が各10.5%(2/19例)であった。
副作用発現頻度は、84.2%(16/19例)であった。主な副作用は、浮動性めまい42.1%(8/19例)、傾眠31.6%(6/19例)、回転性めまい、悪心が各10.5%(2/19例)であった。
注4)本剤の承認された1日最高用量は400mgである。
17.1.3 国際共同第III相試験(併用療法、成人)
既存の抗てんかん薬で十分な発作抑制効果が得られない部分発作を有する16歳以上の日本人及び中国人のてんかん患者547例(日本人患者142例を含む)を対象として、本剤200、400mg/日又はプラセボを16週間経口投与(既存の抗てんかん薬1〜3剤との併用)したとき、主要評価項目である観察期間に対する維持期間の28日あたりの部分発作回数変化量は下表のとおりであり、プラセボ群と本剤200mg/日及び400mg/日群との間で統計学的に有意な差が認められた。なお、各群における50%レスポンダーレート(28日あたりの部分発作回数が観察期間と比べて50%以上改善した患者の割合)は、プラセボ群19.7%(36/183例)、本剤200mg/日群38.5%(70/182例)及び本剤400mg/日群49.2%(88/179例)であった19)。
| 例数a) | 28日あたりの部分発作回数の変化量b) | p値c) | プラセボ群に対する減少率d)[95%信頼区間] | |
| プラセボ群 | 183 | −1.22 | / | / |
| 200mg/日群 | 182 | −3.33 | <0.001 | 29.4[18.7,38.7] |
| 400mg/日群 | 179 | −4.50 | <0.001 | 39.6[30.5,47.6] |
副作用発現頻度は、本剤群で47.7%(173/363例)であった。主な副作用は、浮動性めまい22.9%(83/363例)、傾眠8.8%(32/363例)、複視4.4%(16/363例)であった。
17.1.4 国際共同長期継続投与試験(成人)
国際共同第III相試験(併用療法)を完了した日本及び中国の患者473例(日本人患者123例を含む)を対象として、本剤100〜400mg/日を1日2回に分けて経口投与したとき(中間報告、最長767日投与)、先行試験の観察期間からの28日あたりの部分発作回数減少率の中央値は55.23%、50%レスポンダーレートは56.3%(265/471例)であった20)。
副作用発現頻度は、本剤群で42.9%(203/473例)であった。主な副作用は、浮動性めまい17.8%(84/473例)、傾眠5.7%(27/473例)、頭痛3.8%(18/473例)であった。
副作用発現頻度は、本剤群で42.9%(203/473例)であった。主な副作用は、浮動性めまい17.8%(84/473例)、傾眠5.7%(27/473例)、頭痛3.8%(18/473例)であった。
17.1.5 海外第III相試験(小児)
既存の抗てんかん薬で十分な発作抑制効果が得られない部分発作を有する4歳以上17歳未満の小児てんかん患者343例を対象として、本剤(体重30kg未満の患者は8〜12mg/kg/日、体重30〜50kg未満の患者は6〜8mg/kg/日、体重50kg以上の患者は300〜400mg/日)又はプラセボを16週間経口投与(既存の抗てんかん薬1〜3剤との併用)したとき、主要評価項目である観察期間に対する維持期間の28日あたりの部分発作回数変化量は下表のとおりであり、プラセボ群と本剤群との間で統計学的に有意な差が認められた21)。
| 例数a) | 28日あたりの部分発作回数の変化量b) | p値c) | プラセボ群に対する減少率d)[95%信頼区間] | |
| プラセボ群 | 170 | −1.55 | / | / |
| 本剤群 | 170 | −3.05 | 0.0003 | 31.72[16.342,44.277] |
副作用発現頻度は、本剤群で33.9%(58/171例)であった。主な副作用は、傾眠14.0%(24/171例)、浮動性めまい8.8%(15/171)であった。
17.1.6 国際共同第II相長期継続投与試験(小児)
4歳から17歳の直接登録された小児てんかん患者136例(日本人46例、外国人90例)を対象として、本剤12mg/kg/日(体重50kg以上の患者は600mg/日注5))までを1日2回に分けて経口投与したとき、観察期間からの全治療期間における部分発作回数変化率の中央値は−52.73%(日本人で−27.63%、外国人で−60.56%)であった22)。
副作用発現頻度は、56.2%(77/137例)であった。主な副作用は、浮動性めまい20.4%(28/137例)、傾眠19.7%(27/137例)、振戦8.0%(11/137例)であった。
副作用発現頻度は、56.2%(77/137例)であった。主な副作用は、浮動性めまい20.4%(28/137例)、傾眠19.7%(27/137例)、振戦8.0%(11/137例)であった。
注5)本剤の承認された1日最高用量は、成人及び体重50kg以上の小児には400mg、体重30kg以上50kg未満の小児には8mg/kg、体重30kg未満の小児には12mg/kgである。
<強直間代発作>
17.1.7 国際共同第III相試験(成人及び小児)
既存の抗てんかん薬で十分な発作抑制効果が得られない強直間代発作を有する4歳以上のてんかん患者242例(日本人患者30例を含む)を対象として、本剤(体重30kg未満の小児患者は8〜12mg/kg/日、体重30〜50kg未満の小児患者は6〜8mg/kg/日、体重50kg以上の小児及び成人患者は300〜400mg/日)又はプラセボを最長で24週間経口投与(既存の抗てんかん薬1〜3剤との併用)したとき、主要評価項目である24週間の治療期間における2回目の強直間代発作が発現するまでの時間は下表及び下図のとおりであり、プラセボと本剤群との間で統計学的に有意な差が認められた23)。
| 投与群 | 例数a) | イベント発現までの日数(日)b)[95%信頼区間] | ハザード比c)[95%信頼区間] | p値c) |
| プラセボ群 | 121 | 77.0[49.0,128.0] | 0.540[0.377,0.774] | <0.001 |
| 本剤群 | 118 | −[144.0,−] |
治療期間における2回目の強直間代発作が発現するまでの時間のKaplan-Meier曲線
副作用発現頻度は、本剤群で46.3%(56/121例)であった。主な副作用は、浮動性めまい17.4%(21/121例)、傾眠13.2%(16/121例)、悪心7.4%(9/121例)であった。
17.1.8 国際共同長期継続投与試験(成人及び小児)
国際共同第III相試験(成人及び小児)を完了した患者及び当該試験での適格性基準のうち強直間代発作回数の基準のみを満たさなかった患者239例(日本人患者37例を含む)を対象として、本剤(体重50kg未満の小児患者は4〜12mg/kg/日、体重50kg以上の小児患者は200〜600mg/日、成人患者は200〜800mg/日注6))を1日2回に分けて経口投与したとき(中間報告、最長1416日投与)、先行試験の観察期間からの治療期間における28日あたりの強直間代発作回数変化率の中央値は−88.52%であった24)。
副作用発現頻度は、34.7%(83/239例)であった。主な副作用は、浮動性めまい10.9%(26/239例)、傾眠5.9%(14/239例)、回転性めまい及び悪心3.8%(9/239例)であった。
注6)本剤の承認された1日最高用量は、成人及び体重50kg以上の小児には400mg、体重30kg以上50kg未満の小児には8mg/kg、体重30kg未満の小児には12mg/kgである。
17.3 その他
17.3.1 心電図に対する影響
健康成人214例にラコサミド400mg/日、800mg/日注7)又はプラセボを1日2回に分けて6日間反復経口投与、又はモキシフロキサシン400mg/日を1日1回3日間反復経口投与したとき、ラコサミドはQTc間隔を延長しなかった。ラコサミド群のPR間隔の平均変化量は第6日目の投与1時間後に最大となり、プラセボ群との差は、400mg/日で7.3ms、800mg/日注7)で11.9msであった25)(外国人データ)。
注7)本剤の承認された1日最高用量は400mgである。
18. 薬効薬理
18.1 作用機序
ラコサミドは電位依存性ナトリウムチャネルの緩徐な不活性化を選択的に促進し、過興奮状態にある神経細胞膜を安定化させることによって抗けいれん作用を示すと考えられている26)。
18.2 てんかん発作に対する作用
18.3 抗てんかん原性作用
扁桃核電気刺激キンドリングラットにおいて、キンドリング形成を抑制した29)。
19. 有効成分に関する理化学的知見
19.1. ラコサミド
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
[プラスチックボトル]100g、500g
23. 主要文献
- 厚生労働省:重篤副作用疾患別対応マニュアル 薬剤性過敏症症候群
- 岡垣琢也 他, 薬理と治療, 43, 1307-1316, (2015)
- 社内資料:外国人健康成人におけるラコサミド反復投与時の薬物動態(2016年7月4日承認、CTD 2.7.6.3.3)
- 社内資料:日本人及び外国人小児患者における母集団薬物動態解析(2019年1月8日承認、CTD 2.7.2.2.3)
- 岡垣琢也 他, 薬理と治療, 46, 1331-1338, (2018)
- 社内資料:外国人健康成人におけるラコサミドの薬物動態に及ぼす食事の影響(2016年7月4日承認、CTD 2.7.6.1.1)
- 寺田清人 他, 臨床精神薬理, 21, 1223-1234, (2018)
- Cawello W,et al., Eur J Drug Metab Pharmacokinet., 37, 241-248, (2012) »PubMed »DOI
- Cawello W,et al., Clin Pharmacokinet., 52, 897-906, (2013) »PubMed »DOI
- 社内資料:外国人肝機能低下者におけるラコサミドの薬物動態(2016年7月4日承認、CTD 2.7.6.4.5)
- Schaefer C,et al., Clin Drug Investig., 35, 255-265, (2015) »PubMed »DOI
- Cawello W,et al., J Clin Pharmacol., 50, 459-471, (2010) »PubMed »DOI
- Cawello W,et al., Clin Drug Investig., 34, 317-325, (2014) »PubMed »DOI
- 社内資料:ミダゾラムとの薬物相互作用(2016年7月4日承認、CTD 2.7.6.5.9)
- Stockis A,et al., Epilepsia., 54, 1161-1166, (2013) »PubMed »DOI
- 社内資料:ラコサミドに関する母集団薬物動態解析(2016年7月4日承認、CTD 2.7.2.2.5.2)
- 社内資料:部分発作単剤療法の国際共同実薬対照試験
- 社内資料:部分発作併用療法から単剤療法への切り替え試験
- 社内資料:日本及び中国における部分発作併用療法のプラセボ対照比較試験(2016年7月4日承認、CTD 2.7.6.7.1)
- 社内資料:日本及び中国における部分発作併用療法の長期継続投与試験(2016年7月4日承認、CTD 2.7.6.8.1)
- 社内資料:小児患者を対象とした部分発作併用療法のプラセボ対照比較試験(2019年1月8日承認、CTD 2.7.6.3.1)
- 社内資料:小児患者を対象とした部分発作併用療法の長期継続投与試験(2019年1月8日承認、CTD 2.7.6.4.1)
- 社内資料:成人及び小児患者を対象とした強直間代発作併用療法の国際共同プラセボ対照試験(2020年12月25日承認、CTD 2.7.6.1.1)
- 社内資料:成人及び小児患者を対象とした強直間代発作併用療法の長期継続投与試験(2020年12月25日承認、CTD 2.7.6.2.1)
- Kropeit D,et al., Acta Neurol Scand., 132, 346-354, (2015) »PubMed
- Errington AC,et al., Mol Pharmacol., 73, 157-169, (2008) »PubMed
- 社内資料:The early evaluation of anticonvulsant drugs
- 社内資料:Effects of lacosamide on fully-kindled seizures in the mouse amygdala kindling model
- Brandt C,et al., Epilepsia., 47, 1803-1809, (2006) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
製品情報問い合わせ先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
26. 製造販売業者等
26.1 製造販売元
ユーシービージャパン株式会社
東京都新宿区西新宿8丁目17番1号
26.2 販売元
第一三共株式会社
東京都中央区日本橋本町3-5-1