医薬品情報
| 総称名 | ゴナックス |
|---|---|
| 一般名 | デガレリクス酢酸塩 |
| 欧文一般名 | Degarelix Acetate |
| 製剤名 | 注射用デガレリクス酢酸塩 |
| 薬効分類名 | GnRHアンタゴニスト(徐放性)/前立腺癌治療剤 |
| 薬効分類番号 | 2499 |
| ATCコード | L02BX02 |
| KEGG DRUG |
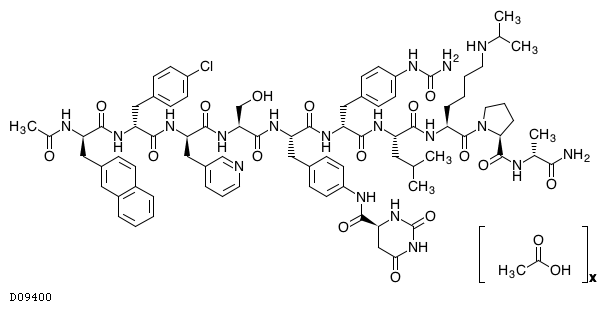
D09400
デガレリクス酢酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年11月 改訂(第3版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ゴナックス皮下注用80mg | Gonax 80mg for Subcutaneous Injection | フェリング・ファーマ | 2499412D3027 | 18174円/瓶 | 劇薬, 処方箋医薬品注) |
| ゴナックス皮下注用120mg | Gonax 120mg for Subcutaneous Injection | フェリング・ファーマ | 2499412D4023 | 21940円/瓶 | 劇薬, 処方箋医薬品注) |
| ゴナックス皮下注用240mg | Gonax 240mg for Subcutaneous Injection | フェリング・ファーマ | 2499412D5020 | 26161円/瓶 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、成人にはデガレリクスとして、初回は240mgを1カ所あたり120mgずつ腹部2カ所に皮下投与する。2回目以降は、初回投与4週間後より、維持用量を投与する。4週間間隔で投与を繰り返す場合は、デガレリクスとして80mgを維持用量とし、腹部1カ所に皮下投与する。12週間間隔で投与を繰り返す場合は、デガレリクスとして480mgを維持用量とし、1カ所あたり240mgずつ腹部2カ所に皮下投与する。
初回投与
1カ所あたり、本剤120mgバイアルに日本薬局方注射用水3.0mLを注入し、溶解後速やかに3.0mLを皮下投与する。(3.0mLで溶解することにより、40mg/mLとなる。)
維持用量を4週間間隔で投与する場合
本剤80mgバイアルに日本薬局方注射用水4.2mLを注入し、溶解後速やかに4.0mLを皮下投与する。(4.2mLで溶解することにより、20mg/mLとなる。)
維持用量を12週間間隔で投与する場合
1カ所あたり、本剤240mgバイアルに日本薬局方注射用水4.2mLを注入し、溶解後速やかに4.0mLを皮下投与する。(4.2mLで溶解することにより、60mg/mLとなる。)
7. 用法及び用量に関連する注意
7.1 本剤は投与液濃度、投与量が有効性に影響するため、調製方法を遵守すること。初回投与時は120mgバイアル2本、維持用量を4週間間隔で投与する場合は80mgバイアル1本、維持用量を12週間間隔で投与する場合は240mgバイアル2本を使用すること。[14.1.1-14.1.3参照]
7.2 維持用量として4週間間隔投与と12週間間隔投与を切り替えた際の有効性及び安全性は確立していない。
8. 重要な基本的注意
本剤は内分泌療法剤であり、がんに対する薬物療法について十分な知識・経験を持つ医師のもとで、本剤による治療が適切と判断される患者についてのみ使用すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 間質性肺疾患又はその既往歴のある患者
間質性肺疾患が発現又は増悪する可能性がある。[11.1.1参照]
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 間質性肺疾患(0.4%)[9.1.1参照]
11.1.2 肝機能障害(0.4%)
ALT、AST、γ-GTP増加等の肝機能障害があらわれることがある。
11.1.3 糖尿病増悪(0.4%)
11.1.4 ショック、アナフィラキシー(いずれも頻度不明)
11.1.5 心不全(頻度不明)
11.1.6 血栓塞栓症(頻度不明)
心筋梗塞、脳梗塞、静脈血栓症、肺塞栓症等の血栓塞栓症があらわれることがある。
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 注射部位 | 疼痛、硬結、紅斑、腫脹、そう痒感 | 熱感、発疹、小水疱、結節、内出血、変色 | 炎症、膿瘍、蜂巣炎 |
| 血液 | 貧血、ヘモグロビン減少、白血球数減少、血小板減少症 | ||
| 心臓 | 心電図QT延長、心室性期外収縮 | ||
| 消化器 | 便秘、嘔吐、下痢、悪心、胃炎、腹部膨満、歯周炎 | ||
| 肝臓 | ALT増加、AST増加、肝機能異常、γ-GTP増加、Al-P増加、脂肪肝、肝酵素上昇 | ||
| 感染症 | CRP増加、膀胱炎、鼻咽頭炎 | ||
| 代謝 | 糖尿病、血中コレステロール増加、食欲減退、高脂血症、中心性肥満、血中尿酸増加 | ||
| 筋骨格系 | 筋力低下、関節痛、筋痙縮、頚部痛、筋骨格硬直、骨密度減少、肋骨骨折、背部痛、四肢痛 | ||
| 良性、悪性及び詳細不明の新生物 | 結腸癌、胃癌 | 脂肪腫 | |
| 精神神経系 | 不眠症、頭痛、浮動性めまい、神経痛、坐骨神経痛、気力低下、脳出血 | ||
| 泌尿器 | 夜間頻尿、血中尿素増加、排尿困難 | ||
| 生殖系及び乳房 | 勃起不全、精巣萎縮、女性化乳房 | ||
| 呼吸器 | 湿性咳嗽 | ||
| 皮膚 | 多汗症、皮下出血、そう痒症、発疹、湿疹、蕁麻疹、全身性そう痒症 | 血管浮腫 | |
| 血管 | ほてり、高血圧 | 血圧上昇、潮紅 | |
| その他 | 体重増加、発熱、倦怠感 | 疲労、末梢性浮腫、悪寒、体重減少 | 無力症 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤に溶解液を加えた後、静かに円を描くように回して溶解すること。激しく振とうしないこと。[7.1参照]
14.1.2 投与液濃度、投与量が有効性に影響するため、溶け残りがなく、溶液が透明な状態になるまで溶解し、規定する量を抜き取るよう注意すること。[7.1参照]
14.1.3 溶解後速やかに投与すること。本剤を調製後1時間以上放置すると、注射液が懸濁又は粘度を増すことがあり、その結果、薬物の放出能に影響を及ぼすおそれがある。[7.1参照]
14.2 薬剤投与時の注意
14.2.1 投与経路
皮下注射にのみ使用すること。本剤は生体内成分と触れることによりゲル化することから、静脈注射により血栓症を誘発するおそれがある。
14.2.2 腹部に皮下注射を行うこと。
14.2.3 注射部位は毎回変更し、同一部位への反復注射は行わないこと。
14.2.4 注射部位はベルト周り等圧迫される部位及び肋骨近辺を避けること。
14.2.5 注射針が血管内に入っていないことを確認すること。
14.3 薬剤投与後の注意
14.3.1 注射部位周辺をもまないように患者に指導すること。
15. その他の注意
15.1 臨床使用に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 反復投与
<維持用量を4週間間隔で投与する場合>
前立腺癌患者にデガレリクス初回用量240mg(40mg/mL)を腹部2カ所に皮下投与し、初回投与4週間後より、4週ごとにデガレリクス維持用量80mg(20mg/mL)を腹部1カ所に皮下投与した際の初回投与後の薬物動態パラメータ及び投与開始後1年間の血漿中濃度推移は以下のとおりである。初回投与後、およそ1日で最高血漿中濃度(約75ng/mL)に達した。また、維持用量投与後速やかに定常状態に到達し(投与8週目)、投与開始後1年間のトラフ濃度は約17〜18ng/mLで推移した。血漿中濃度の推移からみて蓄積性は認められなかった4)6)。
| n | Cmax(ng/mL) | Tmaxa)(day) | AUC0-28day(ng・day/mL) | C28day(ng/mL) |
| 136 | 75.03±45.25 | 0.96[0.73-27.98] | 735±306b) | 14.43±5.21 |
投与開始後1年間の平均血漿中デガレリクス濃度推移(初回投与後4週間の経時推移及び維持用量投与後のトラフ濃度)
<維持用量を12週間間隔で投与する場合>
前立腺癌患者にデガレリクス初回用量240mg(40mg/mL)を腹部2カ所に皮下投与し、初回投与4週間後より、12週ごとにデガレリクス維持用量480mg(60mg/mL)を腹部2カ所に皮下投与した際の初回投与後及び4回目(投与40週目)の維持用量投与後の薬物動態パラメータは以下のとおりである。維持用量投与後、およそ3日で最高血漿中濃度(約120ng/mL)に達した。デガレリクスの血漿中トラフ濃度の平均値は、抗デガレリクス抗体陰性例では維持用量投与後速やかに定常状態に達し(投与16週目)、約16〜19ng/mLで推移した。一部の抗デガレリクス抗体陽性例では、抗体陽性転化後約1年にわたってデガレリクスの血漿中トラフ濃度が上昇傾向を示したが、その後はおおむね安定することが確認された7)。
| n | Cmax(ng/mL) | Tmaxa)(day) | AUCb)(ng・day/mL) | |
| 初回投与 | 115 | 62.08±28.26 | 2.92[1.71-6.94] | 761±295 |
| 維持投与 | 96 | 119.46±113.93 | 2.99[1.85-84.01] | 3380±2423 |
16.2 吸収
海外健康高齢男性30例に総投与量として3.7〜49.4μg/kgを48時間静脈内持続投与注)した際の血漿中濃度及び日本人前立腺癌患者114例にデガレリクス初回用量240mg(40mg/mL)を皮下投与し、初回投与4週間後より、4週ごとにデガレリクス維持用量80mg(20mg/mL)を皮下投与した際の血漿中濃度、並びに日本人前立腺癌患者71例にデガレリクス初回用量240mg(40mg/mL)を皮下投与し、初回投与4週間後より、12週ごとにデガレリクス維持用量480mg(60mg/mL)を皮下投与した際の血漿中濃度を用いた母集団薬物動態解析において、バイオアベイラビリティの母集団平均は、投与液濃度が20、40及び60mg/mLのとき、それぞれ0.64、0.42及び0.27と推定された。なお、日本人前立腺癌患者の抗体陽性例のデータは解析から除外した8)。
16.3 分布
健康成人男性6例にデガレリクス30μg/kgを静脈内持続投与注)し、投与終了後1〜24時間に採取したサンプルを使用したex vivo試験では、血漿中デガレリクス濃度が3.83〜98.60ng/mLの範囲における血漿蛋白結合率は85.3〜92.4%であった(外国人データ)。In vitro試験において、デガレリクスは主にアルブミン及びα1-酸性糖蛋白に結合した9)。
16.4 代謝
In vitro試験において、デガレリクスはCYPによりほとんど代謝されず、プロテアーゼによる加水分解によってペプチド鎖に分解されると推定された10)。
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
海外健康高齢男性30例に総投与量として3.7〜49.4μg/kgを48時間静脈内持続投与注)した際の血漿中濃度及び日本人前立腺癌患者114例にデガレリクス初回用量240mg(40mg/mL)を皮下投与し、初回投与4週間後より、4週ごとにデガレリクス維持用量80mg(20mg/mL)を皮下投与した際の血漿中濃度、並びに日本人前立腺癌患者71例にデガレリクス初回用量240mg(40mg/mL)を皮下投与し、初回投与4週間後より、12週ごとにデガレリクス維持用量480mg(60mg/mL)を皮下投与した際の血漿中濃度を用いた母集団薬物動態解析において、推定糸球体ろ過速度(eGFR)に基づいて腎機能を分類し、腎機能の低下がデガレリクスの薬物動態に及ぼす影響を検討した。軽度(60≦eGFR<90mL/min/1.73m2、136例)、中等度(30≦eGFR<60mL/min/1.73m2、57例)及び重度腎機能障害患者(15≦eGFR<30mL/min/1.73m2、3例)では、腎機能正常者(eGFR≧90mL/min/1.73m2、19例)と比べて、デガレリクスのクリアランスは軽度腎機能障害患者で平均17.8%、中等度・重度腎機能障害患者では平均30.7%低いと推定された。なお、日本人前立腺癌患者の抗体陽性例のデータは解析から除外した8)。
16.6.2 肝機能障害患者
健康成人及び肝機能障害患者にデガレリクス1mgを静脈内持続投与注)したときの薬物動態パラメータは下表のとおりである11)(外国人データ)。
| 投与群 | n | Cmax(ng/mL) | AUC(ng・h/mL) | t1/2a)(h) | CL(L/h) |
| 健康成人 | 8 | 57.4±4.77 | 322±45.2 | 16.6[12.8-25.2] | 3.17±0.472 |
| 軽度肝機能障害患者 (Child-Pughスコア6以下) | 8 | 48.8±10.4 | 292±42.1 | 18.9[15.8-24.0] | 3.49±0.476 |
| 中等度肝機能障害患者 (Child-Pughスコア7〜9) | 8 | 40.0±5.13 | 272±59.8 | 17.9[14.0-24.8] | 3.84±0.894 |
注)本剤の承認された投与方法は皮下投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<維持用量を4週間間隔で投与する場合>
17.1.1 国内第II相試験
前立腺癌患者を対象に、初回用量を240mg(40mg/mL)、以後4週ごとに維持用量80mg(20mg/mL)を1年間投与した際の有効性、安全性を検討した。
去勢率及び抗腫瘍効果(奏効率)は下表のとおりである。
去勢率及び抗腫瘍効果(奏効率)は下表のとおりである。
| デガレリクス | |
| 去勢率a)b) | 94.9%(130/136例) |
| 95%CI | 90.9〜98.9% |
| 評価時期 | 4週 | 12週 | 28週 | 52週 |
| 奏効率c) | 77.4%(103/133例) | 90.8%(119/131例) | 88.0%(110/125例) | 84.5%(93/110例) |
国内第II相試験の安全性評価症例数136例中、臨床検査値異常を含む副作用発現症例は113例(83.1%)であり、主なものは注射部位疼痛(33.1%)、ほてり(33.1%)、注射部位硬結(30.9%)、注射部位紅斑(27.2%)、体重増加(17.6%)、発熱(9.6%)、注射部位腫脹(9.6%)、高血圧(7.4%)、注射部位そう痒感(5.1%)であった4)。
17.1.2 海外第III相試験
前立腺癌患者を対象に、本剤を初回用量240mg(40mg/mL)、以後4週ごとに維持用量80mg(20mg/mL)又はリュープロレリンを1年間投与した際の有効性の結果は下表のとおりである13)。
| デガレリクス | リュープロレリンb)(対照薬) | |
| 去勢率a) | 97.2%(202/207例) | 96.4%(194/201例) |
| 95%CI | 93.5〜98.8% | 92.5〜98.2% |
<維持用量を12週間間隔で投与する場合>
17.1.3 国内第III相試験
前立腺癌患者234例(本剤群117例、対照群117例)を対象に、本剤を初回用量240mg(40mg/mL)、以後12週ごとに維持用量480mg(60mg/mL)又はゴセレリンを1年間投与した際の有効性の結果は下表のとおりである5)。
| デガレリクス | ゴセレリン(対照薬)b) | |
| 去勢率a) | 95.1%(112/117例) | 100.0%(115/115例) |
安全性評価症例数117例中、臨床検査値異常を含む副作用発現症例は116例(99.1%)であり、主なものは注射部位疼痛(76.9%)、注射部位硬結(73.5%)、注射部位紅斑(71.8%)、注射部位腫脹(28.2%)、ほてり(25.6%)、注射部位そう痒感(18.8%)、発熱(17.1%)、体重増加(14.5%)、倦怠感(10.3%)、便秘(6.8%)、注射部位熱感(6.0%)、高血圧(5.1%)であった。
18. 薬効薬理
18.1 作用機序
18.2 下垂体性腺系機能抑制作用
18.3 抗腫瘍作用
19. 有効成分に関する理化学的知見
19.1. デガレリクス酢酸塩
20. 取扱い上の注意
ブリスター包装内は滅菌済みであるので、使用時まで開封しないこと。破損時、異常が認められるときは使用しないこと。
22. 包装
<ゴナックス皮下注用80mg[維持用量(4週ごと)包装]>
1バイアル(日局注射用水4.2mL入りシリンジ1本添付)
<ゴナックス皮下注用120mg[初回用量包装]>
2バイアル(日局注射用水3.0mL入りシリンジ2本添付)
<ゴナックス皮下注用240mg[維持用量(12週ごと)包装]>
2バイアル(日局注射用水4.2mL入りシリンジ2本添付)
23. 主要文献
- Bidoggia,H.et al., Am.Heart J., 140 (4), 678-683, (2000) »PubMed
- Saylor,P.J.et al., J.Urol., 181 (5), 1998-2008, (2009) »PubMed
- Tivesten,A.et al., Urol.Oncol., 33 (11), 464-475, (2015) »PubMed
- 社内報告書:前立腺癌患者・国内第II相試験[CL-0003](2012年6月29日承認 CTD2.7.6.20)
- 社内報告書:前立腺癌患者・国内第III相比較試験[CL-0010](2019年1月8日承認 CTD2.7.6.2)
- 社内報告書:前立腺癌患者・国内第II相試験[CL-0003](2012年6月29日承認 CTD2.7.2.2.2.2.2.6)
- 社内報告書:前立腺癌患者・国内第III相比較試験[CL-0010]
- 社内報告書:海外健康成人及び前立腺癌患者・薬物動態
- 社内報告書:ヒト血漿蛋白結合(2012年6月29日承認 CTD2.7.2.2.1.1)
- 社内報告書:代謝(2012年6月29日承認 CTD2.7.2.2.1.2.1)
- 社内報告書:海外健康成人・海外第I相試験[CS05](2012年6月29日承認 CTD2.7.2.2.2.1.1.2)
- 社内報告書:海外健康成人及び肝機能低下患者・薬物動態(2012年6月29日承認 CTD2.7.2.2.2.3)
- 社内報告書:海外前立腺癌患者・海外第III相比較試験[CS21](2012年6月29日承認 CTD2.7.6.5)
- 社内報告書:ヒトGnRHレセプター・薬理試験(2012年6月29日承認 CTD2.4.2.1.1)
- 社内報告書:ラット・薬理作用(2012年6月29日承認 CTD2.4.2.1.2)
- 社内報告書:サル・薬理作用(2012年6月29日承認 CTD2.6.6.2.7)
- 社内報告書:ラット及びラット前立腺癌細胞・薬理作用(2012年6月29日承認 CTD2.6.2.2.2.2)
- 社内報告書:マウス及びヒト前立腺癌細胞・薬理作用(2012年6月29日承認 CTD2.6.2.1、CTD2.6.2.2.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
フェリング・ファーマ株式会社
くすり相談室
〒105-0001
東京都港区虎ノ門二丁目10番4号
電話:フリーダイヤル:0120-093-168
製品情報問い合わせ先
フェリング・ファーマ株式会社
くすり相談室
〒105-0001
東京都港区虎ノ門二丁目10番4号
電話:フリーダイヤル:0120-093-168
26. 製造販売業者等
26.1 製造販売元(輸入)
フェリング・ファーマ株式会社
東京都港区虎ノ門二丁目10番4号