医薬品情報
| 総称名 | モメタゾン |
|---|---|
| 一般名 | モメタゾンフランカルボン酸エステル水和物 |
| 欧文一般名 | Mometasone Furoate Hydrate |
| 製剤名 | モメタゾンフランカルボン酸エステル水和物点鼻液 |
| 薬効分類名 | 定量噴霧式アレルギー性鼻炎治療剤 |
| 薬効分類番号 | 1329 |
| ATCコード | R01AD09 |
| KEGG DRUG |
D03325
モメタゾンフランカルボン酸エステル水和物
|
| KEGG DGROUP |
DG00419
モメタゾン
DG01955
副腎皮質ステロイド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年7月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| モメタゾン点鼻液50μg「MYL」56噴霧用 (後発品) | MOMETASONE Nasal 50μg[MYL]56 sprays | 東興薬品工業 | 1329710Q3020 | 401.1円/瓶 | 処方箋医薬品注) |
| モメタゾン点鼻液50μg「MYL」112噴霧用 (後発品) | MOMETASONE Nasal 50μg[MYL]112 sprays | 東興薬品工業 | 1329710Q4026 | 808.6円/瓶 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 有効な抗菌剤の存在しない感染症、全身性の真菌症の患者[症状を増悪させるおそれがある。]
2.2 本剤の成分に対して過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
<成人>
通常、成人には、各鼻腔に2噴霧ずつ1日1回投与する(モメタゾンフランカルボン酸エステルとして1日200μg)。
<小児>
通常、12歳未満の小児には、各鼻腔に1噴霧ずつ1日1回投与する(モメタゾンフランカルボン酸エステルとして1日100μg)。
通常、12歳以上の小児には、各鼻腔に2噴霧ずつ1日1回投与する(モメタゾンフランカルボン酸エステルとして1日200μg)。
8. 重要な基本的注意
8.1 鼻・咽喉頭真菌症が発現した場合、本剤の投与を中止し、適切な処置を行うこと。
8.2 全身性ステロイド剤と比較し可能性は低いが、点鼻ステロイド剤の投与により全身性の作用(クッシング症候群、クッシング様症状、副腎皮質機能抑制、小児の成長遅延、骨密度の低下、白内障、緑内障を含む)が発現する可能性がある。特に長期間、大量投与の場合には定期的に検査を行い、全身性の作用が認められた場合には適切な処置を行うこと。
8.3 通年性アレルギー性鼻炎の患者において長期に使用する場合、症状の改善状態が持続するようであれば、本剤の減量につとめること。
8.4 本剤の投与が数ヵ月以上にわたる場合は、鼻中隔潰瘍等の鼻所見に注意すること。
8.5 季節性の疾患に対しては、好発期を考えて、その直前から治療を開始し、抗原との接触がなくなるまで続けることが望ましい。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 結核性疾患、未治療の感染症(有効な抗菌剤の存在しない感染症、全身性の真菌症を除く)及び眼の単純ヘルペス患者
症状を増悪させるおそれがある。
9.1.2 反復性鼻出血の患者
出血を増悪させるおそれがある。
9.1.3 鼻中隔潰瘍のある患者、鼻の手術を受けた患者、あるいは鼻外傷のある患者
患部が治癒するまで本剤を投与しないこと。ステロイド剤は創傷治癒を抑制する作用がある。
9.1.4 ステロイド剤の全身投与から局所投与に切り替えた患者
副腎皮質機能不全又は離脱症状(関節あるいは筋肉の疼痛、倦怠感及びうつ等)の徴候、症状があらわれた場合には、適切な処置を行うこと。また、全身性ステロイド剤の減量中並びに離脱後も副腎皮質機能検査を行い、外傷、手術、重症感染症等の侵襲には十分に注意を払うこと。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。経皮又は経口投与による動物実験(ラット、ウサギ)で催奇形性作用が報告されている。1)
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
9.7.1 長期間投与する場合には、身長等の経過の観察を十分行うこと。また、使用にあたっては、使用法を正しく指導すること。全身性ステロイド剤と比較し可能性は低いが、点鼻ステロイド剤を特に長期間、大量に投与する場合に小児の成長遅延をきたすおそれがある。
9.7.2 国内において、3歳未満の幼児、乳児、新生児及び低出生体重児を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下している。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
アナフィラキシー(呼吸困難、全身潮紅、血管浮腫、じん麻疹等)があらわれることがある。
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 過敏症 | じん麻疹等の発疹 | ||
| 鼻腔 | 鼻症状(刺激感注)、そう痒感、乾燥感注)、疼痛、発赤、不快感注)等)、真菌検査陽性 | 鼻出血注)、鼻漏、鼻閉、くしゃみ、嗅覚障害 | 鼻中隔穿孔、鼻潰瘍、鼻症状(灼熱感) |
| 口腔並びに呼吸器 | 咽喉頭症状(刺激感、疼痛、不快感、乾燥等) | 咳嗽、上気道炎 | |
| 肝臓 | 肝機能障害、ALT上昇注)、AST上昇注)、ビリルビン上昇、Al-P上昇、ウロビリン尿 | ||
| 血液 | 好中球増多、好酸球増多、単球増多、白血球減少、白血球増多、白血球分画異常、赤血球減少注)、ヘモグロビン減少注)、ヘマトクリット減少注)、リンパ球減少、血小板減少注)、カリウム上昇 | ||
| 精神神経系 | 頭痛、倦怠感 | ||
| 眼 | 眼圧亢進、霧視、中心性漿液性網脈絡膜症 | ||
| その他 | コルチゾール減少注) | 蛋白尿注)、尿糖、BUN上昇、コルチゾール上昇 | 味覚障害 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者には添付の携帯袋及び使用説明書を渡し、以下の使用方法を指導すること。
・鼻腔内噴霧用にのみ使用すること。
・初回使用時のみ予備噴霧(5回程度)を行うこと。
・噴霧口を針やピンなどで突かないこと。
16. 薬物動態
16.1 血中濃度
季節性アレルギー性鼻炎患者(成人)を対象に、本剤200μg(各鼻腔に2噴霧ずつ)を単回投与注)した際、投与1時間後の血漿中モメタゾンフランカルボン酸エステル濃度の平均値は8.85pg/mL、最大値は24.5pg/mLであった。
注)本剤の成人の承認用法・用量は、「通常、成人には、各鼻腔に2噴霧ずつ1日1回投与する(モメタゾンフランカルボン酸エステルとして1日200μg)。」である。
17. 臨床成績
17.3 その他
生物学的同等性試験
季節性アレルギー性鼻炎患者(成人)を対象とした治療学的同等性試験において、本剤、標準製剤又はプラセボを各鼻腔に2噴霧ずつ1日1回(モメタゾンフランカルボン酸エステルとして1日200μg)2週間投与した。
主要評価項目である総合鼻症状スコア(くしゃみ発作、鼻汁、鼻閉、鼻内そう痒感)の期間平均変化量注1)を同等性の指標とし、得られた値の平均値の差の95%信頼区間を算出した結果、治療学的同等限界(△=±1.13)の範囲内であり、両剤の治療学的同等性が確認された。2)
主要評価項目である総合鼻症状スコア(くしゃみ発作、鼻汁、鼻閉、鼻内そう痒感)の期間平均変化量注1)を同等性の指標とし、得られた値の平均値の差の95%信頼区間を算出した結果、治療学的同等限界(△=±1.13)の範囲内であり、両剤の治療学的同等性が確認された。2)
| 投与群 | 症例数 | ベースライン Mean (S.D.) | 変化量 平均値の推定値注2) (95%信頼区間) | 解析結果注2) |
| 本剤 | 72 | 8.764 (1.754) | -4.297 (-4.841〜-3.753) | 平均値の差の推定値(本剤−標準製剤):0.342 95%信頼区間:-0.427〜1.112 |
| 標準製剤 | 72 | 8.685 (1.869) | -4.639 (-5.184〜-4.095) | |
| プラセボ | 36 | 8.861 (1.746) | -1.859 (-2.628〜-1.089) | − |
注1)ベースライン(投与前3日間の平均スコア)に対する投与Day12〜14の計3日間の平均スコアの変化量
注2)投与群を固定効果、ベースラインを共変量とした時の線形モデルでの解析結果
総合鼻症状スコアの経時推移
18. 薬効薬理
18.1 作用機序
モメタゾンフランカルボン酸エステルは、グルココルチコイド受容体に対する親和性が高く、強い局所抗炎症作用及びアレルギー性鼻炎抑制作用を示す。
18.2 アレルギー性鼻炎抑制作用
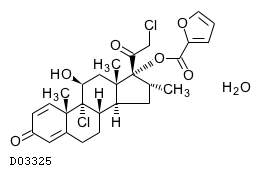
19. 有効成分に関する理化学的知見
19.1. モメタゾンフランカルボン酸エステル水和物
22. 包装
<モメタゾン点鼻液50μg「MYL」56噴霧用>
5本[7g(瓶)×5]
10本[7g(瓶)×10]
<モメタゾン点鼻液50μg「MYL」112噴霧用>
5本[13g(瓶)×5]
10本[13g(瓶)×10]
23. 主要文献
24. 文献請求先及び問い合わせ先
文献請求先
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
製品情報問い合わせ先
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
26. 製造販売業者等
26.1 製造販売元
東興薬品工業株式会社
富山県中新川郡立山町辻20
26.2 販売元
ヴィアトリス製薬合同会社
東京都港区麻布台一丁目3番1号