医薬品情報
| 総称名 | イナビル |
|---|---|
| 一般名 | ラニナミビルオクタン酸エステル水和物 |
| 欧文一般名 | Laninamivir Octanoate Hydrate |
| 製剤名 | ラニナミビルオクタン酸エステル水和物吸入剤 |
| 薬効分類名 | 長時間作用型ノイラミニダーゼ阻害剤 |
| 薬効分類番号 | 6250 |
| ATCコード | J05AH04 |
| KEGG DRUG |
D09547
ラニナミビルオクタン酸エステル水和物
|
| KEGG DGROUP |
DG03029
抗インフルエンザウイルス薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年1月 改訂(再審査結果)(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| イナビル吸入懸濁用160mgセット | INAVIR FOR INHALATION SUSPENSION | 第一三共 | 6250703G2029 | 4241.5円/瓶 | 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
5.1 抗ウイルス薬の投与が全てのA型又はB型インフルエンザウイルス感染症の治療に必須ではないことを踏まえ、本剤の使用の必要性を慎重に検討すること。[1.参照]
5.2 本剤の予防投与における有効性及び安全性は確立していない。[1.参照]
5.3 本剤はC型インフルエンザウイルス感染症には効果がない。[1.参照]
5.4 本剤は細菌感染症には効果がない。[1.、8.2参照]
6. 用法及び用量
成人及び小児には、ラニナミビルオクタン酸エステルとして160mgを日本薬局方生理食塩液2mLで懸濁し、ネブライザを用いて単回吸入投与する。
7. 用法及び用量に関連する注意
7.1 症状発現後、可能な限り速やかに投与を開始することが望ましい。症状発現から48時間を経過後に投与を開始した患者における有効性を裏付けるデータは得られていない。
7.2 本剤を吸入する際には、ジェット式ネブライザを使用すること。添付のネブライザ吸入器を使用する際に、事前にコンプレッサーとの適合性を確認すること。
8. 重要な基本的注意
8.1 抗インフルエンザウイルス薬の服用の有無又は種類にかかわらず、インフルエンザ罹患時には、異常行動を発現した例が報告されている。
異常行動による転落等の万が一の事故を防止するための予防的な対応として、1)異常行動の発現のおそれがあること、2)自宅において療養を行う場合、少なくとも発熱から2日間、保護者等は転落等の事故に対する防止対策を講じること、について患者・家族に対し説明を行うこと。
なお、転落等の事故に至るおそれのある重度の異常行動については、就学以降の小児・未成年者の男性で報告が多いこと、発熱から2日間以内に発現することが多いこと、が知られている。[11.1.3参照]
異常行動による転落等の万が一の事故を防止するための予防的な対応として、1)異常行動の発現のおそれがあること、2)自宅において療養を行う場合、少なくとも発熱から2日間、保護者等は転落等の事故に対する防止対策を講じること、について患者・家族に対し説明を行うこと。
なお、転落等の事故に至るおそれのある重度の異常行動については、就学以降の小児・未成年者の男性で報告が多いこと、発熱から2日間以内に発現することが多いこと、が知られている。[11.1.3参照]
8.2 細菌感染症がインフルエンザウイルス感染症に合併したり、インフルエンザ様症状と混同されることがある。細菌感染症の場合には、抗菌剤を投与するなど適切な処置を行うこと。[5.4参照]
8.3 本剤投与後に失神やショック症状があらわれるおそれがある。この失神やショック症状はインフルエンザウイルス感染症に伴う発熱、脱水等の全身状態の悪化及び本剤による可能性がある。患者には吸入法を十分に理解させ、くつろいだ状態(例えば座位等)で吸入するよう指導すること。[11.1.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 慢性呼吸器疾患(気管支喘息及び慢性閉塞性肺疾患等)を有する患者
患者の状態を十分に観察しながら投与すること。インフルエンザウイルス感染症により気道過敏性が亢進することがあり、気管支攣縮や呼吸機能低下があらわれるおそれがある。[11.1.2参照]
9.1.2 基礎疾患(糖尿病を含む慢性代謝性疾患、慢性腎機能障害、慢性心疾患)を有する患者、あるいは免疫低下状態の患者等
患者の状態を十分に観察しながら投与すること。使用経験が少ない。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で胎盤通過性が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中に移行することが報告されている。
9.8 高齢者
患者の状態を十分に観察しながら投与すること。一般に生理機能が低下していることが多い。[16.6.2参照]
10. 相互作用
10.2 併用注意
| 経鼻弱毒生インフルエンザワクチン | 経鼻弱毒生インフルエンザワクチンの効果が得られないおそれがある。 | ワクチンウイルスの増殖が抑制され、経鼻弱毒生インフルエンザワクチンの効果が減弱する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)、アナフィラキシー(頻度不明)
失神、呼吸困難、蕁麻疹、血圧低下、顔面蒼白、冷汗等があらわれることがある。本剤投与後に失神やショック症状があらわれた場合には、患者に仰臥位をとらせ安静を保つとともに、補液を行うなど適切な処置を行うこと。[8.3参照]
11.1.2 気管支攣縮(頻度不明)、呼吸困難(頻度不明)[9.1.1参照]
11.1.3 異常行動(頻度不明)
因果関係は不明であるものの、インフルエンザ罹患時には、転落等に至るおそれのある異常行動(急に走り出す、徘徊する等)があらわれることがある。[8.1参照]
11.1.4 皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)、中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、多形紅斑(頻度不明)
11.2 その他の副作用
| 0.5%未満 | 頻度不明注) | |
| 過敏症 | 蕁麻疹、発疹、紅斑、そう痒 | |
| 消化器 | 嘔吐 | 下痢、胃腸炎、悪心、腹痛、口内炎、腹部膨満、食欲減退、腹部不快感 |
| 精神神経系 | めまい、頭痛 | |
| 血液 | 白血球数増加 | |
| 肝臓 | ALT上昇、AST上昇、γ-GTP上昇、肝機能異常 | |
| 泌尿器 | 尿蛋白 | |
| その他 | CRP上昇、尿中ブドウ糖陽性 |
14. 適用上の注意
14.1 薬剤投与時の注意
添付のネブライザ吸入器は再使用しないこと。
16. 薬物動態
16.1 血中濃度
16.1.1 血漿中濃度
<成人>
健康成人男性8例にラニナミビルオクタン酸エステルとして160mgをネブライザを用いて単回吸入投与したときの活性代謝物ラニナミビルの血漿中濃度推移及び薬物動態パラメータは次のとおりであった1)。
ラニナミビルの血漿中濃度推移
| 投与量 | 例数 | Cmax(ng/mL) | Tmaxa)(hr) | AUClast(ng・hr/mL) | t1/2(hr) |
| 160mg | 8 | 26.6±1.6 | 6.0(6.0〜6.0) | 1040±217 | 115.6±46.1 |
<小児>(参考:イナビル吸入粉末剤)
4〜12歳の小児のインフルエンザウイルス感染症患者19例に吸入粉末剤をラニナミビルオクタン酸エステルとして20mg又は40mg単回吸入投与したときの活性代謝物ラニナミビルの血漿中濃度は次のとおりであった。
| 投与量 | 例数 | 投与1時間後 | 投与4時間後 | 投与24時間後 | 投与144時間後 |
| 20mg | 8 | 12.0±8.1 | 17.6±10.0 | 5.3±2.7 | 0.5±0.8 |
| 40mg | 11 | 21.7±7.7 | 32.7±10.0 | 9.6±3.0 | 2.0±1.1 |
16.3 分布
16.3.1 組織移行
健康成人男性24例にラニナミビルオクタン酸エステルとして160mgをネブライザを用いて単回吸入投与したときの活性代謝物ラニナミビルの血漿、肺胞粘液及び肺胞マクロファージ中濃度推移並びに薬物動態パラメータの推定値は次のとおりであった1)。
ラニナミビルの血漿、肺胞粘液及び肺胞マクロファージ中濃度推移
各測定時点6例(ただし、0.5時間、2時間、3.5時間後の血漿中濃度は24例)
| 試料 | Cmax(ng/mL) | Tmax(hr) | AUClast(ng・hr/mL) | t1/2(hr) |
| 血漿 | 24.0 | 3.5 | 1180 | 86.5 |
| 肺胞粘液 | 1.46×103 | 4.0 | 128×103 | 219 |
| 肺胞マクロファージ | 480×103 | 24.0 | 52.4×106 | − |
ラットに14C-ラニナミビルオクタン酸エステル水和物を単回経気管投与したところ、放射能は主な標的組織である気管や肺に高濃度に認められ、肺中放射能濃度は消失半減期23.2時間で推移した。放射能は中枢神経系(脳・脊髄)にはほとんど認められなかった。
16.3.2 蛋白結合率(超遠心法)
ヒト血漿蛋白結合率は、ラニナミビルオクタン酸エステル水和物では67〜70%、活性代謝物ラニナミビルでは0.4%以下であった(in vitro)。
16.4 代謝
ラニナミビルオクタン酸エステル水和物は、吸入投与後、気管及び肺において加水分解により活性代謝物ラニナミビルに変換されると推測される。
16.5 排泄
健康成人男性8例に吸入粉末剤をラニナミビルオクタン酸エステルとして40mg単回吸入投与したとき、活性代謝物ラニナミビルの投与144時間後までの累積尿中排泄率は投与量の23.1%であった。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
クレアチニンクリアランス(CLcr)値により規定された腎機能低下者13例に吸入粉末剤をラニナミビルオクタン酸エステルとして20mgを単回吸入投与したところ、活性代謝物ラニナミビルのt1/2に変化は認めず、AUC0-infは、腎機能正常者と比較して、軽度(CLcr:50〜80mL/min)、中等度(CLcr:30〜50mL/min)及び重度(CLcr:30mL/min未満)の腎機能低下者でそれぞれ1.1倍、2.0倍、4.9倍であった2)。
16.6.2 高齢者
健康な高齢者(65歳以上)6例に吸入粉末剤をラニナミビルオクタン酸エステルとして40mgを単回吸入投与したところ、非高齢者(20〜45歳)と比較して、活性代謝物ラニナミビルのTmax及びt1/2に変化は認めず、Cmaxが0.5倍、AUC0-infが0.8倍であった。[9.8参照]
注)本剤の承認された用法及び用量は、ネブライザによる160mg単回吸入投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(成人及び10歳以上の小児)
成人及び10歳以上の小児(534例)を対象にプラセボ対照無作為化単盲検並行群間比較試験を実施した。主要評価項目であるインフルエンザ罹病時間(全てのインフルエンザ症状が「なし」又は「軽度」に改善し、それらが21.5時間以上持続するまでの時間)についての結果は以下のとおりであり、プラセボに対するラニナミビルオクタン酸エステル160mgの優越性が検証された(層別一般化Wilcoxon検定:P=0.0024)。また、副作用発現頻度は、ラニナミビルオクタン酸エステル160mg群で2.2%(6/268例)であった。主な副作用は、下痢0.7%(2/268例)であった3)。
| ラニナミビルオクタン酸エステル群(268例) | プラセボ群(266例) | |
| 中央値[95%信頼区間](hr) | 55.3[48.9,68.8] | 73.6[67.8,84.3] |
| P値a) | 0.0024 | |
インフルエンザ罹病時間に係るKaplan-Meier推定値
| 投与終了からの時間(hr) | 0 | 40 | 80 | 120 | 160 | 200 | 240 | 280 | 320 | 360 | |
| At risk | ラニナミビルオクタン酸エステル群(例) | 268 | 177 | 101 | 50 | 28 | 21 | 16 | 12 | 9 | 0 |
| プラセボ群(例) | 266 | 198 | 118 | 64 | 44 | 35 | 27 | 23 | 17 | 0 |
17.1.2 国内第III相試験(10歳未満の小児)
10歳未満の小児(173例;0歳1例、1〜6歳117例、7〜9歳55例)を対象に非対照非盲検試験を実施した。主要評価項目であるインフルエンザ罹病時間(咳及び鼻症状の2症状が「なし」又は「軽度」に改善し、かつ体温が37.4℃以下となって、それらが21.5時間以上持続するまでの時間)の中央値[95%信頼区間]は49.0[43.0,61.0]時間であった。また、副作用発現頻度は、1.7%(3/173例)であった。認められた副作用は、便秘、悪心及び嘔吐が各0.6%(1/173例)であった4)。
インフルエンザ罹病時間に係るKaplan-Meier推定値
| 投与終了からの時間(hr) | 0 | 40 | 80 | 120 | 160 | 200 | 240 | 280 | 320 | 360 | |
| At risk | ラニナミビルオクタン酸エステル群(例) | 173 | 103 | 56 | 38 | 24 | 12 | 7 | 5 | 4 | 0 |
18. 薬効薬理
18.1 作用機序
ラニナミビルオクタン酸エステル水和物はプロドラッグであり、加水分解により活性代謝物ラニナミビルに変換された後、抗ウイルス作用を示す。
ラニナミビルは、A型及びB型インフルエンザウイルスのノイラミニダーゼを選択的に阻害し、新しく形成されたウイルスの感染細胞からの遊離を阻害することにより、ウイルスの増殖を抑制する。
ラニナミビルは、A型及びB型インフルエンザウイルスのノイラミニダーゼを選択的に阻害し、新しく形成されたウイルスの感染細胞からの遊離を阻害することにより、ウイルスの増殖を抑制する。
18.2 抗ウイルス作用(in vitro)
18.3 抗ウイルス作用(in vivo)
A型インフルエンザウイルスのマウス感染モデルでは、ラニナミビルオクタン酸エステル水和物の単回経鼻投与により、6.6〜660μg/kgで有意な肺中ウイルス力価の減少、21〜190μg/kgで有意な生存数の増加といった治療効果が認められた8)。
B型インフルエンザウイルスのフェレット感染モデルでは、ラニナミビルオクタン酸エステル水和物の単回経鼻投与(24μg/kg及び240μg/kg)は、鼻腔洗浄液中のウイルス力価を低下させた8)9)。
また、インフルエンザA型(H1N1)pdm09ウイルスのマウス感染モデルにおいて、ラニナミビルオクタン酸エステル水和物700μg/kgの単回経鼻投与で有意な肺中ウイルス力価の減少が認められた6)。
高病原性鳥インフルエンザA型(H5N1)ウイルスのマウス感染モデルにおいても、ラニナミビルオクタン酸エステル水和物の単回経鼻投与は、75μg/kg以上の投与量で感染3日後の、750μg/kg以上の投与量で感染6日後までの肺中ウイルス力価を減少させた7)。
B型インフルエンザウイルスのフェレット感染モデルでは、ラニナミビルオクタン酸エステル水和物の単回経鼻投与(24μg/kg及び240μg/kg)は、鼻腔洗浄液中のウイルス力価を低下させた8)9)。
また、インフルエンザA型(H1N1)pdm09ウイルスのマウス感染モデルにおいて、ラニナミビルオクタン酸エステル水和物700μg/kgの単回経鼻投与で有意な肺中ウイルス力価の減少が認められた6)。
高病原性鳥インフルエンザA型(H5N1)ウイルスのマウス感染モデルにおいても、ラニナミビルオクタン酸エステル水和物の単回経鼻投与は、75μg/kg以上の投与量で感染3日後の、750μg/kg以上の投与量で感染6日後までの肺中ウイルス力価を減少させた7)。
18.4 耐性
インフルエンザウイルス感染症に対するラニナミビルオクタン酸エステル水和物の効果を検討した国内臨床試験8試験(国際共同試験の1試験含む)で、1,917例の患者から分離したインフルエンザウイルス株において活性代謝物ラニナミビルに対する感受性が低下した株は認められなかった。
19. 有効成分に関する理化学的知見
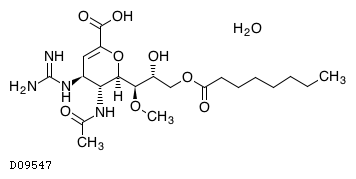
19.1. ラニナミビルオクタン酸エステル水和物
22. 包装
5バイアル(ネブライザ吸入器 5個添付)
23. 主要文献
- Toyama K,et al., Antimicrob Agents Chemother., 62 (1), e01722-17, (2018) »PubMed »DOI
- Ishizuka H,et al., J Clin Pharmacol., 51 (2), 243-251, (2011) »PubMed »DOI
- 社内資料:成人及び10歳以上の小児のインフルエンザウイルス感染症患者を対象としたプラセボ対照無作為化単盲検比較試験(2019年6月18日承認、CTD2.7.6.2)
- 社内資料:10歳未満の小児のインフルエンザウイルス感染症患者を対象とした非対照非盲験試験(2019年6月18日承認、CTD2.7.6.3)
- Yamashita M,et al., Antimicrob Agents Chemother., 53 (1), 186-192, (2009) »PubMed »DOI
- Itoh Y,et al., Nature., 460 (7258), 1021-1025, (2009) »PubMed »DOI
- Kiso M,et al., PLoS Pathog., 6 (2), e1000786, (2010) »PubMed »DOI
- Kubo S,et al., Antimicrob Agents Chemother., 54 (3), 1256-1264, (2010) »PubMed
- 社内資料:フェレット感染モデルにおける抗ウイルス作用(イナビル吸入粉末剤 2010年9月10日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
製品情報問い合わせ先
第一三共株式会社
製品情報センター
〒103-8426
東京都中央区日本橋本町3-5-1
電話:0120-189-132
26. 製造販売業者等
26.1 製造販売元
第一三共株式会社
東京都中央区日本橋本町3-5-1