医薬品情報
| 総称名 | ゾルトファイ |
|---|---|
| 一般名 | インスリン デグルデク(遺伝子組換え) リラグルチド(遺伝子組換え) |
| 欧文一般名 | Insulin Degludec(Genetical Recombination) Liraglutide(Genetical Recombination) |
| 製剤名 | インスリン デグルデク(遺伝子組換え)/リラグルチド(遺伝子組換え) |
| 薬効分類名 | 持効型溶解インスリンアナログ/ヒトGLP-1アナログ 配合注射液 |
| 薬効分類番号 | 3969 |
| ATCコード | A10AE56 |
| KEGG DRUG |
D11567
インスリンデグルデク
|
| KEGG DGROUP |
DG01636
インスリン製剤
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第7版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ゾルトファイ配合注フレックスタッチ | Xultophy combination injection FlexTouch | ノボノルディスクファーマ | 3969500G1029 | 4207円/キット | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 低血糖症状を呈している患者[11.1.1参照]
2.3 糖尿病性ケトアシドーシス、糖尿病性昏睡、1型糖尿病患者[インスリンのみを含有する製剤による速やかな治療が必須となるので、本剤を投与すべきでない]
2.4 重症感染症、手術等の緊急の場合[インスリンのみを含有する製剤による血糖管理が望まれるので、本剤の投与は適さない]
4. 効能または効果
インスリン療法が適応となる2型糖尿病
5. 効能または効果に関連する注意
本剤は食事療法・運動療法に加え、糖尿病用薬による治療で効果不十分な場合に使用を検討すること。[17.1参照]
6. 用法及び用量
通常、成人では、初期は1日1回10ドーズ(インスリン デグルデク/リラグルチドとして10単位/0.36mg)を皮下注射する。投与量は患者の状態に応じて適宜増減するが、1日50ドーズ(インスリン デグルデク/リラグルチドとして50単位/1.8mg)を超えないこと。注射時刻は原則として毎日一定とする。なお、本剤の用量単位である1ドーズには、インスリン デグルデク1単位及びリラグルチド0.036mgが含まれる。
7. 用法及び用量に関連する注意
7.1 本剤はインスリン デグルデクとリラグルチドを配合した製剤であるため、投与量は慎重に決定すること。なお、本剤は1〜50ドーズの投与量を1ドーズ刻みで調節可能である。
7.2 本剤の開始時は、以下の点に注意すること[17.1参照]
(1)インスリン製剤(Basalインスリン又は混合型/配合溶解インスリン)以外の糖尿病用薬による治療で効果不十分な場合
・GLP-1受容体作動薬による治療で効果不十分な場合に本剤を投与するにあたっては、前治療のGLP-1受容体作動薬の投与を中止し、本剤と併用しないこと。週1回投与などの持続性GLP-1受容体作動薬による治療から本剤に切り替える場合は、その作用持続性を考慮し、次回に予定していた投与タイミングから本剤の投与を開始すること。
(2)インスリン製剤(Basalインスリン又は混合型/配合溶解インスリン)による治療で効果不十分な場合
・開始用量は、通常1日1回10ドーズであるが、前治療のインスリン投与量や患者の状態に応じて、1日1回16ドーズ(インスリン デグルデク/リラグルチドとして16単位/0.58mg)までの範囲で増減できる。
・本剤の投与にあたっては、前治療のインスリン製剤(Basalインスリン又は混合型/配合溶解インスリン)の投与を中止し、本剤と併用しないこと。
7.3 本剤の1日用量として50ドーズを超える用量が必要な場合は、他の糖尿病用薬への切り替えを検討すること。
7.4 投与を忘れた場合には、本剤の作用持続時間等の特徴から気づいた時点で直ちに投与できるが、その次の投与は8時間以上あけてから行い、その後は通常の注射時刻に投与するよう指導すること。
8. 重要な基本的注意
8.1 投与する場合には、血糖を定期的に検査し、薬剤の効果を確かめ、3〜4ヵ月間投与して効果が不十分な場合には、速やかに他の治療薬への切り替えを行うこと。
8.2 本剤の投与開始時及びその後数週間は血糖コントロールのモニタリングを十分に行うこと。特に、高用量のインスリン製剤(Basalインスリン又は混合型/配合溶解インスリン)を投与している患者が本剤に切り替える場合は、血糖コントロールが一時的に悪化する可能性があることから、注意すること。
8.4 低血糖症状を起こすことがあるので、高所作業、自動車の運転等に従事している患者に投与するときには注意すること。[11.1.1参照]
8.7 肝機能障害があらわれることがあるので、観察を十分に行い、異常が認められた場合は適切な処置を行うこと。
8.8 本剤投与中は、甲状腺関連の症候の有無を確認し、異常が認められた場合には、専門医を受診するよう指導すること。[15.2.1参照]
8.9 胆石症、胆嚢炎、胆管炎又は胆汁うっ滞性黄疸が発現するおそれがあるので、腹痛等の腹部症状がみられた場合には、必要に応じて画像検査等による原因精査を考慮するなど、適切に対応すること。[11.1.5参照]
8.10 急激な血糖コントロールに伴い、糖尿病網膜症の顕在化又は増悪、眼の屈折異常、治療後神経障害(主として有痛性)があらわれることがあるので注意すること。
8.11 本剤の自己注射にあたっては、以下の点に留意すること。
・投与法について十分な教育訓練を実施したのち、患者自ら確実に投与できることを確認した上で、医師の管理指導の下で実施すること。
・全ての器具の安全な廃棄方法について指導を徹底すること。
・添付されている取扱説明書を必ず読むよう指導すること。
8.12 本剤の有効成分の一つであるリラグルチドとDPP-4阻害薬はいずれもGLP-1受容体を介した血糖降下作用を有している。リラグルチドとDPP-4阻害薬を併用した際の臨床試験成績はなく、有効性及び安全性は確認されていない。
8.13 本剤と他の糖尿病用注射剤を取り違えないよう、毎回注射する前に本剤のラベル等を確認するよう患者に十分指導すること。
8.14 同一箇所への繰り返し投与により、注射箇所に皮膚アミロイドーシス又はリポジストロフィーがあらわれることがあるので、定期的に注射箇所を観察するとともに、以下の点を患者に指導すること。
・本剤の注射箇所は、少なくとも前回の注射箇所から2〜3cm離すこと。[14.1.2参照]
・注射箇所の腫瘤や硬結が認められた場合には、当該箇所への投与を避けること。
8.15 皮膚アミロイドーシス又はリポジストロフィーがあらわれた箇所に本剤を投与した場合、本剤の吸収が妨げられ十分な血糖コントロールが得られなくなることがある。血糖コントロールの不良が認められた場合には、注射箇所の腫瘤や硬結の有無を確認し、注射箇所の変更とともに投与量の調整を行うなどの適切な処置を行うこと。血糖コントロールの不良に伴い、過度に増量されたインスリン製剤が正常な箇所に投与されたことにより、低血糖に至った例が報告されている。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 腹部手術の既往又はイレウスの既往のある患者
腸閉塞を含むイレウスを起こすおそれがある。[11.1.4参照]
9.1.3 糖尿病胃不全麻痺、炎症性腸疾患等の胃腸障害のある患者
十分な使用経験がなく胃腸障害の症状が悪化するおそれがある。
9.1.4 低血糖を起こすおそれがある以下の患者又は状態
9.2 腎機能障害患者
9.3 肝機能障害患者
9.5 妊婦
妊娠又は妊娠している可能性のある女性には本剤を投与せず、インスリン製剤を使用すること。
リラグルチドの生殖発生毒性試験で、ラットにおいてリラグルチドの最大推奨臨床用量である1.8mgの約18.3倍の曝露量に相当する1.0mg/kg/日で早期胚死亡の増加、ウサギにおいてリラグルチドの最大推奨臨床用量である1.8mgの約0.76倍の曝露量に相当する0.05mg/kg/日で母動物の摂餌量減少に起因するものと推測される胎児の軽度の骨格異常が認められている。
リラグルチドの生殖発生毒性試験で、ラットにおいてリラグルチドの最大推奨臨床用量である1.8mgの約18.3倍の曝露量に相当する1.0mg/kg/日で早期胚死亡の増加、ウサギにおいてリラグルチドの最大推奨臨床用量である1.8mgの約0.76倍の曝露量に相当する0.05mg/kg/日で母動物の摂餌量減少に起因するものと推測される胎児の軽度の骨格異常が認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
ラットでは乳汁中への移行がインスリン デグルデク及びリラグルチドにて報告されている。ヒトでの乳汁移行に関するデータ及びヒトの哺乳中の児への影響に関するデータはない。
ラットでは乳汁中への移行がインスリン デグルデク及びリラグルチドにて報告されている。ヒトでの乳汁移行に関するデータ及びヒトの哺乳中の児への影響に関するデータはない。
9.7 小児等
18歳未満の患者を対象とした臨床試験は本剤では実施していない。
9.8 高齢者
10. 相互作用
10.2 併用注意
| 糖尿病用薬 ビグアナイド薬 スルホニルウレア薬 速効型インスリン分泌促進薬 α-グルコシダーゼ阻害薬 チアゾリジン薬 DPP-4阻害薬 SGLT2阻害薬 等 | 血糖降下作用の増強による低血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること[11.1.1参照]。特に、スルホニルウレア薬と併用する場合、低血糖のリスクが増加するおそれがあるため、スルホニルウレア薬の減量を検討すること。 | 血糖降下作用が増強される。 |
| モノアミン酸化酵素(MAO)阻害剤 | 血糖降下作用の増強による低血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること[11.1.1参照]。特に、スルホニルウレア薬と併用する場合、低血糖のリスクが増加するおそれがあるため、スルホニルウレア薬の減量を検討すること。 | インスリン分泌促進、糖新生抑制作用による血糖降下作用を有する。 |
| 三環系抗うつ剤 ノルトリプチリン塩酸塩 等 | 血糖降下作用の増強による低血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること[11.1.1参照]。特に、スルホニルウレア薬と併用する場合、低血糖のリスクが増加するおそれがあるため、スルホニルウレア薬の減量を検討すること。 | 機序は不明であるが、インスリン感受性を増強するなどの報告がある。 |
| サリチル酸誘導体 アスピリン エテンザミド | 血糖降下作用の増強による低血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること[11.1.1参照]。特に、スルホニルウレア薬と併用する場合、低血糖のリスクが増加するおそれがあるため、スルホニルウレア薬の減量を検討すること。 | 糖に対するβ細胞の感受性の亢進やインスリン利用率の増加等による血糖降下作用を有する。また、末梢で弱いインスリン様作用を有する。 |
| 抗腫瘍剤 シクロホスファミド水和物 | 血糖降下作用の増強による低血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること[11.1.1参照]。特に、スルホニルウレア薬と併用する場合、低血糖のリスクが増加するおそれがあるため、スルホニルウレア薬の減量を検討すること。 | インスリンが結合する抗体の生成を抑制し、その結合部位からインスリンを遊離させる可能性がある。 |
| β-遮断剤 プロプラノロール塩酸塩 アテノロール ピンドロール | 血糖降下作用の増強による低血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること[11.1.1参照]。特に、スルホニルウレア薬と併用する場合、低血糖のリスクが増加するおそれがあるため、スルホニルウレア薬の減量を検討すること。 | アドレナリンによる低血糖からの回復反応を抑制する。また、低血糖に対する交感神経系の症状(振戦、動悸等)をマスクし、低血糖を遷延させる可能性がある。 |
| クマリン系薬剤 ワルファリンカリウム | 血糖降下作用の増強による低血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること[11.1.1参照]。特に、スルホニルウレア薬と併用する場合、低血糖のリスクが増加するおそれがあるため、スルホニルウレア薬の減量を検討すること。 | 機序不明 |
| クロラムフェニコール | 血糖降下作用の増強による低血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること[11.1.1参照]。特に、スルホニルウレア薬と併用する場合、低血糖のリスクが増加するおそれがあるため、スルホニルウレア薬の減量を検討すること。 | 機序不明 |
| ベザフィブラート | 血糖降下作用の増強による低血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること[11.1.1参照]。特に、スルホニルウレア薬と併用する場合、低血糖のリスクが増加するおそれがあるため、スルホニルウレア薬の減量を検討すること。 | インスリン感受性増強等の作用により、本剤の作用を増強する。 |
| サルファ剤 | 血糖降下作用の増強による低血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること[11.1.1参照]。特に、スルホニルウレア薬と併用する場合、低血糖のリスクが増加するおそれがあるため、スルホニルウレア薬の減量を検討すること。 | 膵臓でのインスリン分泌を増加させることにより、低血糖を起こすと考えられている。腎機能低下、空腹状態の遷延、栄養不良、過量投与が危険因子となる。 |
| シベンゾリンコハク酸塩 ジソピラミド ピルメノール塩酸塩水和物 | 血糖降下作用の増強による低血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること[11.1.1参照]。特に、スルホニルウレア薬と併用する場合、低血糖のリスクが増加するおそれがあるため、スルホニルウレア薬の減量を検討すること。 | インスリン分泌作用を認めたとの報告がある。 |
| チアジド系利尿剤 トリクロルメチアジド | 血糖降下作用の減弱による高血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | カリウム喪失が関与すると考えられている。カリウム欠乏時には、血糖上昇反応に対するβ細胞のインスリン分泌能が低下する可能性がある。 |
| 副腎皮質ステロイド プレドニゾロン トリアムシノロン | 血糖降下作用の減弱による高血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | 糖新生亢進、筋肉組織・脂肪組織からのアミノ酸や脂肪酸の遊離促進、末梢組織でのインスリン感受性低下等による血糖上昇作用を有する。 |
| ACTH テトラコサクチド酢酸塩 | 血糖降下作用の減弱による高血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | 副腎皮質刺激作用により糖質コルチコイドの分泌が増加する。糖質コルチコイドは、糖新生亢進、筋肉組織・脂肪組織からのアミノ酸や脂肪酸の遊離促進、末梢組織でのインスリン感受性低下等による血糖上昇作用を有する。 |
| アドレナリン | 血糖降下作用の減弱による高血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | 糖新生亢進、末梢での糖利用抑制、インスリン分泌抑制による血糖上昇作用を有する。 |
| グルカゴン | 血糖降下作用の減弱による高血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | 糖新生亢進、肝グリコーゲン分解促進による血糖上昇作用を有する。 |
| 甲状腺ホルモン レボチロキシンナトリウム水和物 | 血糖降下作用の減弱による高血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | 糖新生亢進、肝グリコーゲン分解促進による血糖上昇作用を有する。 |
| 成長ホルモン ソマトロピン | 血糖降下作用の減弱による高血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | 抗インスリン様作用による血糖上昇作用を有する。 |
| 卵胞ホルモン エチニルエストラジオール 結合型エストロゲン | 血糖降下作用の減弱による高血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | 末梢組織でインスリンの作用に拮抗する。 |
| 経口避妊薬 | 血糖降下作用の減弱による高血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | 末梢組織でインスリンの作用に拮抗する。 |
| ニコチン酸 | 血糖降下作用の減弱による高血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | 末梢組織でのインスリン感受性を低下させるため耐糖能障害を起こす。 |
| 濃グリセリン | 血糖降下作用の減弱による高血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | 代謝されて糖になるため、血糖値が上昇する。 |
| イソニアジド | 血糖降下作用の減弱による高血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | 炭水化物代謝を阻害することによる血糖上昇作用を有する。 |
| ダナゾール | 血糖降下作用の減弱による高血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | インスリン抵抗性を増強するおそれがある。 |
| フェニトイン | 血糖降下作用の減弱による高血糖症状があらわれることがある。併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | インスリン分泌抑制作用を有する。 |
| 蛋白同化ステロイド メテノロン | 血糖降下作用の増強による低血糖症状[11.1.1参照]、又は減弱による高血糖症状があらわれることがある。 併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | 機序不明 |
| ソマトスタチンアナログ製剤 オクトレオチド酢酸塩 ランレオチド酢酸塩 | 血糖降下作用の増強による低血糖症状[11.1.1参照]、又は減弱による高血糖症状があらわれることがある。 併用する場合は血糖値その他患者の状態を十分観察しながら投与すること。 | インスリン、グルカゴン及び成長ホルモン等互いに拮抗的に調節作用をもつホルモン間のバランスが変化することがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 低血糖(頻度不明)
脱力感、倦怠感、高度の空腹感、冷汗、顔面蒼白、動悸、振戦、頭痛、めまい、嘔気、視覚異常、不安、興奮、神経過敏、集中力低下、精神障害、痙攣、意識障害(意識混濁、昏睡)等があらわれることがある。無処置の状態で続くと低血糖昏睡等を起こし、重篤な転帰(中枢神経系の不可逆的障害、死亡等)をとるおそれがある。
また、長期にわたる糖尿病、糖尿病性神経障害、β-遮断剤投与あるいは強化インスリン療法が行われている場合では、低血糖の初期の自覚症状(冷汗、振戦等)が通常と異なる場合や、自覚症状があらわれないまま、低血糖あるいは低血糖性昏睡に陥ることがある。
症状が認められた場合には糖質を含む食品を摂取する等、適切な処置を行うこと。α-グルコシダーゼ阻害薬との併用時にはブドウ糖を投与すること。経口摂取が不可能な場合はブドウ糖を静脈内に、グルカゴンを筋肉内に投与する等適切な処置を行うこと。
本剤の作用は持続的であるため、回復が遅延するおそれがある。低血糖は臨床的に回復した場合にも再発することがあるので継続的に観察すること。[2.2、8.3、8.4、9.1.4、9.2.1、9.3.1、9.8、10.2、17.1参照]
また、長期にわたる糖尿病、糖尿病性神経障害、β-遮断剤投与あるいは強化インスリン療法が行われている場合では、低血糖の初期の自覚症状(冷汗、振戦等)が通常と異なる場合や、自覚症状があらわれないまま、低血糖あるいは低血糖性昏睡に陥ることがある。
症状が認められた場合には糖質を含む食品を摂取する等、適切な処置を行うこと。α-グルコシダーゼ阻害薬との併用時にはブドウ糖を投与すること。経口摂取が不可能な場合はブドウ糖を静脈内に、グルカゴンを筋肉内に投与する等適切な処置を行うこと。
本剤の作用は持続的であるため、回復が遅延するおそれがある。低血糖は臨床的に回復した場合にも再発することがあるので継続的に観察すること。[2.2、8.3、8.4、9.1.4、9.2.1、9.3.1、9.8、10.2、17.1参照]
11.1.2 アナフィラキシーショック(頻度不明)
呼吸困難、血圧低下、頻脈、発汗、全身の発疹、血管神経性浮腫等が認められた場合には投与を中止すること。
11.1.3 膵炎(頻度不明)
11.1.4 イレウス(頻度不明)
腸閉塞を含むイレウスを起こすおそれがある。高度の便秘、腹部膨満、持続する腹痛、嘔吐等の異常が認められた場合には投与を中止すること。[9.1.1参照]
11.1.5 胆嚢炎、胆管炎、胆汁うっ滞性黄疸(いずれも頻度不明)[8.9参照]
11.2 その他の副作用
| 5%以上 | 0.8〜5%未満 | 頻度不明 | |
| 血液及びリンパ系障害 | 貧血 | ||
| 免疫系障害 | 過敏症 | ||
| 内分泌障害 | 甲状腺腫瘤 | ||
| 代謝及び栄養障害 | 食欲減退 | 脱水、高脂血症、抗インスリン抗体産生に伴う血糖コントロール不良 | |
| 神経系障害 | 頭痛、浮動性めまい、感覚鈍麻、味覚異常 | ||
| 眼障害 | 糖尿病性網膜症 | ||
| 心臓障害 | 心拍数増加注)、心室性期外収縮 | ||
| 血管障害 | 高血圧 | ||
| 呼吸器、胸郭及び縦隔障害 | 咳嗽 | ||
| 胃腸障害 | 便秘 | 悪心、下痢、腹部不快感、嘔吐、腹部膨満、胃食道逆流性疾患、胃炎、消化不良 | 腹痛、鼓腸、おくび、胃排出遅延 |
| 肝胆道系障害 | 肝機能異常(AST、ALTの上昇 等)、胆石症 | ||
| 皮膚及び皮下組織障害 | じん麻疹、そう痒症、発疹、リポジストロフィー(皮下脂肪の萎縮・肥厚 等)、皮膚アミロイドーシス | ||
| 全身障害及び投与部位の状態 | 注射部位反応 | 倦怠感、胸痛、浮腫、疲労 | |
| 臨床検査 | 体重増加、膵酵素(リパーゼ、アミラーゼ)増加、遊離脂肪酸減少、血中プロインスリン減少、インスリンCペプチド減少 | 体重減少、血中ケトン体増加 |
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 投与時
(1)本剤はJIS T 3226-2に準拠したA型専用注射針を用いて使用すること。
本剤はA型専用注射針との適合性の確認をペンニードルで行っている。
本剤はA型専用注射針との適合性の確認をペンニードルで行っている。
(2)本剤とA型専用注射針との装着時に液漏れ等の不具合が認められた場合には、新しい注射針に取り替える等の処置方法を患者に十分指導すること。
(3)1本の本剤を複数の患者に使用しないこと。
14.1.2 投与部位
皮下注射は、腹部、大腿、上腕に行う。同じ部位に注射を行う場合は、その中で注射箇所を毎回変えること。前回の注射箇所より2〜3cm離して注射すること。[8.14参照]
14.1.3 投与経路
静脈内及び筋肉内に投与しないこと。皮下注射したとき、まれに注射針が血管内に入り、注射後直ちに低血糖があらわれることがあるので注意すること。
14.1.4 その他
(1)本剤と他の薬剤を混合しないこと。本剤は他の薬剤との混合により、成分が分解するおそれがある。
(2)注射後注射針を廃棄すること。注射針は毎回新しいものを、必ず注射直前に取り付けること。
(3)カートリッジに薬液を補充してはならない。
(4)カートリッジにひびが入っている場合は使用しないこと。
(5)液に濁りが生じたり、変色している場合は、使用しないこと。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 インスリン製剤又は経口糖尿病薬の投与中にアンジオテンシン変換酵素阻害剤を投与することにより、低血糖が起こりやすいとの報告がある1)。
15.1.2 本剤とピオグリタゾンを併用する場合には、浮腫及び心不全の徴候を十分観察しながら投与すること。ピオグリタゾンをインスリンと併用した場合、浮腫が多く報告されている。
15.1.3 本剤とワルファリンを併用する場合には、PT-INR等のモニタリングの実施等を考慮すること。GLP-1受容体作動薬とワルファリンとの併用時にPT-INR増加の報告がある。
15.2 非臨床試験に基づく情報
15.2.1 リラグルチドのラット及びマウスにおける2年間がん原性試験において、非致死性の甲状腺C細胞腫瘍が認められた。甲状腺髄様癌の既往のある患者及び甲状腺髄様癌又は多発性内分泌腫瘍症2型の家族歴のある患者に対する、リラグルチドの安全性は確立していない。[8.8参照]
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人における単回投与後の薬物動態
外国人健康成人男性(24例)を対象に、本剤を17ドーズ単回投与したときの薬物動態パラメータを検討した結果、Cmax及びAUCinf(幾何平均)は、インスリン デグルデクで1.339nmol/L及び50.231nmol・h/L、リラグルチドで3.943nmol/L及び136.859nmol・h/L、であった2)(外国人データ)。
16.1.2 日本人被験者における母集団薬物動態解析
日本人2型糖尿病患者を対象とした第III相臨床試験から得られた血中濃度データ(インスリン デグルデク:546例、3098点の濃度データ、リラグルチド:547例、3140点の濃度データ)を用いて構築した母集団薬物動態モデルに基づき、薬物動態パラメータを推定した結果、本剤を平均投与量である28.1ドーズ投与したときの定常状態におけるCmax及びAUC0-24h(幾何平均値)は、インスリン デグルデクで3.670nmol/L及び75nmol・h/L、リラグルチドで12.010nmol/L及び258nmol・h/Lと推定された3)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害被験者における薬物動態
(1)インスリン デグルデク
腎機能障害の程度の異なる被験者〔クレアチニンクリアランス(CCr)に基づく分類〕にインスリン デグルデク0.4単位/kgを単回投与したときの薬物動態の比較結果は、以下のとおりであった4)(外国人データ)。
| 腎機能 | AUC0-120h比 [90%信頼区間] | Cmax比 [90%信頼区間] |
| 軽度/正常 (軽度:CCr50以上〜80mL/min以下) | 1.12 [0.77;1.63] | 1.14 [0.81;1.61] |
| 中等度/正常 (中等度:CCr30以上〜50mL/min未満) | 1.12 [0.78;1.60] | 1.06 [0.76;1.49] |
| 重度/正常 (重度:CCr30mL/min未満) | 1.20 [0.83;1.74] | 1.23 [0.87;1.73] |
| 末期注)/正常 (末期:血液透析を必要とする患者) | 1.02 [0.74;1.40] | 1.05 [0.75;1.46] |
(2)リラグルチド
腎機能障害の程度の異なる被験者〔クレアチニンクリアランス(CCr)に基づく分類〕にリラグルチド0.75mgを単回投与したときの薬物動態の比較検討結果は、以下のとおりであった5)(外国人データ)。
| 腎機能 | AUC0-inf比 [90%信頼区間] | Cmax比 [90%信頼区間] |
| 軽度/正常 (軽度:CCr50超〜80mL/min以下) | 0.67 [0.54;0.85] | 0.75 [0.57;0.98] |
| 中等度/正常 (中等度:CCr30超〜50mL/min以下) | 0.86 [0.70;1.07] | 0.96 [0.74;1.23] |
| 重度/正常 (重度:CCr30mL/min以下) | 0.73 [0.57;0.94] | 0.77 [0.57;1.03] |
| 末期/正常 (末期:血液透析を必要とする患者) | 0.74 [0.56;0.97] | 0.92 [0.67;1.27] |
16.6.2 肝機能障害被験者における薬物動態
(1)インスリン デグルデク
肝機能障害の程度の異なる被験者(Child-Pugh scoresに基づく分類)にインスリン デグルデク0.4単位/kgを単回投与したときの薬物動態の比較結果は、以下のとおりであった6)(外国人データ)。
| 肝機能 | AUC0-120h比 [90%信頼区間] | Cmax比 [90%信頼区間] |
| 軽度/正常 〔軽度:Child-Pugh Grade A(5〜6ポイント)〕 | 0.95 [0.77;1.16] | 0.90 [0.67;1.20] |
| 中等度/正常 〔中等度:Child-Pugh Grade B(7〜9ポイント)〕 | 1.00 [0.82;1.22] | 0.77 [0.58;1.03] |
| 重度/正常 〔重度:Child-Pugh Grade C(10〜15ポイント)〕 | 0.92 [0.74;1.14] | 0.75 [0.55;1.02] |
(2)リラグルチド
肝機能障害の程度の異なる被験者(Child-Pugh scoresに基づく分類)にリラグルチド0.75mgを単回投与したときの薬物動態の比較結果は、以下のとおりであった7)(外国人データ)。
| 肝機能 | AUC0-inf比 [90%信頼区間] | Cmax比 [90%信頼区間] |
| 軽度/正常 〔軽度:Child-Pugh Grade A(5〜6ポイント)〕 | 0.77 [0.53;1.11] | 0.89 [0.65;1.21] |
| 中等度/正常 〔中等度:Child-Pugh Grade B(7〜9ポイント)〕 | 0.87 [0.60;1.25] | 0.80 [0.59;1.09] |
| 重度/正常 〔重度:Child-Pugh Grade C(10〜15ポイント)〕 | 0.56 [0.39;0.81] | 0.71 [0.52;0.97] |
16.7 薬物相互作用
本剤及びインスリン デグルデクの薬物相互作用の検討は実施していない。
リラグルチドの経口剤との薬物動態学的薬物相互作用は、リラグルチド1.8mg又はプラセボ反復投与後の定常状態において、パラセタモール、アトルバスタチン、グリセオフルビン、リシノプリル及びジゴキシンの単回投与後の薬物動態を比較し検討した。また、経口避妊薬中のエチニルエストラジオール及びレボノルゲストレルについても同様に検討した。両試験の結果を以下に示す(外国人データ)。
リラグルチドの経口剤との薬物動態学的薬物相互作用は、リラグルチド1.8mg又はプラセボ反復投与後の定常状態において、パラセタモール、アトルバスタチン、グリセオフルビン、リシノプリル及びジゴキシンの単回投与後の薬物動態を比較し検討した。また、経口避妊薬中のエチニルエストラジオール及びレボノルゲストレルについても同様に検討した。両試験の結果を以下に示す(外国人データ)。
| 経口薬 | 投与量 | N | AUC0-∞比 [90%信頼区間] | Cmax比 [90%信頼区間] | tmax差(h) [90%信頼区間] |
| パラセタモール | 1.0g | 18 | 1.04 [0.97;1.10] | 0.69 [0.56;0.85] | 0.25 [0.00;1.54] |
| アトルバスタチン | 40mg | 42 | 0.95 [0.89;1.01] | 0.62 [0.53;0.72] | 1.25 [1.00;1.50] |
| グリセオフルビン | 500mg | 22 | 1.10 [1.01;1.19] | 1.37 [1.24;1.51] | 0.00 [−7.00;2.00] |
| リシノプリル | 20mg | 40 | 0.85 [0.75;0.97] | 0.73 [0.63;0.85] | 2.00 [2.00;3.00] |
| ジゴキシン | 1mg | 27 | 0.84 [0.72;0.98]注) | 0.69 [0.60;0.79] | 1.125 [0.50;1.25] |
| エチニルエストラジオール | 0.03mg | 21 | 1.06 [0.99;1.13] | 0.88 [0.79;0.97] | 1.50 [1.00;2.50] |
| レボノルゲストレル | 0.15mg | 14 | 1.18 [1.04;1.34] | 0.87 [0.75;1.00] | 1.50 [0.50;2.00] |
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 インスリンによる治療を実施中の2型糖尿病患者におけるインスリン デグルデクとの比較試験(国内第III相試験)
経口糖尿病薬とインスリン製剤(Basalインスリン又は混合型/配合溶解インスリンのいずれか1剤を使用、1日投与量は20単位以上50単位以下)による治療で十分な血糖コントロールが得られていない2型糖尿病患者210例(本剤群:105例、インスリン デグルデク群:105例)を対象とし、26週間投与試験を実施した。本剤及びインスリン デグルデクは、メトホルミンの併用下で1日1回投与した。本剤及びインスリン デグルデクの推奨開始用量は10ドーズ及び10単位とし、低血糖又は高血糖の発現リスクを含めた各被験者の安全性を考慮し、16ドーズ及び16単位まで選択可能とした。投与期間中、本剤及びインスリン デグルデクの投与量は平均朝食前血糖値(血糖自己測定)に基づき、1週間に2回の頻度(1回の増減幅は+2から−2ドーズ及び+2から−2単位)で継続的に調節した。本剤及びインスリン デグルデクの最高用量は50ドーズ及び50単位とした。投与後26週の平均投与量は、本剤群で37.6ドーズ(用量範囲:10〜50ドーズ)、インスリン デグルデク群で41.2単位(用量範囲:10〜50単位)であった。HbA1cを指標とした血糖コントロールについて、本剤のインスリン デグルデクに対する優越性が検証された(p<0.0001)。空腹時血糖値(FPG)の低下量は両群で同程度であった。26週間の低血糖(血糖値が56mg/dL未満であった低血糖及び第三者による処置が必要な低血糖)及び夜間低血糖(低血糖のうち00:01から05:59に発現したもの)の患者あたりの年間発現件数は、両群で同程度であった8)。[7.2、11.1.1参照]
| 本剤(N=105) | インスリン デグルデク(N=105) | 差(本剤−インスリン デグルデク)の推定値[95%信頼区間] | |||
| ベースライン | 投与終了時 | ベースライン | 投与終了時 | ||
| 変化量 | 変化量 | ||||
| HbA1c(%) | 8.61±0.88 | 6.66±0.80 | 8.56±0.80 | 7.91±1.05 | −1.28[−1.50;−1.06] |
| −1.95±1.01 | −0.65±0.98 | ||||
| FPG(mg/dL) | 161.31±46.95 | 110.71±41.09 | 155.62±45.37 | 114.36±33.69 | −4.59[−14.62;5.44] |
| −50.60±57.16 | −41.26±48.29 | ||||
| 低血糖の患者あたりの年間発現件数(件/人・年)及び低血糖を発現した患者の割合(%) | |||||
| 低血糖注1) | 2.28(28.6%) | 2.09(30.5%) | − | ||
| 夜間低血糖注2) | 0.48(7.6%) | 0.36(9.5%) | − | ||
17.1.2 経口糖尿病薬単剤で治療中の2型糖尿病患者におけるインスリン デグルデク及びリラグルチドとの比較試験(国内第III相試験)
経口糖尿病薬単剤による治療で十分な血糖コントロールが得られていない2型糖尿病患者819例(本剤群:275例、インスリン デグルデク群:271例、リラグルチド群:273例)を対象とし、52週間投与試験を実施した。本剤、インスリン デグルデク及びリラグルチドは、経口糖尿病薬(メトホルミン、α-グルコシダーゼ阻害薬、チアゾリジン薬、スルホニルウレア薬、SGLT2阻害薬又は速効型インスリン分泌促進薬)の併用下で1日1回投与した。本剤及びインスリン デグルデクの推奨開始用量は10ドーズ及び10単位とした。投与期間中、本剤及びインスリン デグルデクの投与量は平均朝食前血糖値(血糖自己測定)に基づき、1週間に2回の頻度(1回の増減幅は+2から−2ドーズ及び2から−2単位)で継続的に調節した。本剤の最高用量は50ドーズとし、インスリン デグルデクは最高用量を設定しなかった。リラグルチドは0.3mgから開始し、1週間の間隔で0.3mgずつ漸増し、1.8mgまで増量した。投与後52週の平均投与量は、本剤群で27.7ドーズ(用量範囲:3.7〜50.0ドーズ)、インスリン デグルデク群で34.8単位(用量範囲:0〜186.0単位)であった。HbA1cを指標とした血糖コントロールについて、本剤のリラグルチドに対する優越性(p<0.0001)及びインスリン デグルデクに対する非劣性(非劣性マージン:0.3%)が検証された。本剤群の空腹時血糖値(FPG)の低下量は、インスリン デグルデク群と同程度であり、リラグルチド群と比較して大きかった。本剤群における52週間の低血糖(血糖値が56mg/dL未満であった低血糖及び第三者による処置が必要な低血糖)及び夜間低血糖(低血糖のうち00:01から05:59に発現したもの)の患者あたりの年間発現件数は、インスリン デグルデク群と比較して少なく、リラグルチド群と比較して多かった3)。[7.2、11.1.1参照]
| 本剤(N=275) | インスリン デグルデク(N=271) | リラグルチド(N=273) | 差の推定値 [95%信頼区間] | |||||
| ベースライン | 投与終了時 | ベースライン | 投与終了時 | ベースライン | 投与終了時 | 本剤−インスリン デグルデク | 本剤−リラグルチド | |
| 変化量 | 変化量 | 変化量 | ||||||
| HbA1c(%) | 8.52±1.12 | 6.10±0.72 | 8.53±1.05 | 6.73±0.79 | 8.32±0.99 | 6.52±0.86 | −0.63 [−0.75;−0.52] | −0.48 [−0.60;−0.37] |
| −2.42±1.04 | −1.80±1.02 | −1.80±0.92 | ||||||
| FPG(mg/dL) | 178.68±42.99 | 105.08±26.76 | 179.94±42.25 | 108.39±30.00 | 175.40±39.79 | 128.36±28.71 | −3.04 [−7.55;1.46] | −23.90 [−28.40;−19.39] |
| −73.60±44.58 | −71.55±46.05 | −47.14±35.12 | ||||||
| 低血糖の患者あたりの年間発現件数(件/人・年)及び低血糖を発現した患者の割合(%) | ||||||||
| 低血糖注1) | 1.74(38.5%) | 3.32(54.6%) | 0.05(2.2%) | − | − | |||
| 夜間低血糖注2) | 0.25(9.8%) | 0.50(16.6%) | 0(0%) | − | − | |||
17.2 製造販売後調査等
17.2.1 国内製造販売後データベース調査
国内の医療情報データベースを用い、2型糖尿病患者を対象に、GLP-1受容体作動薬(インスリン製剤との併用を含む)から本剤へ切り替えた際の重大な低血糖を評価した。GLP-1受容体作動薬(インスリン製剤との併用を含む)から本剤へ切り替えた新規使用患者(曝露群)は2,365例、その他の血糖降下薬から本剤へ切り替えた新規使用患者(対照群)は5,845例であった。重大な低血糖のリスクについて、対照群に対する曝露群の調整発生率比[95%信頼区間]は0.78[0.42,1.44]であった9)。
18. 薬効薬理
18.1 作用機序
本剤は、血糖コントロールを改善する作用機序を有するインスリン デグルデク及びリラグルチドの配合剤である。
(1)インスリン デグルデク
インスリン デグルデクは、製剤中では可溶性のダイヘキサマーとして存在するが、投与後、皮下組織において会合して、可溶性で安定なマルチヘキサマーを形成し、一時的に注射部皮下組織にとどまる。インスリン デグルデクモノマーはマルチヘキサマーから徐々に解離するため、投与部位から緩徐にかつ持続的に血中に吸収され、長い作用持続時間をもたらす。さらに、皮下注射部位及び血中で脂肪酸側鎖を介してアルブミンと結合し、作用の持続化に寄与する10)。
インスリン デグルデクの主な薬理作用は、グルコース代謝の調節である。インスリン デグルデクを含むインスリンは、インスリンレセプターに結合し、特異的な作用を発現する。インスリンレセプターに結合したインスリンは骨格筋及び脂肪細胞における糖の取り込みを促進し、また肝臓におけるグルコース産生を阻害することによって血糖値を降下させる。さらに、脂肪細胞における脂肪分解及び蛋白質分解を阻害し、蛋白質合成を促進する。
インスリン デグルデクの主な薬理作用は、グルコース代謝の調節である。インスリン デグルデクを含むインスリンは、インスリンレセプターに結合し、特異的な作用を発現する。インスリンレセプターに結合したインスリンは骨格筋及び脂肪細胞における糖の取り込みを促進し、また肝臓におけるグルコース産生を阻害することによって血糖値を降下させる。さらに、脂肪細胞における脂肪分解及び蛋白質分解を阻害し、蛋白質合成を促進する。
(2)リラグルチド
19. 有効成分に関する理化学的知見
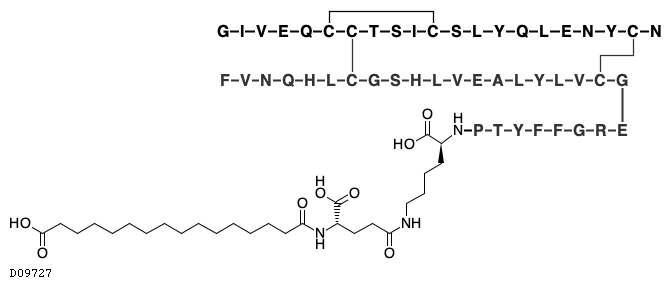
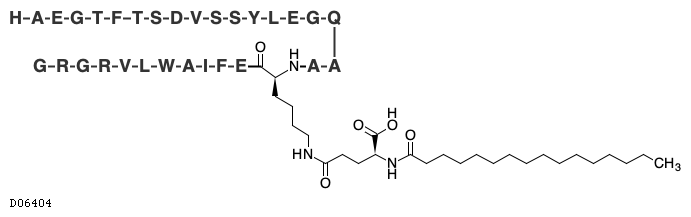
19.1. インスリン デグルデク(遺伝子組換え)
19.2. リラグルチド(遺伝子組換え)
20. 取扱い上の注意
使用中は室温(30℃以下)にキャップ等により遮光して保管し、3週間以内に使用すること。ただし、25℃以下の保管であれば、4週間以内に使用すること。冷蔵庫保管(2〜8℃)も可能であるが、凍結を避け、4週間以内に使用すること。
残った場合は廃棄すること。
残った場合は廃棄すること。
22. 包装
1筒3mL、2本
23. 主要文献
- Herings RMC,et al., Lancet., 345, 1195-8, (1995) »PubMed »DOI
- 社内資料、第I相臨床試験(NN9068-3632)(2019年6月18日承認、CTD 2.7.2.3)
- 社内資料、第III相臨床試験(NN9068-4183)(2019年6月18日承認、CTD 2.7.2.3及び2.7.6.4)
- Kiss I,et al., Clin Pharmacokinet., 53, 175-83, (2014) »PubMed »DOI
- 社内資料、ビクトーザ皮下注18mg第I相臨床試験(NN2211-1329)(2010年1月20日承認、CTD 2.7.6.14)
- Kupcova V,et al., Clin Drug Investig., 34, 127-33, (2014) »PubMed »DOI
- Flint A, Br J Clin Pharmacol., 70 (6), 807-14, (2010), (2010 Dec) »PubMed
- 社内資料、第III相臨床試験(NN9068-4184)(2019年6月18日承認、CTD 2.7.6.5)
- 社内資料、製造販売後データベース調査(NN9068-4474)(2025年9月16日通知、再審査申請資料概要1.4.2.3)
- Jonassen I,et al., Pharm Res., 29, 2104-14, (2012) »PubMed
- Holst JJ, Annu Rev Physiol., 59, 257-71, (1997) »PubMed
- Knudsen LB,et al., J Med Chem., 47, 4128-34, (2004) »PubMed
- Degn KB,et al., Diabetes., 53, 1187-94, (2004) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
ノボノルディスクファーマ株式会社
ノボケア相談室
〒100-0005
東京都千代田区丸の内2-1-1
電話:0120-180363(フリーダイアル)
製品情報問い合わせ先
ノボノルディスクファーマ株式会社
ノボケア相談室
〒100-0005
東京都千代田区丸の内2-1-1
電話:0120-180363(フリーダイアル)