医薬品情報
| 総称名 | ザファテック |
|---|---|
| 一般名 | トレラグリプチンコハク酸塩 |
| 欧文一般名 | Trelagliptin Succinate |
| 製剤名 | トレラグリプチンコハク酸塩錠 |
| 薬効分類名 | 持続性選択的DPP-4阻害剤 2型糖尿病治療剤 |
| 薬効分類番号 | 3969 |
| KEGG DRUG |
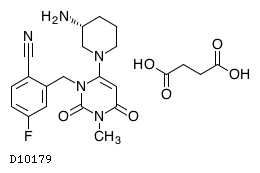
D10179
トレラグリプチンコハク酸塩
|
| KEGG DGROUP |
DG01601
DPP-4阻害薬
DG02044
血糖降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(再審査結果)(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ザファテック錠100mg | Zafatek Tablets 100mg | 帝人ファーマ | 3969024F2024 | 806.9円/錠 | 処方箋医薬品注) |
| ザファテック錠50mg | Zafatek Tablets 50mg | 帝人ファーマ | 3969024F1028 | 420.7円/錠 | 処方箋医薬品注) |
| ザファテック錠25mg | Zafatek Tablets 25mg | 帝人ファーマ | 3969024F3020 | 226円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 重症ケトーシス、糖尿病性昏睡又は前昏睡、1型糖尿病の患者[輸液、インスリンによる速やかな高血糖の是正が必須となるので本剤の投与は適さない。]
2.2 重症感染症、手術前後、重篤な外傷のある患者[インスリン注射による血糖管理が望まれるので本剤の投与は適さない。]
2.3 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
本剤の適用はあらかじめ糖尿病治療の基本である食事療法、運動療法を十分に行ったうえで効果が不十分な場合に限り考慮すること。
6. 用法及び用量
通常、成人にはトレラグリプチンとして100mgを1週間に1回経口投与する。
7. 用法及び用量に関連する注意
7.1 中等度以上の腎機能障害患者では、排泄の遅延により本剤の血中濃度が上昇するため、腎機能の程度に応じて、下表を参考に投与量を減量すること。[9.2.1、9.8、16.6.1参照]
| 血清クレアチニン(mg/dL)注1) | クレアチニンクリアランス(Ccr,mL/min) | 投与量 | |
| 中等度腎機能障害患者 | 男性:1.4<〜≦2.4 女性:1.2<〜≦2.0 | 30≦〜<50 | 50mg、週1回 |
| 高度腎機能障害患者/末期腎不全患者注2) | 男性:>2.4 女性:>2.0 | <30 | 25mg、週1回 |
7.2 投与にあたっては次の点を患者に指導すること。
・本剤は週1回服用する薬剤であり、同一曜日に服用すること。
・本剤の服用を忘れた場合は、気づいた時点で決められた用量のみを服用し、その後はあらかじめ定められた曜日に服用すること。
8. 重要な基本的注意
8.2 急性膵炎があらわれることがあるので、持続的な激しい腹痛、嘔吐等の初期症状があらわれた場合には、速やかに医師の診察を受けるよう患者に指導すること。[11.1.3参照]
8.3 本剤は1週間に1回経口投与する薬剤であり、投与中止後も作用が持続するので、血糖値や副作用の発現について十分留意すること。
また、本剤投与中止後に他の糖尿病用薬を使用するときは、血糖管理状況等を踏まえ、その投与開始時期及び用量を検討すること。[16.1.1、16.1.2、18.2.2参照]
また、本剤投与中止後に他の糖尿病用薬を使用するときは、血糖管理状況等を踏まえ、その投与開始時期及び用量を検討すること。[16.1.1、16.1.2、18.2.2参照]
8.4 本剤投与中は、血糖を定期的に検査するとともに、経過を十分に観察し、本剤を2〜3ヵ月投与しても効果が不十分な場合には、より適切と考えられる治療への変更を考慮すること。
8.5 低血糖症状を起こすことがあるので、高所作業、自動車の運転等に従事している患者に投与するときには注意すること。[11.1.1参照]
8.6 本剤とGLP-1受容体作動薬はいずれもGLP-1受容体を介した血糖降下作用を有している。両剤を併用した際の臨床試験成績はなく、有効性及び安全性は確認されていない。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.2 腎機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物試験(ラット)において、胎盤通過が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物試験(ラット)で乳汁中へ移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
10. 相互作用
10.2 併用注意
| 糖尿病用薬 スルホニルウレア剤 速効型インスリン分泌促進薬 α-グルコシダーゼ阻害剤 ビグアナイド系薬剤 チアゾリジン系薬剤 GLP-1受容体作動薬 SGLT2阻害剤 インスリン製剤 [11.1.1参照] | 低血糖を発現するおそれがある。特に、スルホニルウレア剤又はインスリン製剤と併用する場合、低血糖のリスクが増加するため、これらの薬剤の減量を検討すること。 | 併用により血糖降下作用が増強するおそれがある。 |
| 糖尿病用薬の血糖降下作用を増強する薬剤 β-遮断薬 サリチル酸製剤 モノアミン酸化酵素阻害薬 フィブラート系の高脂血症治療薬 等 | 血糖が低下するおそれがある。 | 併用により血糖降下作用が増強するおそれがある。 |
| 糖尿病用薬の血糖降下作用を減弱する薬剤 アドレナリン 副腎皮質ホルモン 甲状腺ホルモン 等 | 血糖が上昇するおそれがある。 | 併用により血糖降下作用が減弱するおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 低血糖(0.1〜5%未満)
11.1.2 類天疱瘡(頻度不明)
水疱、びらん等があらわれた場合には、皮膚科医と相談し、投与を中止するなど適切な処置を行うこと。
11.1.3 急性膵炎(頻度不明)
持続的な激しい腹痛、嘔吐等の異常が認められた場合には投与を中止し、適切な処置を行うこと。[8.2参照]
11.1.4 イレウス(頻度不明)
腸閉塞を含むイレウスを起こすおそれがある。高度の便秘、腹部膨満、持続する腹痛、嘔吐等の異常が認められた場合には投与を中止し、適切な処置を行うこと。[9.1.2参照]
11.2 その他の副作用
| 0.1〜5%未満 | |
| 過敏症 | 発疹、そう痒 |
| 循環器 | 心房細動 |
| 肝臓 | ALT上昇、AST上昇、γ-GTP上昇 |
| その他 | 血中アミラーゼ上昇、リパーゼ上昇、CK上昇、尿潜血陽性、鼻咽頭炎 |
13. 過量投与
13.1 処置
本剤は血液透析による除去は、有用ではないと考えられる[16.6.1参照]
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
海外臨床試験においてトレラグリプチンとして800mg注)を単回投与したときにQT延長が報告されている。[17.3.1参照]
注)本剤の承認用法・用量は、通常、トレラグリプチンとして100mgを1週間に1回経口投与である。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
16.1.2 反復投与
健康成人(9例)にトレラグリプチンとして100mgを朝食開始30分前に1日1回単回経口投与注1)し、その3日後から朝食開始30分前に1日1回11日間反復投与した時、投与1日目のCmax及びAUC(0-inf)の平均値(標準偏差)はそれぞれ544.3(122.0)ng/mL及び5,572.3(793.2)ng・h/mL、投与14日目のCmax及びAUC(0-tau)の平均値(標準偏差)はそれぞれ602.6(149.5)ng/mL及び5,292.9(613.8)ng・h/mLであった2)。[8.3参照]
注1)本剤の承認用法・用量は、通常、トレラグリプチンとして100mgを1週間に1回経口投与である。
16.2 吸収
健康成人(12例)にトレラグリプチンとして100mgを朝食開始30分後に経口投与した時のCmax及びAUC(0-inf)は、朝食絶食下に投与した時と比較して、それぞれ16.8%増加、2.5%減少した3)。
16.3 分布
[14C]トレラグリプチンを0.1〜10μg/mLの濃度でヒト血漿に添加した時の蛋白結合率は、22.1〜27.6%であった(in vitro)4)。
16.4 代謝
16.4.2 トレラグリプチンはCYP3A4/5に対して弱い阻害作用を示したが(直接阻害作用IC50値:100μmol/L以上、代謝由来阻害作用IC50値:12μmol/L(ミダゾラム1'-水酸化活性)及び28μmol/L(テストステロン6β-水酸化活性))、CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19及びCYP2D6を阻害せず、CYP1A2、CYP2B6及びCYP3A4を誘導しなかった(in vitro)5)。
16.5 排泄
16.5.1 健康成人(12例)にトレラグリプチンとして100mgを朝食絶食下又は朝食開始30分後に単回経口投与した時、投与168時間までのトレラグリプチンの累積尿中排泄率は、それぞれ76.6%、76.1%であった3)。
16.5.2 トレラグリプチンはP-糖蛋白質の基質であり、P-糖蛋白質を介するジゴキシンの輸送をわずかに阻害した(IC50値:500μmol/L以上)。また、トレラグリプチンは有機カチオントランスポーターOCT2の基質であるメトホルミンの取り込みに対して阻害作用を示した(IC50値:55.9μmol/L)(in vitro)7)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能障害者及び健康成人にトレラグリプチンとして50mgを単回経口投与した時注1)のAUC(0-tlqc)及びCmaxは、年齢、性別、人種及び体重を対応させた健康成人と比較して軽度腎機能障害者(Ccr=50〜80mL/min、6例)で55.7%増加、36.3%増加、中等度腎機能障害者(Ccr=30〜50mL/min、6例)で105.7%増加、12.9%増加、高度腎機能障害者(Ccr<30mL/min、6例)で201.4%増加、9.1%増加、末期腎不全患者(6例)で268.1%増加、13.8%低下した。また、トレラグリプチンは4時間の血液透析で投与量の9.2%が除去された8)(外国人データ)。[7.1、9.2.1、9.8、13.1参照]
注1)本剤の承認用法・用量は、通常、トレラグリプチンとして100mgを1週間に1回経口投与である。
16.6.2 肝機能障害患者
中等度肝機能障害者(Child-Pugh注2)スコアが7〜9、8例)及び健康成人(8例)にトレラグリプチンとして50mgを単回経口投与した時注1)のAUC(0-inf)及びCmaxは、年齢、性別、人種、喫煙歴及び体重を対応させた健康成人と比較して5.1%増加、4.3%減少した9)(外国人データ)。
注1)本剤の承認用法・用量は、通常、トレラグリプチンとして100mgを1週間に1回経口投与である。
注2)ビリルビン、アルブミン、PT又はINR、肝性脳症、腹水症の状態からスコア化する分類
16.7 薬物相互作用
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 単独療法
(1)国内第II相試験(二重盲検比較試験)
食事療法、運動療法を実施しても血糖コントロールが不十分な2型糖尿病患者を対象にトレラグリプチンとして100mg(週1回朝食前)を12週間経口投与した。治療期終了時のHbA1c(NGSP値)の投与前からの変化量の調整済み平均値(標準誤差)は、トレラグリプチン100mg群(55例、解析対象集団)で−0.54(0.068)%、プラセボ群(55例、解析対象集団)で0.35(0.068)%であり、トレラグリプチン100mg群でプラセボ群と比べ有意なHbA1cの低下が認められた〔投与前のHbA1c(NGSP値)を共変量とした共分散分析モデルに基づく、対比検定による対比較:p<0.0001〕。なお、投与前のHbA1c(NGSP値)の平均値(標準偏差)はトレラグリプチン100mg群で8.41(0.97)%、プラセボ群で8.15(0.95)%であった13)。
副作用の発現頻度はトレラグリプチン100mg群で9.1%(5/55例)であり、低血糖の副作用はみられなかった。[11.1.1参照]
(2)国内第III相検証試験
食事療法、運動療法を実施しても血糖コントロールが不十分な2型糖尿病患者を対象にトレラグリプチンとして100mg(週1回朝食前)、アログリプチンとして25mg(1日1回朝食前)を24週間経口投与した結果は下表のとおりであり、治療期終了時のHbA1c(NGSP値)の投与前からの変化量の調整済み平均値の群間差において、トレラグリプチン100mg群のアログリプチン25mg群に対する非劣性(許容限界:0.40%)が検証された。なお、投与前のHbA1c(NGSP値)の平均値(標準偏差)はトレラグリプチン100mg群で7.73(0.85)%、アログリプチン25mg群で7.87(0.86)%であった14)。
副作用の発現頻度はトレラグリプチン100mg群で5.0%(5/101例)であり、低血糖の副作用はみられなかった。低血糖以外の主な副作用は脂質異常症2.0%(2/101例)であった。[11.1.1参照]
| 投与群 | HbA1c(NGSP値)注1)(%) | 空腹時血糖値注2)(mg/dL) | 食後血糖2時間値注2)(mg/dL) | |||
| 投与前からの変化量 | アログリプチンとの差 | 投与前からの変化量 | アログリプチンとの差 | 投与前からの変化量 | アログリプチンとの差 | |
| アログリプチン25mg(n=92) | −0.45(0.06) | 0.11[−0.05,0.28] | −14.9(27.0) | 8.6[1.7,15.5] | −29.2(42.2) | 12.1[−0.9,25.1] |
| トレラグリプチン100mg(n=101) | −0.33(0.06) | −6.4(21.2) | −17.2(47.7) | |||
(3)国内第III相長期投与試験
食事療法、運動療法を実施しても血糖コントロールが不十分な2型糖尿病患者(248例、解析対象集団)を対象にトレラグリプチンとして100mg(週1回朝食前)を52週間経口投与した。治療期終了時のHbA1c(NGSP値)の投与前からの変化量の平均値(標準偏差)は−0.57(0.88)%であり、52週にわたって安定した血糖コントロールが得られた。なお、投与前のHbA1c(NGSP値)の平均値(標準偏差)は7.87(0.87)%であった15)。
副作用の発現頻度は15.7%(39/248例)であり、低血糖の副作用発現頻度は0.4%(1/248例)であった。
低血糖以外の主な副作用は鼻咽頭炎3.2%(8/248例)、便秘、血中クレアチンホスホキナーゼ増加及びリパーゼ増加が各1.6%(4/248例)、発疹1.2%(3/248例)であった。[11.1.1参照]
低血糖以外の主な副作用は鼻咽頭炎3.2%(8/248例)、便秘、血中クレアチンホスホキナーゼ増加及びリパーゼ増加が各1.6%(4/248例)、発疹1.2%(3/248例)であった。[11.1.1参照]
(4)国内第III相非盲検試験
食事療法、運動療法に加え、既存のDPP-4阻害剤を1日1回投与している2型糖尿病患者(14例、解析対象集団)を対象に、トレラグリプチンとして100mg(週1回朝食前)に変更後12週間経口投与した。結果は下表のとおりであった16)。
副作用の発現頻度は7.1%(1/14例)であり、低血糖の副作用はみられなかった。[11.1.1参照]
| 変更前値 | 変更前からの変化量 | |
| 朝食後血糖2時間値(mg/dL) | 202.1(38.3) | −8.7(25.4)注) |
| 空腹時血糖値(mg/dL) | 140.5(23.3) | −1.6(13.9) |
| HbA1c(NGSP値)(%) | 7.06(0.49) | 0.04(0.36) |
17.1.2 併用療法
(1)国内第III相長期投与試験(経口血糖降下薬併用試験)
食事療法、運動療法に加え経口血糖降下薬を併用しても血糖コントロールが不十分な2型糖尿病患者を対象にトレラグリプチンとして100mg(週1回朝食前)を52週間投与した結果は下表のとおりであり、52週にわたって安定した血糖コントロールが得られた15)。
副作用の発現頻度は、スルホニルウレア系薬剤併用で10.8%(17/158例)、速効型インスリン分泌促進剤併用で11.9%(8/67例)、α-グルコシダーゼ阻害剤併用で6.2%(4/65例)、ビグアナイド系薬剤併用で11.4%(8/70例)及びチアゾリジン系薬剤併用で13.9%(10/72例)であった。低血糖の副作用発現頻度は、スルホニルウレア系薬剤併用で3.2%(5/158例)、速効型インスリン分泌促進剤併用で1.5%(1/67例)、ビグアナイド系薬剤併用で1.4%(1/70例)、チアゾリジン系薬剤併用で1.4%(1/72例)であり、α-グルコシダーゼ阻害剤併用ではみられなかった。低血糖以外の主な副作用はスルホニルウレア系薬剤併用でリパーゼ増加1.3%(2/158例)、速効型インスリン分泌促進剤併用で湿疹3.0%(2/67例)並びにチアゾリジン系薬剤併用でアラニンアミノトランスフェラーゼ増加及びアスパラギン酸アミノトランスフェラーゼ増加が各2.8%(2/72例)であった。[11.1.1参照]
| HbA1c(NGSP値)(%) | ||
| 投与前値 | 投与前からの変化量 | |
| スルホニルウレア系薬剤併用例(n=158) | 8.09(0.84) | −0.37(0.90) |
| 速効型インスリン分泌促進剤併用例(n=67) | 7.87(0.78) | −0.25(0.78) |
| α-グルコシダーゼ阻害剤併用例(n=65) | 8.07(0.98) | −0.67(0.74) |
| ビグアナイド系薬剤併用例(n=70) | 7.82(0.94) | −0.31(0.82) |
| チアゾリジン系薬剤併用例(n=72) | 7.91(0.96) | −0.74(0.65) |
17.1.3 高度腎機能障害又は末期腎不全を合併する2型糖尿病
(1)国内第III相二重盲検試験
食事療法、運動療法を実施しても、又は食事療法、運動療法に加え、速効型インスリン分泌促進剤、α-グルコシダーゼ阻害剤又はインスリン製剤を投与してもなお血糖コントロールが不十分な高度腎機能障害又は末期腎不全を合併する2型糖尿病患者を対象にトレラグリプチンとして25mg(週1回朝食前)を12週間投与した。結果は下表のとおりであった。なお、投与前のHbA1c(NGSP値)の平均値(標準偏差)はトレラグリプチン25mg群で7.57(0.85)%、プラセボ群で7.74(1.05)%であった17)。
副作用発現頻度はトレラグリプチン25mg群で18.2%(10/55例)であった。低血糖の副作用発現頻度は、12.7%(7/55例)であった。[11.1.1参照]
| 投与群 | HbA1c(NGSP値)(%) | |
| 投与前からの変化量 | プラセボとの差 | |
| プラセボ(n=52) | 0.01(0.09) | −0.72注)[−0.97,−0.47] |
| トレラグリプチン25mg(n=55) | −0.71(0.09) | |
(2)国内第III相長期投与試験
二重盲検期終了後、プラセボからトレラグリプチン25mgへの切り替え群を含め、トレラグリプチン25mg継続投与において、52週にわたって安定した血糖コントロールが得られた。継続非盲検長期投与期終了時におけるHbA1c(NGSP値)の投与前からの変化量の平均値(標準偏差)はトレラグリプチン25mg継続投与群で−0.76(0.82)%、切り替え群で−0.74(0.84)%であった17)。
継続非盲検長期投与期終了までの副作用発現頻度は、トレラグリプチン25mg継続投与群で23.6%(13/55例)及び切り替え群で12.5%(6/48例)であった。低血糖の副作用発現頻度は、トレラグリプチン25mg継続投与群で18.2%(10/55例)及び切り替え群で10.4%(5/48例)であった。[11.1.1参照]
17.2 製造販売後調査等
17.2.1 併用療法
(1)国内第IV相二重盲検試験(インスリン製剤併用試験)
食事療法、運動療法に加え、インスリン製剤〔混合型(速効型又は超速効型のインスリン含有率が30%以下)、中間型、持効型溶解のいずれか単剤を使用、1日投与量は8単位以上40単位以下、原則として二重盲検期を通して変更しない〕を投与しても血糖コントロールが不十分な2型糖尿病患者を対象にトレラグリプチンとして100mg(週1回朝食前)を12週間投与した。結果は下表のとおりであった。なお、投与前のHbA1c(NGSP値)の平均値(標準偏差)はトレラグリプチン100mg併用群で8.42(0.68)%、インスリン製剤単独群で8.50(0.68)%であった18)。
副作用発現頻度はトレラグリプチン100mg併用群で10.3%(12/116例)であり、低血糖の副作用発現頻度は7.8%(9/116例)であった。[11.1.1参照]
| 投与群 | HbA1c(NGSP値)(%) | |
| 投与前からの変化量 | インスリン製剤単独との差 | |
| インスリン製剤単独(n=124) | 0.07(0.07) | −0.63注)[−0.83,−0.44] |
| トレラグリプチン100mg併用(n=116) | −0.56(0.07) | |
(2)国内第IV相長期投与試験(インスリン製剤併用試験)
二重盲検期終了後、インスリン製剤単独投与からトレラグリプチン100mg併用への切り替え群を含め、トレラグリプチン100mg継続投与において、52週にわたって安定した血糖コントロールが得られた。継続非盲検長期投与期終了時におけるHbA1c(NGSP値)の投与前からの変化量の平均値(標準偏差)はトレラグリプチン100mg継続併用群で−0.43(0.83)%、切り替え群で−0.60(0.83)%であった18)。
継続非盲検長期投与期終了までの副作用発現頻度は、トレラグリプチン100mg継続併用群で15.5%(18/116例)及び切り替え群で16.8%(20/119例)であった。低血糖の副作用発現頻度は、トレラグリプチン100mg継続併用群で12.9%(15/116例)、切り替え群で10.9%(13/119例)であった。[11.1.1参照]
17.3 その他
17.3.1 心電図に対する影響
(1)海外第I相試験(QT/QTc評価試験)
18. 薬効薬理
18.1 作用機序
トレラグリプチンは食事の経口摂取刺激により腸管から血中に分泌されるグルカゴン様ペプチド-1(GLP-1)を不活性化するジペプチジルペプチダーゼ-4(DPP-4)活性を阻害することにより、GLP-1の血中濃度を上昇させ、糖濃度依存的に膵臓からのインスリン分泌を促進させる20)。
18.2 DPP-4に対する阻害作用
18.2.1 ヒト血漿中DPP-4活性を選択的に阻害した(IC50値:4.2nmol/L)(in vitro)。また、トレラグリプチン及びアログリプチンのDPP-4阻害活性を比較するため、同一条件下(in vitro)でIC50値(nmol/L)を比較したところ、それぞれ1.3及び5.3であった21)。
18.3 活性型GLP-1濃度増加作用
食事療法、運動療法を実施しても血糖コントロールが不十分な2型糖尿病患者を対象にトレラグリプチンとして100mgを12週間経口投与(週1回朝食前)したプラセボ対照二重盲検並行群間比較試験において、投与12週後の食事負荷試験における活性型GLP-1濃度はプラセボ群と比べて有意に増加した13)。
18.4 耐糖能改善作用
一晩絶食した肥満2型糖尿病モデル(Wistar fattyラット)及び非肥満2型糖尿病モデル(N-STZ-1.5ラット)にトレラグリプチンを単回経口投与し、投与1時間後にグルコースを経口投与した糖負荷試験において耐糖能改善作用が認められた20)。
19. 有効成分に関する理化学的知見
19.1. トレラグリプチンコハク酸塩
22. 包装
<ザファテック錠100mg>
患者さん用パッケージ付PTP
20錠(2錠シート×10)
<ザファテック錠50mg>
患者さん用パッケージ付PTP
20錠(2錠シート×10)
<ザファテック錠25mg>
患者さん用パッケージ付PTP
20錠(2錠シート×10)
23. 主要文献
- トレラグリプチンの薬物動態試験成績[1](2015年3月26日承認:CTD 2.7.6.3)
- トレラグリプチンの薬物動態試験成績[2](2015年3月26日承認:CTD 2.7.6.4)
- トレラグリプチンの薬物動態試験成績[3](2015年3月26日承認:CTD 2.7.6.1)
- トレラグリプチンの蛋白結合に関する検討(2015年3月26日承認:CTD 2.6.4.4)
- トレラグリプチンの代謝に関する検討(2015年3月26日承認:CTD 2.6.4.5)
- トレラグリプチンの臨床試験成績[1](2015年3月26日承認:CTD 2.7.2.1)
- トレラグリプチンの排泄に関する検討(2015年3月26日承認:CTD 2.7.2.2)
- 腎機能障害患者における薬物動態試験成績(2015年3月26日承認:CTD 2.7.6.8)
- 肝機能障害患者における薬物動態試験成績(2015年3月26日承認:CTD 2.7.6.9)
- グリメピリドとの薬物間相互作用試験成績(2015年3月26日承認:CTD 2.7.6.10)
- メトホルミンとの薬物間相互作用試験成績(2015年3月26日承認:CTD 2.7.6.11)
- カフェイン、トルブタミド、デキストロメトルファン、ミダゾラムとの薬物間相互作用試験成績(2015年3月26日承認:CTD 2.7.6.12)
- トレラグリプチンの臨床試験成績[2](2015年3月26日承認:CTD 2.7.6.13)
- トレラグリプチンの臨床試験成績[3](2015年3月26日承認:CTD 2.7.6.16)
- トレラグリプチンの臨床試験成績[4](2015年3月26日承認:CTD 2.7.6.17)
- トレラグリプチンの臨床試験成績[5](2015年3月26日承認:CTD 2.7.6.18)
- トレラグリプチンの臨床試験成績[6](2019年8月21日承認:CTD 2.7.6.2)
- 社内資料:トレラグリプチンの製造販売後臨床試験成績
- トレラグリプチンのQT/QTc間隔に関する検討(2015年3月26日承認:CTD 2.7.6.7)
- トレラグリプチンの耐糖能改善作用に関する検討(2015年3月26日承認:CTD 2.6.2.2)
- トレラグリプチンの酵素阻害活性に関する検討(2015年3月26日承認:CTD 2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
帝人ファーマ株式会社
メディカル情報グループ
〒100-8585
東京都千代田区霞が関3丁目2番1号
電話:フリーダイヤル 0120-189-315
製品情報問い合わせ先
帝人ファーマ株式会社
メディカル情報グループ
〒100-8585
東京都千代田区霞が関3丁目2番1号
電話:フリーダイヤル 0120-189-315
26. 製造販売業者等
26.1 製造販売元
帝人ファーマ株式会社
東京都千代田区霞が関3丁目2番1号
26.2 販売
武田薬品工業株式会社
〒540-8645
大阪市中央区道修町四丁目1番1号