医薬品情報
| 総称名 | ジカディア |
|---|---|
| 一般名 | セリチニブ |
| 欧文一般名 | Ceritinib |
| 製剤名 | セリチニブ錠 |
| 薬効分類名 | 抗悪性腫瘍剤 チロシンキナーゼ阻害剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L01ED02 |
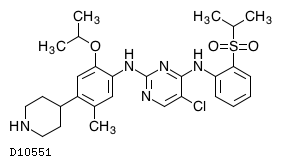
| KEGG DRUG |
D10551
セリチニブ
|
| KEGG DGROUP |
DG03136
ALK阻害薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年5月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ジカディア錠150mg | ZYKADIA tablets 150mg | ノバルティスファーマ | 4291044F1022 | 6413.6円/錠 | 劇薬, 処方箋医薬品 |
1. 警告
1.1 本剤は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本療法が適切と判断される症例についてのみ投与すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 次の薬剤を投与中の患者
ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)、再発又は難治性のマントル細胞リンパ腫の用量漸増期)[10.1参照]
4. 効能または効果
ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌
5. 効能または効果に関連する注意
5.1 十分な経験を有する病理医又は検査施設における検査により、ALK融合遺伝子陽性が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
5.2 本剤の術後補助化学療法における有効性及び安全性は確立していない。
6. 用法及び用量
通常、成人にはセリチニブとして450mgを1日1回、食後に経口投与する。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意
副作用により本剤を休薬、減量、中止する場合には、以下の基準を考慮すること。また、1日150mgで投与継続が困難な場合は、本剤を中止すること。[8.1-8.5、11.1.1-11.1.6参照]
| 基準注) | 本剤の投与量調節 | |
| 間質性肺疾患 | Gradeを問わない | 投与中止。 |
| 肝機能障害 | ・Grade 1以下のAST増加又はALT増加、かつGrade 2の血中ビリルビン増加 ・Grade 2又は3のAST増加又はALT増加、かつGrade 1以下の血中ビリルビン増加 | AST増加、ALT増加及び血中ビリルビン増加がGrade 1以下に回復するまで休薬する。投与再開時には、7日間以内に軽快した場合は休薬前と同じ投与量、7日間を超えて軽快した場合は投与量を150mg減量する。 |
| ・Grade 1以下のAST増加又はALT増加、かつGrade 3の血中ビリルビン増加 ・Grade 2以上のAST増加又はALT増加、かつ正常上限の1.5倍超、2倍以下の血中ビリルビン増加 | AST増加、ALT増加及び血中ビリルビン増加がGrade 1以下に回復するまで休薬する。7日間以内に軽快した場合は、投与量を150mg減量して投与再開する。7日間以内に軽快しない場合は、投与中止する。 | |
| ・Grade 4のAST増加又はALT増加、かつGrade 1以下の血中ビリルビン増加 | AST増加及びALT増加がGrade 1以下に回復するまで休薬する。投与再開時には、投与量を150mg減量する。 | |
| ・Grade 4の血中ビリルビン増加 ・Grade 2以上のAST増加又はALT増加、かつ正常上限の2倍超の血中ビリルビン増加 | 投与中止。 | |
| QT間隔延長 | QTc 500msec超が2回以上認められた場合 | ベースライン又は481msec未満に回復するまで休薬する。投与再開時には、投与量を150mg減量する。 |
| QTc 500msec超、又はベースラインからのQTc延長が60msec超、かつTorsade de pointes、多形性心室性頻脈又は重症不整脈の徴候・症状が認められた場合 | 投与中止。 | |
| 徐脈 | 症候性で治療を要する重篤な場合 | 無症候性又は心拍数が60bpm以上に回復するまで休薬する。投与再開時には、投与量を150mg減量する。 |
| 生命の危険があり緊急治療を要する場合 | 投与中止。 | |
| 悪心・嘔吐・下痢 | ・Grade 3以上 ・適切な制吐剤又は止瀉剤の使用にもかかわらずコントロールできない場合 | Grade 1以下に回復するまで休薬する。投与再開時には、投与量を150mg減量する。 |
| 高血糖 | 適切な治療を行っても250mg/dLを超える高血糖が持続する場合 | 血糖がコントロールできるまで休薬する。投与再開時には、投与量を150mg減量して再開する。 |
| リパーゼ又はアミラーゼ増加 | Grade 3以上 | Grade 1以下に回復するまで休薬する。投与再開時には、投与量を150mg減量する。 |
8. 重要な基本的注意
8.1 間質性肺疾患があらわれることがあるので、息切れ、呼吸困難、咳嗽、発熱等の初期症状があらわれた場合には、速やかに医療機関を受診するよう患者を指導すること。また、胸部CT検査等の実施など、患者の状態を十分観察すること。必要に応じて動脈血酸素分圧(PaO2)、動脈血酸素飽和度(SpO2)、肺胞気動脈血酸素分圧較差(A-aDO2)、肺拡散能力(DLco)等の検査を行うこと。[1.2、7.、9.1.1、11.1.1参照]
8.2 肝機能障害があらわれることがあるので、本剤投与開始前及び本剤投与中は定期的に肝機能検査を行い、患者の状態を十分に観察すること。[7.、11.1.2参照]
8.3 QT間隔延長、徐脈があらわれることがあるので、本剤投与開始前及び本剤投与中は定期的に心電図及び電解質検査(カリウム、マグネシウム、カルシウム等)を行い、また、脈拍、血圧測定を行うなど、患者の状態を十分に観察すること。また、必要に応じて電解質を補正すること。[7.、9.1.2、11.1.3参照]
8.4 高血糖があらわれることがあるので、本剤投与開始前及び本剤投与中は定期的に血糖値を測定するなど、患者の状態を十分に観察すること。[7.、11.1.5参照]
8.5 リパーゼ、アミラーゼが増加することがあるので、本剤投与開始前及び本剤投与中は定期的に検査を行うこと。[7.、11.1.6参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 間質性肺疾患のある患者又はその既往歴のある患者
9.1.2 QT間隔延長のおそれ又はその既往歴のある患者
9.3 肝機能障害患者
9.3.1 重度の肝機能障害のある患者
減量を考慮するとともに、患者の状態をより慎重に観察し、有害事象の発現に十分注意すること。本剤の血中濃度が上昇するとの報告がある。また、重度の肝機能障害のある患者を対象とした臨床試験は実施していない。[16.6.1参照]
9.4 生殖能を有する者
妊娠可能な女性は、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。やむを得ず投与する場合には、本剤投与による胎児へのリスクについて患者に十分説明すること。ラット及びウサギに、セリチニブをそれぞれ50及び25mg/kg/日(AUCに基づく用量比較で臨床曝露量のそれぞれ0.6及び0.4倍に相当)反復投与したところ、胎児に骨格変異が認められた。[9.4参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト母乳中への移行は不明である。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
10. 相互作用
相互作用序文
本剤はCYP3Aの基質となる。本剤はCYP3Aを強く阻害する。また、CYP2C9を阻害する。
薬物代謝酵素用語
CYP3A
薬物代謝酵素用語
CYP2C9
10.1 併用禁忌
| ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)、再発又は難治性のマントル細胞リンパ腫の用量漸増期) (ベネクレクスタ) [2.2参照] | 腫瘍崩壊症候群の発現が増強されるおそれがある。 | 本剤の強いCYP3A阻害により、ベネトクラクスの代謝が阻害され、血中濃度が上昇するおそれがある。 |
10.2 併用注意
| QT間隔延長を起こすことが知られている薬剤 アミオダロン クラリスロマイシン ドロペリドール等 | QT間隔延長を起こすおそれがあるので、患者の状態を十分に観察すること。 | いずれもQT間隔を延長させるおそれがある。 |
| 徐脈を起こすことが知られている薬剤 β遮断剤 非ジヒドロピリジン系カルシウム拮抗剤 クロニジン等 | 徐脈を起こすおそれがあるので、可能な限り併用しないこと。 | いずれも徐脈を起こすおそれがある。 |
| CYP3A阻害剤 ケトコナゾール注) イトラコナゾール リトナビル サキナビル等 [16.7.1参照] | 本剤の血中濃度が増加し、副作用が増加するおそれがあるので、併用は避け、代替の治療薬への変更を考慮すること。併用が避けられない場合は、本剤の減量を考慮するとともに、患者の状態を慎重に観察し、副作用の発現に十分注意すること。 | これらの薬剤のCYP3A阻害により、本剤の代謝が阻害されると考えられる。 |
| CYP3A誘導剤 リファンピシン カルバマゼピン セイヨウオトギリソウ(セント・ジョーンズ・ワート)含有食品等 [16.7.2参照] | 本剤の血中濃度が低下し、本剤の有効性が減弱するおそれがあるので、併用を避けることが望ましい。 | これらの薬剤のCYP3A誘導により、本剤の代謝が促進されると考えられる。 |
| CYP3Aの基質となる薬剤 ミダゾラム注) フェンタニル タクロリムス等 [16.7.3参照] | 副作用の発現頻度及び重症度が増加するおそれがあるので、これらの薬剤と併用する際には、患者の状態を慎重に観察し、副作用発現に十分注意すること。 | 本剤の強いCYP3A阻害により、これらの薬剤の代謝が阻害され、血中濃度が上昇するおそれがある。 |
| CYP2C9の基質となる薬剤 ワルファリン フェニトイン ジクロフェナク等 [16.7.4参照] | 副作用の発現頻度及び重症度が増加するおそれがあるので、これらの薬剤と併用する際には、患者の状態を慎重に観察し、副作用発現に十分注意すること。 ワルファリンと併用する場合にはプロトロンビン時間国際標準比(PT-INR)のモニタリングの頻度を増やすこと。 | 本剤のCYP2C9阻害により、これらの薬剤の代謝が阻害され、血中濃度が上昇するおそれがある。 ワルファリンの抗凝固作用が促進される可能性がある。 |
| 胃内pHを上昇させる薬剤 プロトンポンプ阻害剤等 [16.7.5参照] | エソメプラゾールと併用した場合、本剤の血中濃度が低下したとの報告がある。 | pHの上昇により、本剤の溶解性が低下すると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.2 肝機能障害(4.2%)
ALT、AST、総ビリルビン等の上昇を伴う肝機能障害があらわれることがある。[7.、8.2参照]
11.1.4 重度の下痢(1.1%)
脱水、電解質異常等の異常が認められた場合には、本剤を休薬、減量又は中止するなど適切な処置を行うこと。[7.参照]
11.1.5 高血糖(2.9%)・糖尿病(0.2%)[7.、8.4参照]
11.1.6 膵炎(0.2%)
腹痛等の膵炎を示唆する症状が認められた場合や膵酵素上昇が持続する場合には、画像診断等を行うこと。[7.、8.5参照]
11.2 その他の副作用
| 20%以上 | 10〜20%未満 | 10%未満 | |
| 感染症及び寄生虫症 | − | − | 感染症(肺炎、口腔カンジダ症、胃腸炎、肺感染、鼻咽頭炎等) |
| 血液及びリンパ系障害 | − | − | 貧血 |
| 代謝及び栄養障害 | 食欲減退 | − | 低リン酸血症 |
| 眼障害 | − | − | 視覚障害(霧視、光視症、視力障害、硝子体浮遊物、調節障害、老視等) |
| 心臓障害 | − | − | 心膜炎 |
| 胃腸障害 | 悪心注)(34.8%)、下痢注)(50.6%)、嘔吐注)、腹痛(31.3%) | − | 食道障害(胃食道逆流性疾患、嚥下障害)、消化不良、便秘 |
| 肝胆道系障害 | 肝機能検査値異常(52.8%)(ALT増加(44.5%)、AST増加(38.0%)、γ-GTP増加、血中ビリルビン増加等) | − | − |
| 皮膚及び皮下組織障害 | − | 発疹 | − |
| 腎及び尿路障害 | − | 血中クレアチニン増加 | 腎機能障害、腎不全 |
| 全身障害 | 疲労 | − | − |
| 臨床検査 | − | 体重減少 | アミラーゼ増加、リパーゼ増加 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康被験者にセリチニブ750mgをカプセル剤(150mgカプセル×5)又は錠剤(150mg錠×5)として空腹時に単回経口投与注1)した結果、両製剤の生物学的同等性が確認された1)(外国人データ)。
| 製剤 | Cmax(ng/mL) | Tmax注)(h) | AUClast(h・ng/mL) | T1/2(h) |
| カプセル剤 (n=73) | 208(63.7) | 10.0(6.00-12.1) | 9030(70.5) | 37.0(18.1) |
| 錠剤 (n=73) | 200(52.5) | 10.0(6.00-12.0) | 9000(57.7) | 38.0(17.6) |
健康被験者に750mgをカプセル剤又は錠剤(各製剤150mg×5)として単回経口投与後の血漿中濃度推移(平均値±標準偏差)
16.1.2 単回及び反復投与
ALK融合遺伝子変異を有する日本人固形癌患者に、セリチニブ300、450、600及び750mgを空腹時に経口投与注1)したときの血漿中未変化体濃度を測定した。初回投与後の3日間、並びに、その後1日1回反復投与開始後22日目に薬物濃度を測定し薬物動態パラメータを算出した。反復投与によるAUCの累積比は750mgで7.3倍であった2)。
| 投与量(mg) | 投与 | Cmax(ng/mL) | Tmax注)(h) | AUC0-24h(h・ng/mL) | T1/2(h) |
| 300 | 初回 (n=2) | 166,170 | 4.17,6.03 | 2730,2780 | 19.7,24.5 |
| 22日目 (n=2) | 825,908 | 5.98,5.98 | − | − | |
| 450 | 初回 (n=5) | 48.1(176) | 5.88(2.95-24.1) | 648(169) | 21.6,30.5a) |
| 22日目 (n=5) | 977(11.1) | 5.95(3.95-8.05) | 20600b)(20.5) | − | |
| 600 | 初回 (n=4) | 126(245) | 5.97(3.97-6.03) | 2080(270) | 30.5(11.6) |
| 22日目 (n=4) | 1020(64.6) | 4.93(3.88-8.00) | 10600,32200a) | − | |
| 750 | 初回 (n=6) | 192(46.0) | 5.98(2.92-72.0) | 3160(66.9) | 33.2c)(12.9) |
| 22日目 (n=3) | 1440(25.5) | 1.93(0.00-6.00) | 22300,30500a) | − |
日本人固形癌患者にセリチニブ300、450、600及び750mgを初回投与後(上図)及び反復経口投与開始後22日目(下図)の血漿中濃度推移(平均値±標準偏差)
16.2 吸収
16.2.1 食事の影響
健康被験者にセリチニブ750mgを軽食後に単回経口投与注1)した場合(12例)、空腹時に比べCmax(45%)とAUC(54%)の増加がみられた3)。
また、ALK融合遺伝子陽性の非小細胞肺癌患者を対象にセリチニブ750mgを空腹時に、450mg又は600mgを食後に、それぞれ1日1回反復経口投与し定常状態(22日目)での薬物動態パラメータを比較した。Cmax及びAUC0-24hは、750mg空腹時投与(31例)に対し、450mg食後投与(36例)で幾何平均比(90%信頼区間)としてそれぞれ1.03(0.865-1.22)及び1.04(0.869-1.24)、600mg食後投与(30例)でそれぞれ1.25(1.04-1.49)及び1.24(1.03-1.49)であった。750mg空腹時投与に比べ450mg食後では曝露量は同様であったが600mg食後では曝露量の増加がみられた4)(外国人データ)。
また、ALK融合遺伝子陽性の非小細胞肺癌患者を対象にセリチニブ750mgを空腹時に、450mg又は600mgを食後に、それぞれ1日1回反復経口投与し定常状態(22日目)での薬物動態パラメータを比較した。Cmax及びAUC0-24hは、750mg空腹時投与(31例)に対し、450mg食後投与(36例)で幾何平均比(90%信頼区間)としてそれぞれ1.03(0.865-1.22)及び1.04(0.869-1.24)、600mg食後投与(30例)でそれぞれ1.25(1.04-1.49)及び1.24(1.03-1.49)であった。750mg空腹時投与に比べ450mg食後では曝露量は同様であったが600mg食後では曝露量の増加がみられた4)(外国人データ)。
16.3 分布
セリチニブのヒト血漿蛋白結合率及び血液/血漿濃度比は薬物濃度に依存せず、それぞれ約97%及び1.35であった5)。
16.4 代謝
16.5 排泄
放射性標識したセリチニブ750mgを健康成人(6例)に空腹時に単回経口投与後注1)、15日目までに放射能の91%が糞中に排泄された(未変化体は投与した放射能の68%)。一方、放射能の腎排泄は1.3%とわずかで、セリチニブは主に肝臓から代謝や胆汁排泄により消失すると考えられる7)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 肝機能障害患者
肝機能が正常な健康被験者8例、軽度肝機能障害被験者8例(Child-Pugh分類A)、中等度肝機能障害被験者7例(Child-Pugh分類B)及び重度肝機能障害被験者7例(Child-Pugh分類C)にセリチニブ750mgを空腹時に単回経口投与注1)したとき、血漿中総濃度のAUC(血漿タンパク非結合形濃度のAUC)は、健康被験者に比べて軽度、中等度及び重度障害被験者でそれぞれ1.18倍(1.35倍)、1.02倍(1.22倍)及び1.66倍(2.08倍)であった。総濃度のCmax(血漿タンパク非結合形濃度のCmax)は健康被験者に比べて軽度、中等度及び重度障害被験者でそれぞれ1.40倍(1.61倍)、0.902倍(1.08倍)及び0.767倍(0.960倍)であった8)(外国人データ)。[9.3.1参照]
16.7 薬物相互作用
16.7.1 ケトコナゾール
16.7.2 リファンピシン
16.7.3 ミダゾラム
16.7.4 ワルファリン
16.7.5 エソメプラゾール
16.7.6 その他
注1)本剤の承認された用法及び用量は、450mgを1日1回、食後に経口投与である。
注2)エソメプラゾールの承認された用法及び用量は、1回10〜20mgを1日1回経口投与、ヘリコバクター・ピロリの除菌の補助の場合には、1回20mgをアモキシシリン及びクラリスロマイシンと同時に1日2回経口投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第II相試験
白金系抗悪性腫瘍剤及びクリゾチニブによる治療歴を有するALK融合遺伝子陽性の切除不能な進行・再発非小細胞肺癌患者140例(うち日本人患者24例)に本剤750mgを1日1回空腹時に連日投与した多施設共同非盲検非対照試験である注1)。主要評価項目である奏効率(RECIST ver.1.1基準に基づく治験責任医師判定によるCR又はPR)は37.1%(95%信頼区間:29.1%、45.7%)であった。なお、事前に設定された閾値奏効率は25%であった14)。
副作用発現頻度は97.1%(136/140例)であった。主な副作用は、悪心79.3%(111/140例)、下痢78.6%(110/140例)、嘔吐60.7%(85/140例)、ALT増加43.6%(61/140例)、AST増加37.1%(52/140例)、食欲減退35.7%(50/140例)等であった。(試験終了時までの集計)
17.1.2 国際共同第III相試験
白金系抗悪性腫瘍剤及びクリゾチニブによる治療歴を有するALK融合遺伝子陽性の切除不能な進行・再発非小細胞肺癌患者231例(うち日本人患者29例)が本剤(750mg、1日1回空腹時投与)又は化学療法剤(ペメトレキセド又はドセタキセル)に無作為割付された多施設共同非盲検ランダム化比較試験である注1)。主要評価項目である独立中央画像評価機関の判定に基づく無増悪生存期間(中央値)は、セリチニブ群で5.4ヵ月(95%信頼区間:4.1、6.9)、化学療法群で1.6ヵ月(95%信頼区間:1.4、2.8)であり、化学療法群と比べてセリチニブ群で有意な無増悪生存期間の延長が認められた(層別Cox比例ハザードモデルによるハザード比[95%信頼区間]=0.49[0.36、0.67]、層別ログランク検定による片側p値<0.001)15)。
無増悪生存期間のKaplan-Meier曲線
副作用発現頻度はセリチニブ群で95.7%(110/115例)であった。主な副作用は、下痢63.5%(73/115例)、悪心60.9%(70/115例)、嘔吐47.8%(55/115例)、ALT増加41.7%(48/115例)、AST増加35.7%(41/115例)、食欲減退33.0%(38/115例)等であった。
17.1.3 国際共同第III相試験
化学療法歴のないALK融合遺伝子陽性注2)の切除不能な進行・再発の非扁平上皮非小細胞肺癌患者376例(うち日本人患者12例)が本剤(750mg、1日1回空腹時投与)又は化学療法剤(ペメトレキセドとシスプラチン又はカルボプラチンによる導入療法、並びにそれに続くペメトレキセドによる維持療法)に無作為割付された多施設共同非盲検ランダム化比較試験である注1)。主要評価項目である独立中央画像評価機関の判定に基づく無増悪生存期間(中央値)は、セリチニブ群で16.6ヵ月(95%信頼区間:12.6、27.2)、化学療法群で8.1ヵ月(95%信頼区間:5.8、11.1)であり、化学療法群と比べてセリチニブ群で有意な無増悪生存期間の延長が認められた(層別Cox比例ハザードモデルによるハザード比[95%信頼区間]=0.55[0.42、0.73]、層別ログランク検定による片側p値<0.001)16)。
無増悪生存期間のKaplan-Meier曲線
副作用発現頻度は、セリチニブ群で97.4%(184/189例)であった。主な副作用は、下痢80.4%(152/189例)、悪心64.6%(122/189例)、ALT増加59.3%(112/189例)、嘔吐58.2%(110/189例)、AST増加50.8%(96/189例)、γ-GTP増加34.9%(66/189例)等であった。
17.1.4 海外第I相試験
化学療法歴のないALK融合遺伝子陽性注2)の切除不能な進行・再発非小細胞肺癌患者81例が本剤450mgを1日1回食後投与又は本剤750mgを1日1回空腹時投与に無作為割付された多施設共同非盲検ランダム化試験である注1)。奏効率(RECIST ver.1.1基準に基づく独立中央画像評価機関の判定によるCR又はPR)は、本剤450mg食後投与群で78.0%(95%信頼区間:62.4%、89.4%)、本剤750mg空腹時投与群で70.0%(95%信頼区間:53.5%、83.4%)であった4)。
本剤450mg食後投与群の副作用発現頻度は83.1%(74/89例)であった。主な副作用は、下痢50.6%(45/89例)、悪心34.8%(31/89例)、ALT増加32.6%(29/89例)、AST増加、γ-GTP増加 各25.8%(23/89例)、嘔吐24.7%(22/89例)等であった。
本剤750mg空腹時投与群の副作用発現頻度は91.1%(82/90例)であった。主な副作用は、下痢70.0%(63/90例)、嘔吐46.7%(42/90例)、悪心45.6%(41/90例)、ALT増加30.0%(27/90例)、AST増加27.8%(25/90例)、腹痛22.2%(20/90例)疲労20.0%(18/90例)等であった。
注1)本剤の承認された用法及び用量は、450mgを1日1回、食後に経口投与である。
注2)コンパニオン診断薬として製造販売承認されているベンタナOptiview ALK(D5F3)を用いて検査された。
18. 薬効薬理
19. 有効成分に関する理化学的知見
19.1. セリチニブ
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
14錠[14錠(PTP)×1]
23. 主要文献
- 社内資料:外国健康被験者を対象とした生物学的同等性試験(A2107試験)
- 社内資料:ALK融合遺伝子を有する固形癌患者を対象とした国内第I相臨床試験(X1101試験)(2016年3月28日承認、CTD2.7.2-2.3.2)
- 社内資料:食事の影響(2016年3月28日承認、CTD2.7.6-1.1.2)
- 社内資料:ALK融合遺伝子陽性の切除不能な進行・再発非小細胞肺癌患者を対象とした海外第I相臨床試験(A2112試験)(2019年2月21日承認、CTD2.7.6-4.2.1)
- 社内資料:血漿蛋白結合率と血球移行性(2016年3月28日承認、CTD2.7.2-2.1.1)
- 社内資料:代謝酵素(2016年3月28日承認、CTD2.7.2-2.1.2)
- 社内資料:吸収、分布、代謝、排泄(2016年3月28日承認、CTD2.7.2-2.2.1)
- 社内資料:肝機能障害の影響を検討した海外第I相臨床試験(A2110試験)(2016年3月28日承認、CTD2.7.2-3.5.6)
- 社内資料:ケトコナゾールとの薬物相互作用(2016年3月28日承認、CTD2.7.2-2.2.2)
- 社内資料:リファンピシンとの薬物相互作用(2016年3月28日承認、CTD2.7.2-2.2.3)
- 社内資料:ミダゾラム及びワルファリンとの薬物相互作用
- Lau,YY.et al., Cancer Chemother.Pharmacol., 79 (6), 1119-1128, (2017) »PubMed
- 社内資料:膜透過性と薬物トランスポーター(2016年3月28日承認、CTD2.7.2-2.1.3)
- 社内資料:白金系抗悪性腫瘍剤及びクリゾチニブによる治療歴を有するALK融合遺伝子陽性の切除不能な進行・再発非小細胞肺癌患者を対象とした国際共同第II相臨床試験(A2201試験)(2016年3月28日承認、CTD2.7.6-4.2.1)
- 社内資料:白金系抗悪性腫瘍剤及びクリゾチニブによる治療歴を有するALK融合遺伝子陽性の切除不能な進行・再発非小細胞肺癌患者を対象とした国際共同第III相臨床試験(A2303試験)
- 社内資料:化学療法歴のないALK融合遺伝子陽性の切除不能な進行・再発の非扁平上皮非小細胞肺癌患者を対象とした国際共同第III相臨床試験(A2301試験)
- 社内資料:細胞に導入したALK融合キナーゼに対するセリチニブの活性(2016年3月28日承認、CTD2.6.2-2.1.2)
- 社内資料:ALK遺伝子異常を有するヒト癌細胞株に対するセリチニブの細胞増殖阻害作用(in vitro)(2016年3月28日承認、CTD2.6.2-2.2.1)
- 社内資料:異種移植腫瘍モデルマウスにおけるセリチニブの抗腫瘍効果(2016年3月28日承認、CTD2.6.2-2.3.1)
- 社内資料:異種移植腫瘍モデルラットにおけるセリチニブの抗腫瘍効果(2016年3月28日承認、CTD2.6.2-2.3.2)
- 社内資料:ALK I1171T変異クリゾチニブ耐性腫瘍モデルに対するセリチニブの抗腫瘍効果(2016年3月28日承認、CTD2.6.2-2.3.4)
24. 文献請求先及び問い合わせ先
文献請求先
ノバルティスファーマ株式会社
ノバルティスダイレクト
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-003-293 受付時間:月〜金 9:00〜17:30(祝祭日及び当社休日を除く)
製品情報問い合わせ先
ノバルティスファーマ株式会社
ノバルティスダイレクト
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-003-293 受付時間:月〜金 9:00〜17:30(祝祭日及び当社休日を除く)
26. 製造販売業者等
26.1 製造販売
ノバルティスファーマ株式会社
東京都港区虎ノ門1-23-1