医薬品情報
| 総称名 | テリボン |
|---|---|
| 一般名 | テリパラチド酢酸塩 |
| 欧文一般名 | Teriparatide Acetate |
| 製剤名 | テリパラチド酢酸塩注射液 |
| 薬効分類名 | 骨粗鬆症治療剤 |
| 薬効分類番号 | 2439 |
| ATCコード | H05AA02 |
| KEGG DRUG |
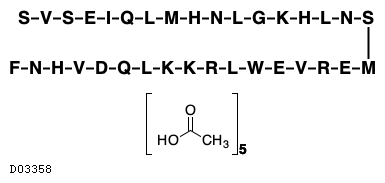
D03358
テリパラチド酢酸塩
|
| KEGG DGROUP |
DG00512
テリパラチド
DG03232
骨粗鬆症治療薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年10月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| テリボン皮下注28.2μgオートインジェクター | Teribone Injection | 旭化成ファーマ | 2439401G1024 | 5995円/キット | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
骨折の危険性の高い骨粗鬆症
5. 効能または効果に関連する注意
本剤の適用にあたっては、低骨密度、既存骨折、加齢、大腿骨頸部骨折の家族歴等の骨折の危険因子を有する患者を対象とすること。
6. 用法及び用量
通常、成人には、テリパラチドとして28.2μgを1日1回、週に2回皮下注射する。
なお、本剤の投与は24ヵ月間までとすること。
なお、本剤の投与は24ヵ月間までとすること。
7. 用法及び用量に関連する注意
7.1 投与間隔は原則3〜4日間隔とすること。
7.3 本剤の投与をやむを得ず一時中断したのちに再投与する場合であっても、投与の合計が24ヵ月(208回)を超えないこと。また、24ヵ月(208回)の投与終了後、再度24ヵ月(208回)の投与を繰り返さないこと。
7.4 テリパラチド(遺伝子組換え)製剤から本剤に切り替えた経験はなく、その安全性は確立していない。なお、テリパラチド(遺伝子組換え)製剤から本剤に切り替えたときにおける本剤の投与期間の上限は検討されていない。[15.2参照]
7.5 アバロパラチド製剤から本剤に切り替えた経験はなく、その安全性は確立していない。
8. 重要な基本的注意
8.1 本剤投与直後から数時間後にかけて、ショック、一過性の急激な血圧低下に伴う意識消失、痙攣、転倒があらわれることがある。投与開始後数ヵ月以上を経て初めて発現することもあるので、本剤投与時には以下の点に留意するよう患者に指導すること。[11.1.2参照]
・投与後30分程度はできる限り安静にすること。
・投与後に血圧低下、めまい、立ちくらみ、動悸、気分不良、悪心、顔面蒼白、冷汗等が生じた場合には、症状がおさまるまで座るか横になること。
8.2 一過性の血圧低下に基づくめまいや立ちくらみ、意識消失等があらわれることがあるので、高所での作業、自動車の運転等危険を伴う作業に従事する場合には注意させること。
8.3 本剤の薬理作用により、投与約4から6時間後を最大として一過性の血清カルシウム値上昇がみられる。本剤投与中に血清カルシウム値上昇が疑われる症状(便秘、悪心、嘔吐、腹痛、食欲減退等)が本剤投与翌日以降も継続して認められた場合には、速やかに診察を受けるよう患者に指導すること。また、血清カルシウム値の測定を行い、持続性高カルシウム血症と判断された場合には、本剤の投与を中止すること。[2.2、10.2参照]
8.4 本剤の自己注射にあたっては、患者に十分な教育訓練を実施したのち、患者自ら確実に投与できることを確認した上で、医師の管理指導のもとで実施すること。また、器具の安全な廃棄方法について指導を徹底すること。本剤の使用説明書を必ず読むよう指導すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 低血圧の患者
一過性の血圧低下があらわれることがある。
9.1.2 心疾患のある患者
患者の状態を観察し、病態の悪化がないか注意しながら本剤を投与すること。副甲状腺ホルモンは血管平滑筋の弛緩作用や心筋への陽性変時・陽性変力作用を示すことが報告されている。なお、重篤な心疾患のある患者は臨床試験では除外されている。
9.1.3 尿路結石のある患者及びその既往歴のある患者
症状を悪化させるおそれがある。
9.1.4 閉経前の骨粗鬆症患者
閉経前の骨粗鬆症患者を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.2 腎機能障害患者
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害を有する患者
臨床試験では重篤な肝機能障害を有する患者は除外されている。
9.4 生殖能を有する者
妊娠する可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、本剤投与期間中は有効な避妊を行うように指導すること。妊娠が認められた場合には、本剤の投与を中止すること。[9.5参照]
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等及び若年者で骨端線が閉じていない患者には投与しないこと。これらの患者を対象とした臨床試験は実施していない。これらの患者では、一般に骨肉腫発現のリスクが高いと考えられている。[2.1参照]
9.8 高齢者
患者の状態を観察し、十分に注意しながら本剤を投与すること。一般に高齢者では生理機能が低下していることが多い。
10. 相互作用
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
11.1.2 ショック(頻度不明)、意識消失(頻度不明)
ショック、一過性の急激な血圧低下に伴う意識消失があらわれることがあり、心停止、呼吸停止を来した症例も報告されている。異常が認められた場合には、適切な処置を行い、次回以降の投与中止を考慮すること。[8.1参照]
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 消化器 | 悪心、嘔吐 | 腹部不快感、消化不良、食欲減退、便秘、下痢、腹痛、逆流性食道炎、口腔内不快感、口渇、虚血性大腸炎、口唇腫脹 | 胃炎、胃潰瘍、腹部膨満、流涎過多、裂孔ヘルニア、おくび、味覚異常、口内乾燥、心窩部不快感、口角口唇炎、口内炎 |
| 精神神経系 | 頭痛 | めまい、傾眠、頭部不快感、感覚鈍麻(四肢、顔、口のしびれ感等) | 不眠症、振戦、鎮静、感情不安定、注意力低下、記憶障害、耳鳴、灼熱感、痙攣 |
| 眼 | 眼瞼浮腫 | 眼瞼下垂、視力障害、結膜充血、眼痛、霧視 | |
| 腎臓 | 血中クレアチニン増加、尿中血陽性、頻尿 | BUN上昇、腎機能障害、尿中蛋白陽性、慢性腎炎 | |
| 循環器 | 血圧低下、血圧上昇、動悸、徐脈、不整脈 | 起立性低血圧、上室性頻脈、心室性期外収縮、心電図異常、狭心痛、潮紅、蒼白、洞結節機能不全、心房細動 | |
| 過敏症 | 紅斑 | 発疹、蕁麻疹、そう痒症、アレルギー性結膜炎、アレルギー性鼻炎 | |
| 肝臓 | 肝機能障害、ALP上昇、ALT上昇、AST上昇、γ-GTP上昇 | ||
| 代謝異常 | 高尿酸血症、高カルシウム血症 | CK上昇、血中リン減少、ALP低下、アルブミン・グロブリン比減少、血中カリウム減少、血中カリウム増加、血中カルシウム増加、血中クロール減少、血中クロール増加、血中コレステロール増加、血中ナトリウム減少、血中ブドウ糖増加、脱水 | |
| 血液 | 貧血 | 好酸球増加、好中球減少、リンパ球増加、血小板減少、好塩基球増加、好酸球減少、好中球増加、赤血球減少、単球減少、白血球減少、白血球増加、ヘマトクリット減少、ヘモグロビン減少、リンパ球減少 | |
| 呼吸器 | 息詰まり感、咳嗽、喘息、鼻漏、副鼻腔炎、咽頭不快感 | ||
| 筋骨格 | 関節痛 | 筋骨格硬直、肩の石灰化腱炎、背部痛、四肢痛、四肢不快感、筋緊張、筋力低下、頚部痛、筋肉痛、骨痛、筋痙縮 | |
| 投与部位 | 注射部位出血 | 注射部位疼痛、注射部位紅斑、注射部位血腫、注射部位反応 | 注射部位腫脹、注射部位不快感 |
| その他 | 倦怠感 | 異常感(全身違和感、気分不良等)、発熱、悪寒、あくび、脱力感 | 胸部不快感、胸痛、多汗症、浮腫、熱感、甲状腺腫、自己免疫性甲状腺炎、リンパ節炎、末梢冷感、インフルエンザ様疾患、胆石症、皮下結節、皮下出血、尿中ウロビリン陽性、尿中ビリルビン増加、脱毛、疼痛、冷感、体重減少 |
13. 過量投与
13.1 症状
血圧低下、脈拍数増加、血清カルシウム値上昇が発現する可能性がある。
13.2 処置
本剤の投与を中止し、血圧、脈拍、血清カルシウム値の測定を行い、適切な措置を行うこと。
14. 適用上の注意
14.1 薬剤投与前の注意
14.1.1 室温に戻しておくこと。
14.1.2 投与直前まで本剤の先端部のキャップを外さないこと。キャップを外したら直ちに投与すること。
14.1.3 投与前に、内容物を目視により確認すること。なお、異物又は変色が認められる場合は使用しないこと。
14.2 薬剤投与時の注意
14.2.1 本剤は皮下注射のみに使用し、注射部位を腹部、大腿部又は上腕部として、広範に順序よく移動して注射すること。
14.2.2 本剤は、1回使用の製剤であり、再使用しないこと。
15. その他の注意
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康閉経後女性に本剤28.2μgを単回皮下投与したとき、腹部、大腿部、上腕部のいずれの投与部位でも血漿中テリパラチド酢酸塩濃度は速やかにピークに達し、また消失も速やかであった(表及び図参照)2)。
| Cmax(pg/mL) | Tmax(min) | T1/2(min) | AUCinf(ng・min/mL) | |
| 腹部(n=12) | 267.1±74.5 | 25.8±14.7 | 45.5±7.6 | 28.8±6.8 |
| 大腿部(n=12) | 208.4±58.2 | 40.0±17.3 | 57.3±15.6※ | 28.2±7.3※ |
| 上腕部(n=12) | 286.3±74.8 | 35.0±9.8 | 50.8±20.0 | 31.74±7.4 |
図 健康閉経後女性に本剤を皮下投与したときの血漿中テリパラチド酢酸塩濃度の推移
16.1.2 反復投与
健康閉経後女性にテリパラチドとして28.2μgを週2回6週間反復皮下投与したとき、投与間隔に関わらず、反復投与によってCmax及びAUCinfは変化しなかった3)。
16.2 吸収
16.2.1 生物学的利用率
16.3 分布
16.3.1 分布容積
30代健康成人男性5例にテリパラチドとして14.1μgを静脈内投与注)したときの分布容積は307±78mL/kg、60代健康成人男性5例にテリパラチドとして14.1μgを静脈内投与注)したときの分布容積は426±190mL/kgであった4)。
16.3.2 血球移行性
健康成人5例の血液サンプルを用いて、テリパラチド酢酸塩の血球への移行性を評価した結果、血球移行性は37.0%であった5)(in vitro)。
16.3.3 組織分布
ラットでの検討より、皮下投与されたテリパラチド酢酸塩(125I標識体)は肝臓及び腎臓に分布することが示唆された6)。
16.4 代謝
ラット組織を用いた検討より、肝臓あるいは腎臓に分布したテリパラチド酢酸塩(125I標識体)は速やかに低分子の分解物へと代謝されることが示唆された6)。
16.5 排泄
健康閉経後女性16例にテリパラチドとして56.5μg注)を単回皮下投与したとき、24時間までに排泄された尿中にテリパラチド酢酸塩は検出されなかった7)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能障害者にテリパラチドとして56.5μg注)を単回皮下投与したときCmax及びAUCinfは腎機能の影響を大きく受けず、T1/2は高度腎障害者で延長したが(表参照)、本剤の投与間隔を考慮すれば血漿からの消失は十分に速やかであると考えられた(図参照)8)。したがって、腎機能の程度によって用法・用量を変更する必要はないと考えられた。なお、腎透析患者を対象とした試験は実施されていない。[9.2.1参照]
| Cmax(pg/mL) | Tmax(min) | T1/2(min) | AUCinf(ng・min/mL) | |
| 正常〜軽度(n=8) (eGFR:62.3-88.5) | 361.73±103.44 | 50.6±26.5 | 90.64±29.54 | 56.54±9.59 |
| 中等度(n=5) (eGFR:35.0-58.5) | 499.14±259.48 | 48.0±19.6 | 71.76±10.58 | 56.36±13.31 |
| 高度(n=5) (eGFR:16.7-28.5) | 424.68±268.40 | 54.0±25.1 | 297.99±240.38 | 63.36±22.99 |
図 腎機能障害者の血漿中テリパラチド酢酸塩濃度の経時推移
16.6.2 肝機能障害患者
(1)肝機能障害患者を対象とした試験は実施されていない。
(2)肝機能障害モデルラットにテリパラチドとして5.6μg/kgを単回皮下投与したときの薬物動態パラメータは、正常ラットの値とほぼ同様であった5)。
16.7 薬物相互作用
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(骨密度試験)
骨折の危険性の高い原発性骨粗鬆症患者を対象とした48週間投与の実薬対照二重盲検比較試験11)において、本剤(テリパラチドとして1回28.2μg)の週2回投与と対照薬(テリパラチドとして1回56.5μg)の週1回投与を比較した。その結果、最終観察時の腰椎(L2-L4)骨密度の平均変化率は本剤群(251例うち男性23例)が7.3%、56.5μg週1回投与群(239例うち男性22例)が5.9%であり、本剤の56.5μg週1回投与に対する非劣性が検証された(非劣性限界値:−1.6%)。[7.2参照]
| 観察週\ | 本剤 | 56.5μg週1回投与 | 差 | 95%信頼区間 | ||
| n | 平均変化率 | n | 平均変化率 | |||
| 24週後 | 245 | 5.0% | 233 | 3.8% | \ | \ |
| 48週後 | 231 | 7.5% | 224 | 6.0% | \ | \ |
| 最終観察時 | 251 | 7.3% | 239 | 5.9% | 1.3 | 0.400,2.283 |
本剤群の副作用発現頻度は39.7%(110/277例)であった。主な副作用は、本剤群では、悪心20.2%(56/277例)、倦怠感9.4%(26/277例)、嘔吐9.0%(25/277例)、頭痛5.8%(16/277例)、注射部位出血5.1%(14/277例)、56.5μg週1回投与群では、悪心31.9%(88/276例)、嘔吐13.0%(36/276例)、倦怠感12.0%(33/276例)、頭痛10.5%(29/276例)、発熱6.5%(18/276例)等であった。
17.1.2 テリパラチド56.5μg週1回投与製剤の国内第III相試験(72週投与の骨折及び骨密度試験)
骨折の危険性の高い原発性骨粗鬆症患者を対象にテリパラチドとして56.5μgを週1回又はプラセボを週1回72週間投与した第III相試験(二重盲検試験)のKaplan-Meier推定法に基づく新規椎体骨折発生率は下表のとおりであり(56.5μg週1回投与群261例うち男性13例、プラセボ群281例うち男性10例)、56.5μg週1回投与は新規椎体骨折の発生を有意に抑制した12)。72週後の相対リスク減少率は78.6%であり、新規椎体骨折発生率の群間差は11.4%であった。また、Cox回帰モデルに基づく相対リスク減少率は80%であった13)。
| 観察週\ | 56.5μg週1回投与(n=261) | プラセボ(n=281) | logrank検定 |
| 24週後 | 2.6% | 5.3% | p<0.0001 |
| 48週後 | 3.1% | 10.4% | |
| 72週後 | 3.1% | 14.5% |
また、72週後の腰椎(L2-L4)骨密度の平均変化率は、56.5μg週1回投与群(107例うち男性6例)6.7%、プラセボ群(130例うち男性4例)0.3%であり、56.5μg週1回投与群はプラセボ群に対して有意な骨密度増加効果を示した(t検定、p<0.0001)12)。[7.2参照]
56.5μg週1回投与群の副作用発現頻度は43.8%(127/290例)であった。主な副作用は、悪心18.6%(54/290例)、嘔吐8.6%(25/290例)、頭痛7.6%(22/290例)、倦怠感6.2%(18/290例)、腹部不快感4.1%(12/290例)等であった12)。
17.1.3 テリパラチド56.5μg週1回投与製剤の国内第III相試験(24ヵ月投与の骨密度試験)
18. 薬効薬理
18.1 作用機序
18.2 骨強度、骨密度及び骨構造に及ぼす影響
18.3 骨代謝に及ぼす影響
19. 有効成分に関する理化学的知見
19.1. テリパラチド酢酸塩
20. 取扱い上の注意
本剤は冷蔵庫に入れ、凍結を避け、2〜8℃で遮光保存すること。
22. 包装
4オートインジェクター
23. 主要文献
- Watanabe A.et al., J Toxicol.Sci., 37 (3), 617-629, (2012)
- 社内資料:113試験
- Kumagai Y.et al., Clin Pharmacol Drug Dev., (2019), ((doi:10.1002/cpdd.687)) »PubMed »DOI
- 社内資料:健康成人男性での単回静脈内投与試験(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.7.1.2)
- 社内資料:薬物動態試験<血球移行性(in vitro)>(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.6.4.4)
- Serada M.et al., Xenobiotica, 42 (4), 398-407, (2012)
- 社内資料:健康高齢女性での臨床薬理試験(QT/QTc間隔に及ぼす影響の検討)(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.7.6.7)
- 社内資料:腎機能障害者での臨床薬理試験(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.6.4.5)
- 社内資料:薬物動態試験<酵素阻害(in vitro)>(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.6.4.5)
- 社内資料:薬物動態試験<酵素誘導(in vitro)>(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.7.2.2)
- Sugimoto T.et al., Osteoporos Int., 30 (11), 2321-2331 , (2019)
- 社内資料:骨折リスクの高い原発性骨粗鬆症に対するMN-10-Tの第III相骨折試験(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.7.6.10)
- Nakamura T.et al., J Clin Endocrinol Metab., 97 (9), 3097-3106, (2012)
- 社内資料:骨折の危険性の高い原発性骨粗鬆症に対するMN-10-Tの第III相骨量試験
- Isogai Y.et al., J Bone Miner Res., 11 (10), 1384-1393, (1996)
- 社内資料:卵巣摘除ラットにおける骨形成促進作用(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.6.2.3)
- 社内資料:卵巣摘除カニクイザルを用いた18ヵ月間反復投与試験(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.6.2.3)
- Takao-Kawabata R.et al., Calcif Tissue Int., 97 (2), 156-168, (2015)
- Sugie-Oya A.et al., J Bone Miner Metab., 34 (3), 303-314, (2016)
24. 文献請求先及び問い合わせ先
文献請求先
旭化成ファーマ株式会社
くすり相談窓口
〒100-0006
東京都千代田区有楽町一丁目1番2号
電話:フリーダイヤル 0120-114-936(9:00〜17:45/土日祝、休業日を除く)
製品情報問い合わせ先
旭化成ファーマ株式会社
くすり相談窓口
〒100-0006
東京都千代田区有楽町一丁目1番2号
電話:フリーダイヤル 0120-114-936(9:00〜17:45/土日祝、休業日を除く)
26. 製造販売業者等
26.1 製造販売元
旭化成ファーマ株式会社
東京都千代田区有楽町一丁目1番2号