医薬品情報
| 総称名 | エクフィナ |
|---|---|
| 一般名 | サフィナミドメシル酸塩 |
| 欧文一般名 | Safinamide Mesilate |
| 製剤名 | サフィナミドメシル酸塩錠 |
| 薬効分類名 | パーキンソン病治療剤 |
| 薬効分類番号 | 1169 |
| ATCコード | N04BD03 |
| KEGG DRUG |
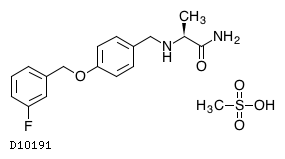
D10191
サフィナミドメシル酸塩
|
| KEGG DGROUP |
DG01967
抗パーキンソン病薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年1月 改訂(第5版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| エクフィナ錠50mg | Equfina TABLETS 50mg | エーザイ | 1169018F1020 | 867.9円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 他のMAO阻害剤(セレギリン塩酸塩、ラサギリンメシル酸塩)を投与中の患者[10.1参照]
2.2 ペチジン塩酸塩含有製剤、トラマドール塩酸塩含有製剤又はタペンタドール塩酸塩を投与中の患者[10.1参照]
2.3 三環系抗うつ剤(アミトリプチリン塩酸塩、アモキサピン、イミプラミン塩酸塩、クロミプラミン塩酸塩、ドスレピン塩酸塩、トリミプラミンマレイン酸塩、ノルトリプチリン塩酸塩、ロフェプラミン塩酸塩)、四環系抗うつ剤(マプロチリン塩酸塩、ミアンセリン塩酸塩、セチプチリンマレイン酸塩)、選択的セロトニン再取り込み阻害剤(フルボキサミンマレイン酸塩、パロキセチン塩酸塩水和物、セルトラリン塩酸塩、エスシタロプラムシュウ酸塩)、セロトニン再取り込み阻害・セロトニン受容体調節薬(ボルチオキセチン臭化水素酸塩)、セロトニン・ノルアドレナリン再取り込み阻害剤(ミルナシプラン塩酸塩、デュロキセチン塩酸塩、ベンラファキシン塩酸塩)、選択的ノルアドレナリン再取り込み阻害剤(アトモキセチン塩酸塩)又はノルアドレナリン・セロトニン作動性抗うつ剤(ミルタザピン)、フェンフルラミン塩酸塩、中枢神経刺激剤(メチルフェニデート塩酸塩、リスデキサンフェタミンメシル酸塩、メタンフェタミン塩酸塩)、マジンドール、トラマゾリン塩酸塩、塩酸テトラヒドロゾリン・プレドニゾロン、ナファゾリン硝酸塩、アプラクロニジン塩酸塩を投与中の患者[10.1参照]
2.4 重度の肝機能障害(Child-Pugh分類C)のある患者[9.3.1参照]
2.5 本剤の成分に対し過敏症の既往歴のある患者
2.6 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
レボドパ含有製剤で治療中のパーキンソン病におけるwearing off現象の改善
5. 効能または効果に関連する注意
レボドパ含有製剤の投与量又は投与回数の調節を行ってもwearing off現象が認められる患者に対して使用すること。
6. 用法及び用量
本剤は、レボドパ含有製剤と併用する。通常、成人にはサフィナミドとして50mgを1日1回経口投与する。なお、症状に応じて100mgを1日1回経口投与できる。
7. 用法及び用量に関連する注意
7.1 レボドパ含有製剤との併用によりレボドパ由来の副作用(ジスキネジア等)があらわれることがある。このため、本剤の投与開始時又は増量時には患者の状態を十分観察し、このような副作用が認められた場合は、本剤あるいはレボドパ含有製剤の用量を調節すること。
8. 重要な基本的注意
8.1 本剤投与により日中の傾眠、前兆のない突発的睡眠があらわれることがあるため、本剤投与中の患者には自動車の運転、機械の操作、高所での作業等、危険を伴う作業に従事させないように注意すること。[11.1.2参照]
8.2 病的賭博(個人的生活の崩壊等の社会的に不利な結果を招くにもかかわらず、持続的にギャンブルを繰り返す状態)、病的性欲亢進、強迫性購買、暴食等の衝動制御障害があらわれることがあるため、このような症状が認められた場合には、投与を中止するなど適切な処置を行うこと。また、患者及び家族等にこのような衝動制御障害の症状について説明すること。[11.1.3参照]
8.3 起立性低血圧又は低血圧があらわれることがあるため、めまい、立ちくらみ、ふらつき等の症状が認められた場合には、投与を中止するなど適切な処置を行うこと。パーキンソン病患者では運動機能障害による転倒リスクが高く、起立性低血圧があらわれた場合には、転倒により骨折又は外傷に至るおそれがある。[11.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 網膜に関連する疾患又はその既往のある患者
網膜変性、ぶどう膜炎、遺伝性網膜症又は重度の進行性糖尿病網膜症のある患者、網膜への影響が生じるリスクが高いと考えられる眼疾患の既往のある患者(遺伝性網膜疾患の家族歴、色素性網膜炎、あらゆる活動性網膜症など)、及び白子症の患者については、視力・視野に関する症状の変化を定期的に観察すること。当該患者は臨床試験では除外されている。
動物実験では、反復経口投与毒性試験(ラット)及びがん原性試験(マウス及びラット)において、用量及び期間に依存した網膜変性が認められ、光曝露による増強がラットで確認された。この変化はサルでは認められなかった1)。
動物実験では、反復経口投与毒性試験(ラット)及びがん原性試験(マウス及びラット)において、用量及び期間に依存した網膜変性が認められ、光曝露による増強がラットで確認された。この変化はサルでは認められなかった1)。
9.3 肝機能障害患者
9.3.1 重度の肝機能障害のある患者(Child-Pugh分類C)
投与しないこと。本剤の血中濃度が上昇するおそれがある。当該患者は臨床試験では除外されている。[2.4参照]
9.3.2 中等度の肝機能障害のある患者(Child-Pugh分類B)
9.4 生殖能を有する者
妊娠する可能性のある女性には、本剤投与中及び最終投与後5日間において避妊する必要性及び適切な避妊法について説明すること。
動物実験(ラット)では、生殖発生毒性試験において雌ラットに黄体数及び着床数の軽度の減少が認められた2)。
動物実験(ラット)では、生殖発生毒性試験において雌ラットに黄体数及び着床数の軽度の減少が認められた2)。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。[2.6参照]
動物実験では、妊娠ラットの器官形成期に投与したところ、胎児に異所性精巣及び泌尿器系の変化(尿管拡張、腎盂拡張)、並びに骨格異常が認められた。また、レボドパ/カルビドパとの併用により、骨格奇形(肩甲骨の湾曲、長骨の短縮/湾曲/肥厚)の発現率が増加した。ウサギにおいては、レボドパ/カルビドパとの併用により、レボドパ/カルビドパの単独投与で認められた心血管系奇形(心室中隔欠損、心臓直結の1血管の拡張)の発現率が増加したことに加え、胚・胎児死亡率の増加が認められた。母動物(ラット)に出生前及び出生後に投与した試験では、出生児に死亡率の増加、及び肝胆道系の障害による変化(皮膚及び頭蓋骨の黄色/橙色化)が認められた2)。
動物実験では、妊娠ラットの器官形成期に投与したところ、胎児に異所性精巣及び泌尿器系の変化(尿管拡張、腎盂拡張)、並びに骨格異常が認められた。また、レボドパ/カルビドパとの併用により、骨格奇形(肩甲骨の湾曲、長骨の短縮/湾曲/肥厚)の発現率が増加した。ウサギにおいては、レボドパ/カルビドパとの併用により、レボドパ/カルビドパの単独投与で認められた心血管系奇形(心室中隔欠損、心臓直結の1血管の拡張)の発現率が増加したことに加え、胚・胎児死亡率の増加が認められた。母動物(ラット)に出生前及び出生後に投与した試験では、出生児に死亡率の増加、及び肝胆道系の障害による変化(皮膚及び頭蓋骨の黄色/橙色化)が認められた2)。
9.6 授乳婦
本剤投与中は授乳を避けさせること。
動物実験(ラット)では、授乳中の母動物にサフィナミドを投与した結果、哺乳児の肝細胞に空胞及びグリコーゲンの減少が認められた。また、哺乳児の血漿中にサフィナミドが検出され、乳汁中への移行が示唆された2)。
動物実験(ラット)では、授乳中の母動物にサフィナミドを投与した結果、哺乳児の肝細胞に空胞及びグリコーゲンの減少が認められた。また、哺乳児の血漿中にサフィナミドが検出され、乳汁中への移行が示唆された2)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
10.1 併用禁忌
| MAO阻害剤 セレギリン塩酸塩 エフピー ラサギリンメシル酸塩 アジレクト [2.1参照] | 高血圧クリーゼ及びセロトニン症候群等の重篤な副作用発現のおそれがある。本剤の投与を中止してから左記薬剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。また、左記薬剤の投与を中止してから本剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。 | 本剤はMAO-B阻害作用を有することから、相加作用のおそれがある。 |
| ペチジン塩酸塩含有製剤 ペチロルファン トラマドール塩酸塩含有製剤 トラマール トラムセット ワントラム ツートラム タペンタドール塩酸塩 タペンタ [2.2参照] | セロトニン症候群等の重篤な副作用発現のおそれがある。本剤の投与を中止してから左記薬剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。また、トラマドール塩酸塩含有製剤の投与を中止してから本剤の投与を開始するまでに、2〜3日間の間隔を置くこと。 | 機序は不明であるが、相加作用のおそれがある。 |
| 三環系抗うつ剤 アミトリプチリン塩酸塩 トリプタノール アモキサピン アモキサン イミプラミン塩酸塩 トフラニール イミドール クロミプラミン塩酸塩 アナフラニール ドスレピン塩酸塩 プロチアデン トリミプラミンマレイン酸塩 スルモンチール ノルトリプチリン塩酸塩 ノリトレン ロフェプラミン塩酸塩 アンプリット [2.3参照] | 他のMAO-B阻害剤との併用により、高血圧、失神、不全収縮、発汗、てんかん、動作・精神障害の変化及び筋強剛等の副作用があらわれ、さらに死亡例も報告されている。本剤の投与を中止してから左記薬剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。また、左記薬剤の投与を中止してから本剤の投与を開始するまでに、少なくとも2〜3日間の間隔を置くこと。 | 機序は不明であるが、相加・相乗作用のおそれがある。 |
| 四環系抗うつ剤 マプロチリン塩酸塩 ルジオミール ミアンセリン塩酸塩 テトラミド セチプチリンマレイン酸塩 テシプール [2.3参照] | 他のMAO-B阻害剤との併用により、高血圧、失神、不全収縮、発汗、てんかん、動作・精神障害の変化及び筋強剛等の副作用があらわれ、さらに死亡例も報告されている。本剤の投与を中止してから左記薬剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。また、左記薬剤の投与を中止してから本剤の投与を開始するまでに、少なくとも2〜3日間の間隔を置くこと。 | 機序は不明であるが、相加・相乗作用のおそれがある。 |
| 選択的セロトニン再取り込み阻害剤 フルボキサミンマレイン酸塩 デプロメール ルボックス パロキセチン塩酸塩水和物 パキシル セルトラリン塩酸塩 ジェイゾロフト エスシタロプラムシュウ酸塩 レクサプロ [2.3参照] | セロトニン症候群等の重篤な副作用発現のおそれがある。本剤の投与を中止してから左記薬剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。また、左記薬剤の投与を中止してから本剤の投与を開始するまでに、フルボキサミンマレイン酸塩は少なくとも7日間、パロキセチン塩酸塩水和物、セルトラリン塩酸塩及びエスシタロプラムシュウ酸塩は少なくとも14日間の間隔を置くこと。 | セロトニン再取り込み阻害作用により、脳内セロトニン濃度が高まるおそれがある。 |
| セロトニン再取り込み阻害・セロトニン受容体調節薬 ボルチオキセチン臭化水素酸塩 トリンテリックス [2.3参照] | セロトニン症候群等の重篤な副作用発現のおそれがある。本剤の投与を中止してから左記薬剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。また、左記薬剤の投与を中止してから本剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。 | セロトニン再取り込み阻害作用により、脳内セロトニン濃度が高まるおそれがある。 |
| セロトニン・ノルアドレナリン再取り込み阻害剤 ミルナシプラン塩酸塩 トレドミン デュロキセチン塩酸塩 サインバルタ ベンラファキシン塩酸塩 イフェクサー [2.3参照] | セロトニン症候群等の重篤な副作用発現のおそれがある。本剤の投与を中止してから左記薬剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。また、左記薬剤の投与を中止してから本剤の投与を開始するまでに、ミルナシプラン塩酸塩は2〜3日間、デュロキセチン塩酸塩は少なくとも5日間、ベンラファキシン塩酸塩は少なくとも7日間の間隔を置くこと。 | モノアミン神経伝達物質の分解が抑制され、脳内のモノアミン総量が増加するおそれがある。 |
| 選択的ノルアドレナリン再取り込み阻害剤 アトモキセチン塩酸塩 ストラテラ [2.3参照] | セロトニン症候群等の重篤な副作用発現のおそれがある。本剤の投与を中止してから左記薬剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。また、左記薬剤の投与を中止してから本剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。 | モノアミン神経伝達物質の分解が抑制され、脳内のモノアミン総量が増加するおそれがある。 |
| ノルアドレナリン・セロトニン作動性抗うつ剤 ミルタザピン リフレックス レメロン [2.3参照] | セロトニン症候群等の重篤な副作用発現のおそれがある。本剤の投与を中止してから左記薬剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。また、左記薬剤の投与を中止してから本剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。 | 脳内ノルアドレナリン、セロトニンの神経伝達が高まり、脳内のモノアミン総量が増加するおそれがある。 |
| フェンフルラミン塩酸塩 フィンテプラ [2.3参照] | セロトニン症候群等の重篤な副作用発現のおそれがある。本剤の投与を中止してから左記薬剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。また、左記薬剤の投与を中止してから本剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。 | 脳内セロトニン濃度が高まるおそれがある。 |
| 中枢神経刺激剤 メチルフェニデート塩酸塩 リタリン コンサータ リスデキサンフェタミンメシル酸塩 ビバンセ メタンフェタミン塩酸塩 ヒロポン [2.3参照] | 高血圧クリーゼ等の重篤な副作用発現のおそれがある。本剤の投与を中止してから左記薬剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。 | 脳内モノアミン総量が増加するおそれがある。 |
| マジンドール サノレックス [2.3参照] | 高血圧クリーゼ等の重篤な副作用発現のおそれがある。本剤の投与を中止してから左記薬剤の投与を開始するまでに、少なくとも14日間の間隔を置くこと。 | 脳内モノアミン総量が増加するおそれがある。 |
| トラマゾリン塩酸塩 トラマゾリン 塩酸テトラヒドロゾリン・プレドニゾロン コールタイジン ナファゾリン硝酸塩 プリビナ アプラクロニジン塩酸塩 アイオピジン [2.3参照] | 急激な血圧上昇を起こすおそれがある。 | カテコールアミンの蓄積をおこし、左記薬剤の交感神経刺激作用を増強するおそれがある。 |
10.2 併用注意
| トラゾドン塩酸塩 | トラゾドン塩酸塩の中止直後に本剤を投与又は併用する場合には、脳内セロトニン濃度が高まるおそれがある。 | セロトニン再取り込み阻害作用により、脳内のセロトニン濃度が高まるおそれがある。 |
| レセルピン誘導体 レセルピン | 本剤の作用が減弱されるおそれがある。 | 脳内ドパミンを減少させる。 |
| フェノチアジン系薬剤 クロルプロマジン ブチロフェノン系薬剤 ハロペリドール スルピリド メトクロプラミド | 本剤の作用が減弱されるおそれがある。 | 脳内ドパミン受容体を遮断する。 |
| デキストロメトルファン臭化水素酸塩水和物 | セロトニン症候群が発現するおそれがある。 | 脳内セロトニン濃度を上昇させる作用を有するため、脳内セロトニン濃度が更に上昇するおそれがある。 |
| リネゾリド | 高血圧クリーゼを含む血圧上昇等が発現するおそれがある。 | 非選択的、可逆的MAO阻害作用を有するリネゾリドとの併用により、相加作用のおそれがある。 |
| 交感神経刺激剤 エフェドリン塩酸塩 メチルエフェドリン塩酸塩 プソイドエフェドリン塩酸塩含有医薬品 フェニルプロパノールアミン塩酸塩含有医薬品 | 高血圧クリーゼを含む血圧上昇が発現するおそれがある。 | MAO-B選択性が低下した場合、交感神経刺激作用が増強されるおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 幻覚等の精神症状
幻視(3.2%)、幻覚(1.1%)等があらわれることがある。
11.1.2 傾眠(1.9%)、突発的睡眠(0.4%)
日中の傾眠や前兆のない突発的睡眠があらわれることがある。[8.1参照]
11.1.3 衝動制御障害(0.2%)
病的賭博、病的性欲亢進、強迫性購買、暴食等の衝動制御障害があらわれることがある。[8.2参照]
11.1.4 セロトニン症候群(頻度不明)
不安、焦燥、興奮、錯乱、発熱、ミオクローヌス、発汗、頻脈等のセロトニン症候群の症状が認められた場合には、投与を中止し、体温冷却及び補液等の全身管理とともに、適切な処置を行うこと。
11.1.5 悪性症候群(頻度不明)
急激な減量又は中止により、高熱、意識障害、高度の筋硬直、不随意運動、血清CK上昇等があらわれるおそれがある。このような症状が認められた場合には、体温冷却及び補液等の全身管理とともに、適切な処置を行うこと。
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 感染症 | 歯肉炎、上咽頭炎 | 肺炎 | ||
| 血液 | 貧血 | |||
| 代謝 | 食欲減退 | |||
| 精神神経系 | ジスキネジア(12.4%) | 不眠症、頭痛、浮動性めまい | せん妄、レム睡眠異常、側反弓、パーキンソン病、下肢静止不能症候群 | 激越、不安、錯乱状態、うつ病、落ち着きのなさ、無動、平衡障害、運動過多、振戦 |
| 感覚器 | 回転性めまい | 白内障、複視、霧視、視力低下、視力障害 | ||
| 循環器 | 低血圧 | 高血圧、起立性低血圧 | ||
| 呼吸器 | 呼吸困難 | |||
| 消化器 | 悪心、便秘 | 消化不良、胃炎、嘔吐 | 腹部不快感、腹痛、下痢、嘔気 | |
| 皮膚 | 紅斑、多汗症、光線過敏性反応 | |||
| 筋骨格系 | 背部痛、姿勢異常、変形性脊椎症 | 関節痛、筋固縮、筋痙縮 | ||
| 全身症状 | 転倒 | 歩行障害、末梢性浮腫、口渇 | 無力症、状態悪化、疲労、倦怠感 | |
| 臨床検査 | ALT増加 | AST増加、ALP増加、γ-GTP増加、血中カリウム増加、尿中ブドウ糖陽性、血圧低下、体重減少 | 血圧上昇 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人健康成人にサフィナミド50mg、100mg及び200mgを絶食下単回経口投与したときのサフィナミドの血漿中濃度推移及び血漿中薬物動態パラメータは以下のとおりであった3)。
図1 日本人健康成人における絶食下単回経口投与時のサフィナミドの血漿中濃度推移
| 投与量 | 評価例数 | tmaxa)(hr) | Cmax(ng/mL) | AUC0-∞(ng・hr/mL) | t1/2(hr) |
| 50mg | 8 | 3.5(1.0-6.0) | 463.02±52.54 | 14343.2±3085.4 | 24.16±2.37 |
| 100mg | 8 | 1.0(1.0-5.0) | 1006.71±209.13 | 24440.0±2178.2 | 22.39±2.36 |
| 200mg | 8 | 1.5(1.0-5.0) | 2172.88±298.69 | 53845.3±8751.0 | 20.44±2.85 |
注)本剤の承認された1日用量は通常50mg、最大100mgである。
16.1.2 反復投与
日本人健康成人にサフィナミド50mg、100mg及び200mgを食後に1日1回7日間反復経口投与(第7日のみ絶食)したとき、最終投与後のサフィナミドの血漿中薬物動態パラメータは以下のとおりであった。サフィナミドを反復投与したときのCmax及びAUCは、投与量に比例して増加した。Cmax及びAUC0-24の累積係数(第7日/第1日の比)は1.9〜2.0であり、各用量とも蓄積性はなく、投与開始6日目には定常状態となった3)。
| 投与量(評価例数) | 投与日 | tmaxa)(hr) | Cmax(ng/mL) | AUC0-24h(ng・hr/mL) | t1/2(hr) |
| 50mg (8例) | 第1日 | 3.0(0.5-4.0) | 398.51±72.98 | 5647.5±793.8 | 18.67±2.97 |
| 第7日 | 1.0(1.0-6.0) | 745.84±93.40 | 11434.4±1758.3 | 21.61±1.92 | |
| 100mg (7例) | 第1日 | 4.0(3.0-5.0) | 936.06±154.02 | 13989.5±2325.7 | 18.90±3.52 |
| 第7日 | 1.0(0.5-6.0) | 1819.01±451.92 | 28754.7±7215.5 | 21.56±2.91 | |
| 200mg (8例) | 第1日 | 3.0(2.0-4.0) | 1842.86±214.24 | 26595.0±2479.9 | 18.16±1.45 |
| 第7日 | 1.0(1.0-5.0) | 3632.43±547.66 | 53976.0±5553.3 | 20.39±2.16 |
注)本剤の承認された1日用量は通常50mg、最大100mgである。
16.2 吸収
日本人健康成人への絶食条件下における単回及び反復経口投与時には、サフィナミドの吸収は速やかであり、tmaxは1.0〜3.5時間であった3)[16.1参照]。また、健康成人にサフィナミド50mgを単回経口投与したときの生物学的利用率は95%であった4)(外国人データ)。
日本人健康成人(8例)に、空腹時及び食後にサフィナミド50mgを単回経口投与したときの血漿中薬物動態パラメータ(Cmax、tmax、t1/2及びAUC0-t)を比較した結果、食事の影響は認められなかった5)。
16.3 分布
16.4 代謝
16.5 排泄
健康成人に14C-サフィナミド400mgを単回経口投与したとき、総放射能の78%が排泄された(尿中に76%、糞中に1.5%)。投与後48時間以内の尿中に検出される未変化体は投与量の僅かでありサフィナミドの多くが代謝を受けることが示された9)(外国人データ)。
日本人健康成人にサフィナミド50mg、100mg及び200mgを単回経口投与したとき、投与96時間後までに、未変化体として4.5〜4.9%が尿中に排泄され、各代謝物の投与96時間までの累積尿中排泄率はプロピオン酸体が31.5〜34.3%、安息香酸体が0.22〜0.25%及びグルクロン酸抱合体が28.4〜32.8%であった3)。
注)本剤の承認された1日用量は通常50mg、最大100mgである。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
中等度腎機能低下者(eGFR30〜59mL/分)及び重度腎機能低下者(eGFR<30mL/分で血液透析を必要としない)にサフィナミド50mgを単回経口投与した時、血漿中薬物動態パラメータは腎機能正常者(eGFR>90mL/分)と同程度であった10)(外国人データ)。
16.6.2 肝機能障害患者
16.7 薬物相互作用
16.7.1 ケトコナゾール
健康成人(14例)にケトコナゾール(CYP3A4阻害剤)200mgを1日2回6日間反復投与し、サフィナミド100mgを単回投与した時、サフィナミド単独投与時と比較して、Cmax及びAUC0-∞はそれぞれ6.6%及び12.9%増加した8)(外国人データ)。
16.7.2 ミダゾラム
健康成人(16例)を対象にサフィナミド100mgを1日1回14日間反復投与し、ミダゾラム(CYP3A4基質)7.5mgを単回投与した時、ミダゾラム単独投与時と比較して、Cmax及びAUC0-tはそれぞれ2%及び20%減少した12)(外国人データ)。
16.7.3 カフェイン
健康成人(16例)を対象にサフィナミド100mgを1日1回14日間反復投与し、カフェイン(CYP1A2基質)200mgを単回投与した時、カフェイン単独投与時と比較して、Cmax及びAUC0-tはそれぞれ7%及び13%増加した13)(外国人データ)。
16.7.4 ロスバスタチン
健康成人(24例)を対象にサフィナミド100mgを1日1回11日間反復投与し、ロスバスタチンカルシウム(BCRP基質)20mgを単回投与した時、ロスバスタチンカルシウム単独投与時と比較して、Cmax及びAUC0-tはそれぞれ29%及び21%増加した14)(外国人データ)。
16.7.5 レボドパ/カルビドパ
パーキンソン病患者(24例)にレボドパ/カルビドパ投与下でサフィナミド100mgを1日1回6日間反復投与した時、レボドパ/カルビドパ単独投与時と比較して、レボドパのCmax及びAUC0-6はそれぞれ0.6%及び7.2%減少した15)(外国人データ)。
16.7.6 CYPの誘導
ヒト肝細胞を用いた酵素誘導試験において、サフィナミドは1μM以上の濃度でCYP2B6のmRNA発現をコントロール群の2倍以上に増加させたことから、サフィナミドはCYP2B6を誘導する可能性が示唆された16)(in vitro)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II/III相試験
レボドパ含有製剤で治療中のwearing off現象を有する日本人のパーキンソン病患者を対象とした無作為化二重盲検比較試験において、最終評価時における1日平均on時間のベースラインからの変化量について、プラセボ群と比較して本剤50mg群及び100mg群でそれぞれ統計学的に有意な増加が認められた17)(p=0.0002及びp<0.0001)。
| 投与群(評価例数) | 最終評価時−ベースラインa)(時間) | プラセボ群との比較b) | |
| 変化量の群間差 [95%信頼区間,下限,上限] | p値 | ||
| プラセボ群(136例) | −0.17±0.26 | − | − |
| 本剤50mg群(131例) | 1.22±0.26 | 1.39 [0.67,2.11] | 0.0002 |
| 本剤100mg群(128例) | 1.49±0.26 | 1.66 [0.93,2.39] | <0.0001 |
副作用発現率は、50mg群で31.6%(42/133例)、100mg群で30.3%(40/132例)であった。主な副作用は、50mg群でジスキネジア8.3%(11/133例)、幻視3.0%(4/133例)、頭痛2.3%(3/133例)、傾眠2.3%(3/133例)及び悪心2.3%(3/133例)、100mg群でジスキネジア10.6%(14/132例)、幻視4.5%(6/132例)、傾眠2.3%(3/132例)、悪心2.3%(3/132例)、体重減少2.3%(3/132例)及び食欲減退2.3%(3/132例)であった17)。
17.1.2 国内第III相試験
レボドパ含有製剤で治療中のwearing off現象を有する日本人のパーキンソン病患者を対象とした非盲検長期投与試験において、本剤50〜100mg/日投与における1日平均on時間のベースラインからの変化量(平均値±標準偏差)は、投与4週後で1.05±1.74時間(193例)、52週後で1.42±2.72時間(142例)であり、長期投与時も効果が持続した18)。
副作用発現率は、38.9%(79/203例)であった。主な副作用は、ジスキネジア16.3%(33/203例)、転倒3.4%(7/203例)、便秘3.0%(6/203例)、幻視2.5%(5/203例)、不眠症2.5%(5/203例)及び悪心2.5%(5/203例)であった18)。
17.3 その他
17.3.1 QT間隔に対する影響
健康成人を対象にサフィナミド100及び350mgを1日1回6日間反復投与した時、QTc間隔は投与1時間後に最小値となり、プラセボ群との差はそれぞれ−5.4及び−15.5msecであった。この作用はサフィナミドの血漿中濃度と相関性を示した19)(外国人データ)。
注)本剤の承認された1日用量は通常50mg、最大100mgである。
18. 薬効薬理
18.1 作用機序
サフィナミドは、選択的かつ可逆的なMAO-B阻害作用を有し、内因性及びレボドパ製剤由来のドパミンの脳内濃度を高める。このMAO-B阻害作用がサフィナミドの主要な作用機序と考えられる。また、サフィナミドは非ドパミン作動性作用(電位依存性ナトリウムチャネル阻害作用を介するグルタミン酸放出抑制作用)を併せ持つ。
18.2 薬理作用
18.2.1 MAO-B阻害作用
18.2.2 電位依存性ナトリウムチャネル阻害作用
18.2.3 パーキンソン病モデルにおける効果
19. 有効成分に関する理化学的知見
19.1. サフィナミドメシル酸塩
20. 取扱い上の注意
アルミピロー又は瓶開封後は湿気を避けて保存すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
100錠[10錠(PTP)×10シート、乾燥剤入り]
500錠[瓶、バラ、乾燥剤入り]
23. 主要文献
- 社内資料:反復投与毒性試験等(2019年9月20日承認、CTD2.6.6.3、2.6.6.5)
- 社内資料:生殖発生毒性試験(2019年9月20日承認、CTD2.6.6.6)
- 社内資料:健康成人における薬物動態試験(2019年9月20日承認、CTD2.7.6.6)
- 社内資料:生物学的利用率試験(2019年9月20日承認、CTD2.7.6.2)
- 社内資料:食事の影響試験(2019年9月20日承認、CTD2.7.6.1)
- 社内資料:In vitro血漿蛋白結合率試験(2019年9月20日承認、CTD2.6.4.4.8)
- 社内資料:In vitro代謝試験(2019年9月20日承認、CTD2.6.4.5)
- 社内資料:薬物相互作用試験(ケトコナゾール)(2019年9月20日承認、CTD2.7.6.14)
- 社内資料:健康成人におけるマスバランス試験(2019年9月20日承認、CTD2.7.6.10)
- 社内資料:腎機能障害者における薬物動態試験(2019年9月20日承認、CTD2.7.6.11)
- 社内資料:肝機能障害者における薬物動態試験(2019年9月20日承認、CTD2.7.6.12)
- 社内資料:薬物相互作用試験(ミダゾラム)(2019年9月20日承認、CTD2.7.6.15)
- 社内資料:薬物相互作用試験(カフェイン)(2019年9月20日承認、CTD2.7.6.15)
- 社内資料:薬物相互作用試験(ロスバスタチン)(2019年9月20日承認、CTD2.7.6.19)
- 社内資料:薬物相互作用試験(レボドパ/カルビドパ)(2019年9月20日承認、CTD2.7.6.16)
- 社内資料:In vitro酵素誘導試験(2019年9月20日承認、CTD2.6.4.7)
- 社内資料:国内第II/III相試験(2019年9月20日承認、CTD2.7.6.25)
- 社内資料:国内長期投与試験(2019年9月20日承認、CTD2.7.6.35)
- 社内資料:QT/QTc評価試験(2019年9月20日承認、CTD2.7.6.20)
- 社内資料:薬効薬理試験(2019年9月20日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
製品情報問い合わせ先
エーザイ株式会社
hhcホットライン
〒112-8088
東京都文京区小石川4-6-10
電話:フリーダイヤル 0120-419-497
26. 製造販売業者等
26.1 製造販売元
エーザイ株式会社
東京都文京区小石川4-6-10