医薬品情報
| 総称名 | オキシコドン |
|---|---|
| 一般名 | オキシコドン塩酸塩水和物 |
| 欧文一般名 | Oxycodone Hydrochloride Hydrate |
| 製剤名 | オキシコドン塩酸塩水和物徐放カプセル |
| 薬効分類名 | 持続性がん疼痛治療剤 |
| 薬効分類番号 | 8119 |
| ATCコード | N02AA05 |
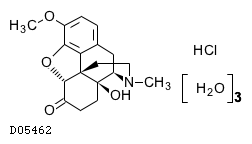
| KEGG DRUG |
D05462
オキシコドン塩酸塩水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年11月 改訂(第3版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 25.保険給付上の注意 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オキシコドン徐放カプセル5mg「テルモ」 | Oxycodone SR Capsules | 帝國製薬 | 8119002N1023 | 121.4円/カプセル | 劇薬, 麻薬, 処方箋医薬品注) |
| オキシコドン徐放カプセル10mg「テルモ」 | Oxycodone SR Capsules | 帝國製薬 | 8119002N2020 | 233.6円/カプセル | 劇薬, 麻薬, 処方箋医薬品注) |
| オキシコドン徐放カプセル20mg「テルモ」 | Oxycodone SR Capsules | 帝國製薬 | 8119002N3026 | 433.7円/カプセル | 劇薬, 麻薬, 処方箋医薬品注) |
| オキシコドン徐放カプセル40mg「テルモ」 | Oxycodone SR Capsules | 帝國製薬 | 8119002N4022 | 799.1円/カプセル | 劇薬, 麻薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 重篤な呼吸抑制のある患者、重篤な慢性閉塞性肺疾患の患者[呼吸抑制を増強する。][11.1.3参照]
2.2 気管支喘息発作中の患者[呼吸を抑制し、気道分泌を妨げる。]
2.3 慢性肺疾患に続発する心不全の患者[呼吸抑制や循環不全を増強する。][9.1.2参照]
2.4 痙攣状態(てんかん重積症、破傷風、ストリキニーネ中毒)にある患者[脊髄の刺激効果があらわれる。][9.1.14参照]
2.5 麻痺性イレウスの患者[消化管運動を抑制する。][11.1.6参照]
2.6 急性アルコール中毒の患者[呼吸抑制を増強する。]
2.7 アヘンアルカロイドに対し過敏症の患者
2.8 出血性大腸炎の患者[腸管出血性大腸菌(O157等)や赤痢菌等の重篤な細菌性下痢のある患者では、症状の悪化、治療期間の延長を来すおそれがある。][9.1.1参照]
2.9 ナルメフェン塩酸塩水和物を投与中又は投与中止後1週間以内の患者[10.1参照]
4. 効能または効果
中等度から高度の疼痛を伴う各種癌における鎮痛
6. 用法及び用量
通常、成人にはオキシコドン塩酸塩(無水物)として1日10〜80mgを2回に分割経口投与する。
なお、症状に応じて適宜増減する。
なお、症状に応じて適宜増減する。
7. 用法及び用量に関連する注意
7.1 初回投与
本剤の投与開始前のオピオイド鎮痛薬による治療の有無を考慮して、1日投与量を決め、2分割して12時間ごとに投与すること。
7.1.1 オピオイド鎮痛薬を使用していない患者には、疼痛の程度に応じてオキシコドン塩酸塩として10〜20mgを1日投与量とすることが望ましい。
7.1.2 モルヒネ製剤の経口投与を本剤に変更する場合には、モルヒネ製剤1日投与量の2/3量を1日投与量の目安とすることが望ましい。
7.1.3 経皮フェンタニル貼付剤から本剤へ変更する場合には、経皮フェンタニル貼付剤剥離後にフェンタニルの血中濃度が50%に減少するまで17時間以上かかることから、剥離直後の本剤の使用は避け、本剤の使用を開始するまでに、フェンタニルの血中濃度が適切な濃度に低下するまでの時間をあけるとともに、本剤の低用量から投与することを考慮すること。
7.2 疼痛増強時
本剤服用中に疼痛が増強した場合や鎮痛効果が得られている患者で突発性の疼痛が発現した場合は、直ちにオキシコドン塩酸塩等の即放性製剤の追加投与(レスキュー薬の投与)を行い鎮痛を図ること。
7.3 増量
本剤投与開始後は患者の状態を観察し、適切な鎮痛効果が得られ副作用が最小となるよう用量調整を行うこと。5mgから10mgへの増量の場合を除き増量の目安は、使用量の25〜50%増とする。[8.5参照]
7.4 減量
7.5 投与の中止
8. 重要な基本的注意
8.1 本剤は徐放性製剤であることから、急激な血中濃度の上昇による重篤な副作用の発現を避けるため、服用に際してカプセルの内容物を砕いたり、すりつぶしたりしないで、そのまま噛まずに服用させること。
8.2 連用により薬物依存を生じることがあるので、観察を十分に行い、慎重に投与すること。[11.1.2参照]
8.3 眠気、眩暈が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないように注意すること。
8.4 本剤を投与する場合には、便秘に対する対策として緩下剤、嘔気・嘔吐に対する対策として制吐剤の併用を、また、鎮痛効果が得られている患者で通常とは異なる強い眠気がある場合には、過量投与の可能性を念頭において本剤の減量を考慮するなど、本剤投与時の副作用に十分注意すること。[13.1、13.2参照]
8.5 本剤を増量する場合には、副作用に十分注意すること。[7.3参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 細菌性下痢のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。治療期間の延長を来すおそれがある。[2.8参照]
9.1.2 心機能障害あるいは低血圧のある患者
循環不全を増強するおそれがある。[2.3参照]
9.1.3 呼吸機能障害のある患者
呼吸抑制を増強するおそれがある。[11.1.3参照]
9.1.4 脳に器質的障害のある患者
呼吸抑制や頭蓋内圧の上昇を起こすおそれがある。
9.1.5 ショック状態にある患者
循環不全や呼吸抑制を増強するおそれがある。[11.1.1参照]
9.1.6 代謝性アシドーシスのある患者
呼吸抑制を起こしたときアシドーシスを増悪させるおそれがある。
9.1.7 甲状腺機能低下症(粘液水腫等)の患者
呼吸抑制や昏睡を起こすおそれがある。
9.1.8 副腎皮質機能低下症(アジソン病等)の患者
呼吸抑制作用に対し、感受性が高くなっている。
9.1.9 薬物・アルコール依存又はその既往歴のある患者
依存性を生じやすい。[9.1.10参照]
9.1.10 薬物、アルコール等による精神障害のある患者
症状が増悪するおそれがある。[9.1.9参照]
9.1.11 衰弱者
呼吸抑制作用に対し、感受性が高くなっている。
9.1.12 前立腺肥大による排尿障害、尿道狭窄、尿路手術術後の患者
排尿障害を増悪することがある。
9.1.13 器質的幽門狭窄又は最近消化管手術を行った患者
消化管運動を抑制する。
9.1.14 痙攣の既往歴のある患者
痙攣を誘発するおそれがある。[2.4参照]
9.1.15 胆嚢障害、胆石症又は膵炎の患者
オッジ筋を収縮させ症状が増悪することがある。
9.1.16 重篤な炎症性腸疾患のある患者
連用した場合、巨大結腸症を起こすおそれがある。
9.2 腎機能障害患者
排泄が遅延し副作用があらわれるおそれがある。
9.3 肝機能障害患者
代謝が遅延し副作用があらわれるおそれがある。
9.5 妊婦
9.5.1 妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。オキシコドンでは催奇形作用は認められていないが、類薬のモルヒネの動物試験(マウス、ラット)で催奇形作用が報告されている。
9.5.2 分娩前に投与した場合、出産後新生児に退薬症候(多動、神経過敏、不眠、振戦等)があらわれることがある。
9.5.3 分娩時の投与により、新生児に呼吸抑制があらわれることがある。
9.6 授乳婦
本剤投与中は授乳を避けさせること。ヒト母乳中へ移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら、慎重に投与すること。一般に生理機能が低下しており、特に呼吸抑制の感受性が高い。なお、薬物動態において高齢者と非高齢者成人には差がなかった。
10. 相互作用
相互作用序文
本剤は、主として薬物代謝酵素CYP3A4及び一部CYP2D6で代謝される。[16.4参照]
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2D6
10.1 併用禁忌
| ナルメフェン塩酸塩水和物 セリンクロ [2.9参照] | 本剤の鎮痛作用を減弱させることがある。また、退薬症候を起こすことがある。 | μオピオイド受容体拮抗作用により、本剤の作用が競合的に阻害される。 |
10.2 併用注意
| 中枢神経抑制剤 フェノチアジン誘導体、バルビツール酸誘導体等 吸入麻酔剤 MAO阻害剤 三環系抗うつ剤 β遮断剤 アルコール | 臨床症状:呼吸抑制、低血圧及び顕著な鎮静又は昏睡が起こることがある。 措置方法:減量するなど慎重に投与すること。 | 相加的に中枢神経抑制作用を増強させる。 |
| クマリン系抗凝血剤 ワルファリンカリウム | クマリン系抗凝血剤の作用が増強されることがあるので投与量を調節するなど慎重に投与すること。 | 機序は不明である。 |
| 抗コリン作用を有する薬剤 フェノチアジン系薬剤、三環系抗うつ剤等 | 臨床症状:麻痺性イレウスに至る重篤な便秘又は尿貯留が起こることがある。 | 相加的に抗コリン作用を増強させる。 |
| ブプレノルフィン、ペンタゾシン等 | 本剤の鎮痛作用を減弱させることがある。また、退薬症候を起こすことがある。 | ブプレノルフィン、ペンタゾシン等は本剤の作用するμ受容体の部分アゴニストである。 |
| CYP3A4阻害作用を有する薬剤 ボリコナゾール、イトラコナゾール、フルコナゾール、リトナビル、クラリスロマイシン等 [16.7.1-16.7.3参照] | 本剤の血中濃度が上昇し、副作用が発現するおそれがあるので、観察を十分に行い、慎重に投与すること。 | CYP3A4を介する本剤の代謝が阻害される。 |
| CYP3A4誘導作用を有する薬剤 リファンピシン、カルバマゼピン、フェニトイン等 [16.7.4参照] | 本剤の血中濃度が低下し、作用が減弱する可能性がある。なお、これらの薬剤の中止後に、本剤の血中濃度が上昇し、副作用が発現するおそれがあるので、観察を十分に行い、慎重に投与すること。 | CYP3A4を介する本剤の代謝が促進される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
顔面蒼白、血圧低下、呼吸困難、頻脈、全身発赤、血管浮腫、蕁麻疹等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。[9.1.5参照]
11.1.2 依存性(頻度不明)
11.1.3 呼吸抑制(頻度不明)
11.1.4 錯乱、譫妄(いずれも頻度不明)
11.1.5 無気肺、気管支痙攣、喉頭浮腫(いずれも頻度不明)
11.1.6 麻痺性イレウス、中毒性巨大結腸(いずれも頻度不明)
炎症性腸疾患の患者に投与した場合、中毒性巨大結腸があらわれるとの報告がある。[2.5参照]
11.1.7 肝機能障害(1.4%注1))
AST、ALT、Al-P等の著しい上昇を伴う肝機能障害があらわれることがある。
注1)頻度は国内第III相試験(がん性疼痛患者を対象としたオキシコドン塩酸塩水和物徐放錠(オキシコンチン錠)からの切り替え試験)における頻度
11.2 その他の副作用
| 5%以上注1) | 5%未満注1) | 頻度不明注1) | |
| 過敏症 | 発疹、蕁麻疹 | ||
| 循環器 | 不整脈、血圧変動、低血圧、起立性低血圧、失神 | ||
| 精神神経系 | 傾眠、意識障害 | 眠気、眩暈、発汗、幻覚、しびれ、筋れん縮、頭痛、頭重感、焦燥、不安、異夢、悪夢、視調節障害、不眠、抑うつ、感情不安定、興奮、縮瞳、神経過敏、感覚異常、痙攣、振戦、筋緊張亢進、健忘、多幸感、思考異常、構語障害、痛覚過敏注2)、アロディニア | |
| 消化器 | 便秘(39.4%)、嘔気 | 嘔吐 | 下痢、食欲不振、胃不快感、口渇、腹痛、鼓腸、おくび、味覚異常、嚥下障害、オッジ筋の機能不全 |
| その他 | そう痒感、発熱、脱力感、倦怠感、胸部圧迫感、血管拡張(顔面潮紅、熱感)、排尿障害、尿閉、脱水、呼吸困難、悪寒、頭蓋内圧の亢進、無月経、性欲減退、勃起障害、浮腫、皮膚乾燥 |
13. 過量投与
14. 適用上の注意
14.1 薬剤交付時の注意
16. 薬物動態
16.1 血中濃度
16.1.1 生物学的同等性
オキシコドン徐放カプセル40mg「テルモ」とオキシコンチン錠40mgをクロスオーバー法によりそれぞれオキシコドンとして40mgを健康成人に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.8)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された1)。
なお、オキシコドンの主要代謝物であるノルオキシコドンについても同時に血漿中濃度を測定し解析したところ、薬物動態パラメータはオキシコンチン錠40mgと同程度であった。
なお、オキシコドンの主要代謝物であるノルオキシコドンについても同時に血漿中濃度を測定し解析したところ、薬物動態パラメータはオキシコンチン錠40mgと同程度であった。
図1 絶食単回経口投与時の血漿中オキシコドン濃度推移
| n | AUC0-48(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | ||
| オキシコドン徐放カプセル40mg「テルモ」 | オキシコドン | 24 | 552.3±103.3 | 54.7±10.6 | 2.7±1.6 | 6.1±1.5 |
| ノルオキシコドン | 635.8±177.1 | 48.8±12.4 | 3.9±1.3 | 6.5±0.8 | ||
| オキシコンチン錠40mg(徐放錠) | オキシコドン | 24 | 572.6±113.3 | 53.3±12.0 | 2.5±1.2 | 5.0±1.1 |
| ノルオキシコドン | 657.4±169.6 | 48.0±8.6 | 3.3±1.1 | 6.5±1.1 | ||
血漿中濃度並びにAUC、Cmax等のパラメータは被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 バイオアベイラビリティ
16.2.2 食事の影響
オキシコドン徐放カプセル40mg「テルモ」とオキシコンチン錠40mgをクロスオーバー法によりそれぞれオキシコドンとして40mgを健康成人に食後単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.8)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された4)。
なお、オキシコドンの主要代謝物であるノルオキシコドンについても同時に血漿中濃度を測定し解析したところ、薬物動態パラメータはオキシコンチン錠40mgと同程度であった。
なお、オキシコドンの主要代謝物であるノルオキシコドンについても同時に血漿中濃度を測定し解析したところ、薬物動態パラメータはオキシコンチン錠40mgと同程度であった。
図2 食後単回経口投与時の血漿中オキシコドン濃度推移
| n | AUC0-48(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | ||
| オキシコドン徐放カプセル40mg「テルモ」 | オキシコドン | 23 | 604.2±114.9 | 68.1±19.2 | 6.0±2.1 | 5.8±2.0 |
| ノルオキシコドン | 490.4±111.5 | 38.9±12.6 | 6.7±2.3 | 6.5±0.8 | ||
| オキシコンチン錠40mg(徐放錠) | オキシコドン | 23 | 632.6±114.8 | 62.3±10.5 | 4.5±2.5 | 4.5±0.9 |
| ノルオキシコドン | 516.9±139.9 | 35.1±9.2 | 5.2±2.3 | 5.9±0.9 | ||
血漿中濃度並びにAUC、Cmax等のパラメータは被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2.3 オキシコドン及びノルオキシコドンの血漿中濃度(トラフ値)
一定用量のオキシコドン塩酸塩水和物徐放錠が3日間以上投与され疼痛がコントロールされているがん性疼痛患者60例に対して、同用量の本剤を5日間投与した切り替え試験において、切り替え前後のオキシコドン及びノルオキシコドン血漿中濃度(トラフ値)に大きな変動は認められなかった5)。
16.3 分布
16.3.1 血清蛋白結合率
限外ろ過法を用いて測定したヒト血清蛋白結合率は45.0〜45.8%であり、主としてアルブミンと結合する6)。
16.3.2 母乳中への移行
オキシコドン塩酸塩とアセトアミノフェンの合剤を授乳婦6例に経口投与したとき、母乳への移行が認められ、そのときの投与0.25〜12時間後におけるオキシコドン塩酸塩の乳汁/血漿中濃度の平均比率は3.4であった7)(外国人データ)。
16.4 代謝
16.5 排泄
健康成人16例にオキシコドン15mgを経口投与したとき、投与後48時間までの尿中に投与量の8.9±2.6%が排泄され、大部分が非抱合体であった。また、ノルオキシコドンも非抱合体として22.1±9.0%が、オキシモルフォンはほぼ抱合化されて10.7±5.5%が尿中に排泄された。なお、未変化体及び代謝物(抱合体を含む)は投与48時間後までの尿中に投与量の72±19%が排泄された9)(外国人データ)。
16.7 薬物相互作用
16.7.1 ボリコナゾール〔400mg/日(2日目のみ600mg/日)〕の経口投与中にオキシコドン塩酸塩(10mg)を単回経口投与した場合、オキシコドンのCmaxが1.72倍、AUCが3.61倍上昇したとの報告がある10)(外国人データ)。[10.2参照]
16.7.2 リトナビル(600mg/日)の経口投与中にオキシコドン塩酸塩(10mg)を単回経口投与した場合、オキシコドンのCmaxが1.74倍、AUCが2.95倍上昇したとの報告がある11)(外国人データ)。[10.2参照]
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(がん性疼痛患者を対象としたオキシコドン塩酸塩水和物徐放錠(オキシコンチン錠)からの切り替え試験)
一定用量のオキシコドン塩酸塩水和物徐放錠(オキシコンチン錠)が3日間以上投与され疼痛がコントロールされているがん性疼痛患者71例に対して、同用量の本剤を5日間投与した切り替え試験において、本剤の疼痛コントロールの維持率は81.7%(58/71例)であった。副作用の発現頻度は、47.9%(34/71例)であり、主な副作用は便秘39.4%(28/71例)、悪心8.5%(6/71例)、嘔吐2.8%(2/71例)、傾眠2.8%(2/71例)であった。重症又は重篤な副作用は認められなかった5)。
| 疼痛コントロール達成例数/評価対象例数 | 疼痛コントロールの維持率注)[95%信頼区間] |
| 58/71 | 81.7%[0.71-0.90] |
18. 薬効薬理
18.1 作用機序
モルヒネと同様にμオピオイド受容体を介して鎮痛作用を示すものと考えられる。
18.2 薬理作用
鎮痛作用について、マウスのTail flick法(TF)、Hot plate法(HP)及びパラフェニルキノンライジング法(PPQ)を用いて皮下投与で検討した結果、オキシコドンはモルヒネ硫酸塩と比べて、ED50値で0.62〜2.04倍の鎮痛作用を示した14)。
| 試験法 | オキシコドン | モルヒネ硫酸塩 |
| TF | 0.94[0.40-2.20] | 1.92[0.89-4.14] |
| HP | 1.37[0.48-3.92] | 0.85[0.39-1.86] |
| PPQ | 0.38[0.19-0.75] | 0.40[0.20-0.80] |
19. 有効成分に関する理化学的知見
19.1. オキシコドン塩酸塩水和物
22. 包装
<オキシコドン徐放カプセル5mg「テルモ」>
40カプセル、100カプセル(PTP包装)
<オキシコドン徐放カプセル10mg「テルモ」>
40カプセル、100カプセル(PTP包装)
<オキシコドン徐放カプセル20mg「テルモ」>
40カプセル、100カプセル(PTP包装)
<オキシコドン徐放カプセル40mg「テルモ」>
40カプセル、100カプセル(PTP包装)
23. 主要文献
- 社内資料(生物学的同等性試験に関する資料1)
- Poyhia R,et al., Br.J.Clin.Pharmacol., 33 (6), 617-621, (1992) »PubMed
- Leow KP,et al., Clin.Pharmacol.Ther., 52 (5), 487-495, (1992) »PubMed
- 社内資料(生物学的同等性試験に関する資料2)
- 社内資料(がん性疼痛患者における切り替え臨床試験に関する資料)
- Leow KP,et al., Ther.Drug.Monit., 15 (5), 440-447, (1993) »PubMed
- Marx CM,et al., Drug.Intell.Clin.Pharm., 20, 474, (1986)
- Lalovic B,et al., Drug.Metab.Dispos., 32 (4), 447-454, (2004) »PubMed
- Lalovic B,et al., Clin.Pharmacol.Ther., 79 (5), 461-479, (2006) »PubMed
- Hagelberg NM,et al., Eur.J.Clin.Pharmacol., 65 (3), 263-271, (2009) »PubMed
- Nieminen TH,et al., Eur.J.Clin.Pharmacol., 66 (10), 977-985, (2010) »PubMed
- Liukas A,et al., J.Clin.Psychopharmacol., 31 (3), 302-308, (2011) »PubMed
- Nieminen TH,et al., Anesthesiology., 110 (6), 1371-1378, (2009) »PubMed
- Beardsley PM,et al., Exp.Clin.Psychopharmacol., 12 (3), 163-172, (2004) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
テルモ株式会社
テルモ・コールセンター
〒259-0151
神奈川県足柄上郡中井町井ノ口1500
電話:0120-12-8195
製品情報問い合わせ先
テルモ株式会社
テルモ・コールセンター
〒259-0151
神奈川県足柄上郡中井町井ノ口1500
電話:0120-12-8195
25. 保険給付上の注意
本剤は厚生労働省告示第75号(平成24年3月5日付)に基づき、投薬量は1回30日分を限度とされている。
26. 製造販売業者等
26.1 製造販売元
帝國製薬株式会社
香川県東かがわ市三本松567番地
26.2 販売元
テルモ株式会社
東京都渋谷区幡ヶ谷2-44-1
26.3 提携
Ethypharm