医薬品情報
| 総称名 | アイラミド |
|---|---|
| 一般名 | ブリモニジン酒石酸塩 ブリンゾラミド |
| 欧文一般名 | Brimonidine Tartrate Brinzolamide |
| 製剤名 | ブリモニジン酒石酸塩・ブリンゾラミド配合懸濁性点眼液 |
| 薬効分類名 | α2作動薬/炭酸脱水酵素阻害薬配合剤 緑内障・高眼圧症治療剤 |
| 薬効分類番号 | 1319 |
| ATCコード | S01EC54 |
| KEGG DRUG |
D10854
ブリンゾラミド・ブリモニジン酒石酸塩
|
| KEGG DGROUP |
DG03201
眼圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年6月 改訂(第4版)

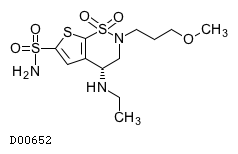
|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アイラミド配合懸濁性点眼液 | AILAMIDE COMBINATION OPHTHALMIC SUSPENSION | 千寿製薬 | 1319825Q1025 | 378.4円/mL | 処方箋医薬品注) |
2. 禁忌
4. 効能または効果
5. 効能または効果に関連する注意
単剤での治療を優先すること。
6. 用法及び用量
1回1滴、1日2回点眼する。
8. 重要な基本的注意
8.1 全身的に吸収される可能性があり、α2-作動剤又はスルホンアミド系薬剤の全身投与時と同様の副作用があらわれることがあるので、留意すること。
8.2 眠気、めまい、霧視等を起こすことがあるので、本剤投与中の患者には、自動車の運転等危険を伴う機械の操作に従事する場合は注意させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 脳血管障害、起立性低血圧のある患者
血圧低下により、症状が悪化するおそれがある。
9.1.2 心血管系疾患のある患者
血圧及び脈拍数の変動により、症状が悪化するおそれがある。
9.1.3 角膜障害(角膜内皮細胞の減少等)のある患者
安全性は確立していない。角膜内皮細胞数の減少により角膜浮腫の発現が増加する可能性がある。
9.1.4 急性閉塞隅角緑内障の患者
薬物治療以外に手術療法などを考慮すること。
9.2 腎機能障害患者
9.2.1 重篤な腎障害のある患者
投与しないこと。ブリンゾラミド及びその代謝物は、主に腎より排泄されるため、排泄遅延により副作用があらわれるおそれがある。[2.3参照]
9.3 肝機能障害患者
有効性及び安全性を指標とした臨床試験は実施していない。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。ブリンゾラミドでは、動物実験(ラット:経口投与)で胎盤を通過することが報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ブリモニジン酒石酸塩は、動物実験(ラット:経口投与)で乳汁中に移行することが報告されている5)。また、ブリンゾラミドは、動物実験(ラット:経口投与)で乳汁中に移行することが報告されている。
9.7 小児等
9.7.1 小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.7.2 低出生体重児、新生児、乳児又は2歳未満の幼児には投与しないこと。外国での市販後において、ブリモニジン酒石酸塩点眼液を投与した乳児に無呼吸、徐脈、昏睡、低血圧、低体温、筋緊張低下、嗜眠、蒼白、呼吸抑制及び傾眠があらわれたとの報告がある。[2.2参照]
9.7.3 外国での臨床試験において、0.2%ブリモニジン酒石酸塩点眼液を1日3回投与した場合、2〜7歳の幼児及び小児に高頻度(25〜83%)で傾眠が認められている6)。
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| 降圧剤 | 降圧作用を増強する可能性がある。 | 相加的に降圧作用が増強されると考えられる。 |
| 中枢神経抑制剤 バルビツール酸誘導体 オピオイド系鎮痛剤 鎮静剤 麻酔剤 等 アルコール | 鎮静作用を増強する可能性がある。 | 相加的に鎮静作用が増強されると考えられる。 |
| モノアミン酸化酵素阻害剤 | 血圧変動に影響する可能性がある。 | ノルアドレナリンの代謝及び再取り込みに影響すると考えられる。 |
| 炭酸脱水酵素阻害剤(全身投与) アセタゾラミド 等 | 炭酸脱水酵素阻害剤の全身的な作用に対して相加的な作用を示す可能性があるので、異常が認められた場合には、投与を中止すること。 | 作用が相加的にあらわれる可能性がある。 |
| アスピリン(大量投与) | ブリンゾラミドとアスピリンの双方又は一方の薬剤の副作用が増強されるおそれがあるので、異常が認められた場合には、投与を中止すること。 | 炭酸脱水酵素阻害剤の血漿蛋白結合と腎からの排泄を抑制し、炭酸脱水酵素阻害剤は血液のpHを低下させ、サリチル酸の血漿から組織への移行を高める可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 角膜混濁(頻度不明)[8.3参照]
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 0.1〜1%未満 | 頻度不明 | |
| 過敏症 | 接触皮膚炎、丘疹、発疹、紅斑、蕁麻疹 | |||
| 眼 | 霧視 | 眼刺激、点状角膜炎 | アレルギー性結膜炎注)、眼の異常感、眼の異物感、眼乾燥、眼脂、眼瞼炎、結膜炎、結膜充血、結膜浮腫、硝子体浮遊物 | 眼瞼下垂、眼瞼紅斑、眼瞼浮腫、眼瞼障害、アレルギー性眼瞼炎注)、眼瞼辺縁痂皮、マイボーム腺梗塞、結膜濾胞、結膜蒼白、結膜出血、角結膜炎、乾性角結膜炎、角膜炎、角膜上皮障害(角膜びらん等)、角膜浮腫、麦粒腫、虹彩炎、白内障、硝子体はく離、眼そう痒症、不快感、眼痛、灼熱感、羞明、眼精疲労、流涙増加、視覚障害、視野欠損、視力低下、複視、縮瞳、べとつき感 |
| 循環器 | 低血圧、高血圧、動悸、頻脈、徐脈 | |||
| 呼吸器 | 鼻刺激感、鼻乾燥、鼻炎、鼻出血、副鼻腔炎、咳嗽、呼吸困難、気管支炎、咽頭炎 | |||
| 精神神経系 | 浮動性めまい、回転性めまい、耳鳴、頭痛、失神、うつ病、傾眠、不眠症 | |||
| 消化器 | 味覚異常 | 口内乾燥、口渇、悪心、胃腸障害、下痢、消化不良、嘔気 | ||
| 感染症 | インフルエンザ症候群、感冒、呼吸器感染 | |||
| その他 | 視野検査異常 | 脱毛、皮膚炎、胸部痛、腎疼痛、疣贅、貧血、無力症、疲労、気分不良、緊張亢進、感覚鈍麻、血中ビリルビン増加、血中ブドウ糖増加、血中トリグリセリド増加、血中尿酸増加、高コレステロール血症、赤血球数の減少 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・使用時、キャップを閉じたままよく振ってからキャップを開けて点眼すること。
・薬液汚染防止のため、点眼のとき、容器の先端が直接目に触れないように注意すること。
・患眼を開瞼して結膜嚢内に点眼し、1〜5分間閉瞼して涙嚢部を圧迫させた後、開瞼すること。
・他の点眼剤を併用する場合には、少なくとも10分以上間隔をあけてから点眼すること。
・本剤に含まれているベンザルコニウム塩化物は、ソフトコンタクトレンズに吸着することがあるので、コンタクトレンズを装用している場合は点眼前にレンズを外し、点眼15分以上経過後に再装用すること。
16. 薬物動態
16.1 血中濃度
健康成人(各6例)に本剤、0.1%ブリモニジン酒石酸塩点眼液又は1%ブリンゾラミド懸濁性点眼液をそれぞれ両眼に1滴ずつ単回点眼した。本剤を点眼したときの血漿中ブリモニジン濃度は点眼後0.5時間(中央値)で最高濃度17.0±8.7pg/mL(平均値±標準偏差)を示し、消失半減期は平均2.0時間であった。最高濃度は0.1%ブリモニジン酒石酸塩点眼液と比較してやや低値であった。また、本剤を点眼したときの血液中ブリンゾラミド濃度は、緩やかに上昇し、点眼後24時間から96時間(最終採血時点)までほぼ同程度で推移した。最高濃度は0.0219±0.0134μg/mL(平均値±標準偏差)であり、1%ブリンゾラミド懸濁性点眼液を点眼したときと同程度であった7)。
16.3 分布
有色ウサギの片眼に本剤を30μL単回点眼したときの房水中ブリモニジン及びブリンゾラミド濃度は、各単剤(0.1%ブリモニジン酒石酸塩点眼液又は1%ブリンゾラミド懸濁性点眼液)を同様に点眼したときと同程度であった8)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相比較試験(0.1%ブリモニジン酒石酸塩点眼液対照試験)
観察期として0.1%ブリモニジン酒石酸塩点眼液を4週間投与した後(治療期開始日)の眼圧値が18.0mmHg以上の原発開放隅角緑内障(広義)又は高眼圧症患者を対象に、0.1%ブリモニジン酒石酸塩点眼液を対照とした無作為化単遮蔽(評価者遮蔽)並行群間比較試験において、本剤又は対照薬を両眼に1回1滴、1日2回4週間点眼した。その結果、主要評価項目である治療期4週における眼圧変化値(2時間値)は表1のとおりであり、本剤群の対照薬群に対する優越性が示された9)。
| 薬剤(例数) | 眼圧変化値(mmHg) | 群間差の点推定値(mmHg)[95%両側信頼区間] | 検定結果 |
| 本剤群(173) | −2.9±2.0 | −0.6[−1.0,−0.1] | P=0.0109 |
| 0.1%ブリモニジン酒石酸塩点眼液群(177) | −2.4±2.0 |
本剤群の副作用は178例中23例(12.9%)に認められ、主な副作用は、霧視12例(6.7%)、眼刺激5例(2.8%)、味覚異常4例(2.2%)、結膜充血2例(1.1%)、眼の異常感2例(1.1%)、結膜炎2例(1.1%)であった。
17.1.2 国内第III相比較試験(1%ブリンゾラミド懸濁性点眼液対照試験)
観察期として1%ブリンゾラミド懸濁性点眼液を4週間投与した後(治療期開始日)の眼圧値が18.0mmHg以上の原発開放隅角緑内障(広義)又は高眼圧症患者を対象に、1%ブリンゾラミド懸濁性点眼液を対照とした無作為化単遮蔽(評価者遮蔽)並行群間比較試験において、本剤又は対照薬を両眼に1回1滴、1日2回4週間点眼した。その結果、主要評価項目である治療期4週における眼圧変化値(2時間値)は表2のとおりであり、本剤群の対照薬群に対する優越性が示された10)。
| 薬剤(例数) | 眼圧変化値(mmHg) | 群間差の点推定値(mmHg)[95%両側信頼区間] | 検定結果 |
| 本剤群(181) | −3.7±2.1 | −2.0[−2.4,−1.5] | P<0.0001 |
| 1%ブリンゾラミド懸濁性点眼液群(176) | −1.7±1.9 |
本剤群の副作用は182例中16例(8.8%)に認められ、主な副作用は、霧視6例(3.3%)、点状角膜炎5例(2.7%)であった。
18. 薬効薬理
18.1 作用機序
18.1.1 ブリモニジン酒石酸塩
18.1.2 ブリンゾラミド
ブリンゾラミドは毛様体突起部のII型炭酸脱水酵素を特異的に阻害してHCO3−の生成を抑制し、それに伴いNa+及び水の後房への輸送を抑えることで、房水産生を抑制して眼圧下降作用を示すと考えられている14)15)。有色ウサギ及びカニクイザルを用いたレーザー誘発高眼圧モデルにおいて、1%ブリンゾラミド懸濁性点眼液の点眼投与によって房水産生が抑制されたことが示されている。一方で、ブリンゾラミドは房水流出には影響を及ぼさなかったことから、ブリンゾラミドの眼圧下降作用は房水産生の抑制によるものと考えられている16)。また、健康成人の片眼に1%ブリンゾラミド懸濁液を点眼した試験(フルオロフォトメトリー法)において、房水産生の抑制が認められている17)。
18.2 眼圧下降作用
19. 有効成分に関する理化学的知見
19.1. ブリモニジン酒石酸塩
19.2. ブリンゾラミド
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
プラスチック点眼容器
5mL×5、5mL×10
23. 主要文献
- Maruyama Y,et al., Cornea, 36, 1567-1569, (2017) »PubMed
- Tsujinaka A,et al., Acta Ophthalmol, 97, e948-e949, (2019) »PubMed
- Manabe Y,et al., Eur J Ophthalmol, 30, NP23-NP25, (2020) »PubMed
- Chikama T,et al., Ocul Immunol Inflamm, 31, 1842-1847, (2023) »PubMed
- 社内資料:ブリモニジン酒石酸塩の排泄(承認年月日:2012年1月18日、アイファガン点眼液0.1% CTD2.6.4.6)
- 社内資料:0.2%ブリモニジン酒石酸塩点眼液の海外第III相試験(承認年月日:2012年1月18日、アイファガン点眼液0.1% CTD2.7.6.27)
- 社内資料:国内第I相試験(承認年月日:2020年3月25日、CTD2.7.6.1)
- 社内資料:ウサギに0.1%ブリモニジン酒石酸塩/1%ブリンゾラミド配合懸濁性点眼液及び各単剤を単回点眼投与後の眼組織移行の比較(承認年月日:2020年3月25日、CTD2.6.4.3)
- 社内資料:国内第III相比較試験(0.1%ブリモニジン酒石酸塩点眼液対照試験)(承認年月日:2020年3月25日、CTD2.7.6.2)
- 社内資料:国内第III相比較試験(1%ブリンゾラミド懸濁性点眼液対照試験)(承認年月日:2020年3月25日、CTD2.7.6.3)
- Burke J,et al., Surv Ophthalmol, 41 (S-1), S9-S18, (1996)
- 社内資料:ブリモニジン酒石酸塩溶液のウサギ房水産生に及ぼす影響(承認年月日:2012年1月18日、アイファガン点眼液0.1% CTD2.6.2.2)
- Toris CB,et al., Arch Ophthalmol, 113, 1514-1517, (1995) »PubMed
- 中島正之, あたらしい眼科, 10, 959-964, (1993)
- Iester M, Clin Ophthalmol, 2, 517-523, (2008) »PubMed
- Toris CB,et al., J Ocul Pharmacol Ther, 19, 397-404, (2003) »PubMed
- Ingram CJ,et al., Am J Ophthalmol, 128, 292-296, (1999) »PubMed
- 社内資料:ブリモニジン酒石酸塩溶液の正常眼圧ウサギにおける用量反応性(承認年月日:2012年1月18日、アイファガン点眼液0.1% CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
千寿製薬株式会社
カスタマーサポート室 受付時間 9:00〜17:30(土、日、祝日を除く)
〒541-0048
大阪市中央区瓦町三丁目1番9号
電話:0120-069-618
FAX:06-6201-0577
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
製品情報問い合わせ先
千寿製薬株式会社
カスタマーサポート室 受付時間 9:00〜17:30(土、日、祝日を除く)
〒541-0048
大阪市中央区瓦町三丁目1番9号
電話:0120-069-618
FAX:06-6201-0577
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
FAX:03-6717-1414
26. 製造販売業者等
26.1 製造販売元
千寿製薬株式会社
大阪市中央区瓦町三丁目1番9号
26.2 販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号
26.3 提携
大塚製薬株式会社
東京都千代田区神田司町2-9