医薬品情報
| 総称名 | メラトベル |
|---|---|
| 一般名 | メラトニン |
| 欧文一般名 | Melatonin |
| 製剤名 | メラトニン |
| 薬効分類名 | メラトニン受容体作動性入眠改善剤 |
| 薬効分類番号 | 1190 |
| ATCコード | N05CH01 |
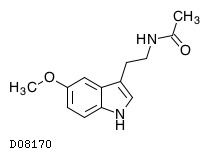
| KEGG DRUG |
D08170
メラトニン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年7月 改訂(第6版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| メラトベル顆粒小児用0.2% | Melatobel granules 0.2% for pediatric | ノーベルファーマ | 1190028D1026 | 207.7円/g | 処方箋医薬品注) |
| メラトベル錠小児用1mg | Melatobel tablets 1mg for pediatric | ノーベルファーマ | 1190028F1027 | 103.9円/錠 | 処方箋医薬品注) |
| メラトベル錠小児用2mg | Melatobel tablets 2mg for pediatric | ノーベルファーマ | 1190028F2023 | 155.9円/錠 | 処方箋医薬品注) |
2. 禁忌
4. 効能または効果
小児期の神経発達症に伴う入眠困難の改善
5. 効能または効果に関連する注意
5.1 神経発達症の診断は、米国精神医学会の精神疾患の診断・統計マニュアル第5版(DSM-5注))に基づき慎重に実施し、基準を満たす場合にのみ投与すること。
5.2 入床を一定の時間帯にするなどの睡眠衛生指導や、可能な場合には行動療法的治療を実施し、入眠潜時の延長のある患者に投与すること。
5.3 6歳未満又は16歳以上の患者における有効性及び安全性は確立していない(当該年齢の患者を対象とした臨床試験は実施していない)。[9.7参照]
注)Diagnostic and Statistical Manual of Mental Disorders,Fifth Edition
6. 用法及び用量
通常、小児にはメラトニンとして1日1回1mgを就寝前に経口投与する。なお、症状により適宜増減するが、1日1回4mgを超えないこと。
7. 用法及び用量に関連する注意
7.1 本剤は、就寝の直前に服用させること。また、服用して就寝した後、睡眠途中において一時的に起床して作業等をする可能性があるときには服用させないこと。
7.2 増量にあたっては患者ごとに睡眠状況を観察しながら行い、1週間以上の間隔を空けること。
7.3 最高血中濃度が低下するおそれがあるため、本剤は食事と同時又は食直後の服用は避けること。[16.2.1参照]
8. 重要な基本的注意
8.1 本剤の連用中における投与中止により、神経発達症に伴う諸症状又は睡眠障害の悪化があらわれることがあるので、投与を中止する際には患者の状態を慎重に観察すること。
8.2 投与開始3ヵ月後を目途に入眠困難に対する有効性及び安全性を評価し、有効性を認めない場合には投与中止を考慮し、漫然と投与しないこと。また、その後も定期的に本剤の有効性及び安全性を評価した上で、投与継続の必要性について検討すること。[17.1.1、17.1.2参照]
8.3 眠気、めまい等があらわれることがあるので、患者又は保護者等に対し、機械操作などを行う際には十分に注意を与えること。ただし、危険を伴う機械操作に従事する高年齢の小児に対しては、本剤投与中には当該操作を行わないように十分に注意を与えること。
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
腎機能障害患者では、腎機能正常者とは異なる内因性メラトニンの濃度推移が報告されていることから、本剤の効果が減弱する可能性がある。なお、腎機能障害患者を対象とした有効性及び安全性を指標とした臨床試験は実施していない。[16.6.1参照]
9.3 肝機能障害患者
本剤の血中濃度が上昇し、作用が強くあらわれるおそれがある。また、肝機能障害患者では、肝機能正常者とは異なる内因性メラトニンの濃度推移が報告されていることから、本剤の効果が減弱する可能性がある。なお、肝機能障害患者を対象とした有効性及び安全性を指標とした臨床試験は実施していない。[16.6.2参照]
9.5 妊婦
9.6 授乳婦
本剤投与中は治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で本剤の乳汁移行が認められている3)。
9.7 小児等
低出生体重児、新生児、乳児又は6歳未満の幼児を対象とした有効性及び安全性を評価する臨床試験は実施していない。[5.3参照]
10. 相互作用
相互作用序文
本剤は主としてCYP1A2により代謝される。その他、CYP1A1、CYP1B1及びCYP2C19が代謝に関与している。[16.4参照]
薬物代謝酵素用語
CYP1A2
薬物代謝酵素用語
CYP1A1
薬物代謝酵素用語
CYP1B1
薬物代謝酵素用語
CYP2C19
10.1 併用禁忌
10.2 併用注意
11. 副作用
11.2 その他の副作用
| 1%以上 | 0.1〜1%未満 | |
| 代謝および栄養 | 高カリウム血症 | |
| 精神神経系 | 傾眠(4.2%)、頭痛 | 易刺激性、ねごと、激越、鎮静、落ち着きのなさ、睡眠障害 |
| 呼吸器 | いびき | |
| 消化器 | 悪心、腹痛、口内炎 | |
| 筋・骨格 | 肩こり | |
| 腎・尿路 | 蛋白尿、血尿 | |
| 一般・全身 | 疲労、倦怠感 | |
| 臨床検査 | 肝機能検査値上昇 | 好酸球数増加、尿pH上昇、尿比重増加、尿中ウロビリノーゲン増加、AST増加 |
14. 適用上の注意
14.1 薬剤交付時の注意
<錠>
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜に刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与(健康成人)
メラトニン0.2mg注1)を男性6例、1mgを男性6例、5mg注1)を男性及び女性各6例に空腹時に単回経口投与したとき、血清中メラトニン濃度の薬物動態パラメータ及び濃度推移は表1及び図1のとおりである9)。
| 投与量注1) | Cmax(pg/mL) | tmax(hr) | AUC0-10h(pg・h/mL) | t1/2(hr) |
| 0.2mg | 266(142) | 0.21(0.05) | 317(232) | 2.46(1.73) |
| 1mg | 1920(1167) | 0.32(0.22) | 2225(1260) | 1.41(0.42) |
| 5mg | 10315(5286) | 0.28(0.11) | 9810(4057) | 1.13(0.34) |
図1 健康成人にメラトニンを空腹時に単回投与したときの血清中濃度推移(平均±標準偏差)
16.1.2 単回投与(幼児及び小児)
メラトニン0.04mg/kg注1)を2〜5歳の6例(投与量0.5〜0.9mg/body注1))及び6〜15歳の6例(投与量0.8〜3.3mg/body注1))に単回経口投与したとき、血清中メラトニン濃度の薬物動態パラメータ及び濃度推移は表2及び図2のとおりである10)。
| 年齢 | Cmax(pg/mL) | tmax(hr) | AUC0-3h(pg・h/mL) | t1/2(hr) |
| 全年齢 | 2574(982) | 0.33(0.12) | 3819(1064) | 2.70(5.11) |
| 2〜5歳 | 2902(1027) | 0.33(0.13) | 4027(993) | 1.39(1.46) |
| 6〜15歳 | 2246(900) | 0.33(0.13) | 3612(1183) | 4.01(7.16) |
図2 幼児及び小児にメラトニンを単回投与したときの血清中濃度推移(平均±標準偏差)
16.1.3 生物学的同等性試験
健康成人男性48例にメラトニン錠2mg 1錠及びメラトニン顆粒0.2% 1g(いずれもメラトニンとして2mg)をクロスオーバー法により絶食時に単回経口投与したときの血清中メラトニン濃度の薬物動態パラメータ(Cmax及びAUCt)及び濃度推移は表3及び図3のとおりである。Cmax及びAUCtの対数の平均値の差について90%信頼区間はlog(0.80)〜log(1.25)の範囲内であったことから、両製剤は生物学的に同等であることが確認された11)。
メラトニン錠1mgは「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン」に基づき、メラトニン錠2mgを標準製剤としたとき、溶出挙動は同等と判定され、生物学的に同等とみなされた。
メラトニン錠1mgは「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン」に基づき、メラトニン錠2mgを標準製剤としたとき、溶出挙動は同等と判定され、生物学的に同等とみなされた。
| 製剤 | Cmax(pg/mL) | AUCt(pg・hr/mL) |
| メラトニン錠2mg | 5099.32(3565.65) | 4172.39(2890.04) |
| メラトニン顆粒0.2% | 5267.35(3927.82) | 4452.34(2806.60) |
図3 製剤群別の血清中メラトニン濃度推移(平均±標準偏差)
16.2 吸収
16.2.1 食事の影響
16.2.2 バイオアベイラビリティ
16.3 分布
16.4 代謝
16.5 排泄
主要代謝物である6-SMTは、腎臓から尿中排泄される。メラトニン0.2〜5mg注1)を健康成人に投与したとき、投与後24時間までの尿中排泄量の約90%が投与後10時間までに排泄された9)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
16.6.2 肝機能障害患者
16.7 薬物相互作用
16.7.1 フルボキサミンマレイン酸塩
16.7.2 カフェイン
16.7.3 喫煙
注1)本剤の承認された用法及び用量は、1日通常1mg、最大4mgの単回経口投与である。
注2)Cockcroft-Gault式による
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II/III相試験
6〜15歳の自閉スペクトラム症に伴う睡眠障害患者を対象とした二重盲検比較試験において、主要評価項目である投与2週間後の電子睡眠日誌による入眠潜時の変化量は、プラセボ群(n=66)の中央値が−5.0分であったのに対して、メラトニン顆粒をメラトニンとして1mg群(n=65)及び4mg群(n=65)では中央値がそれぞれ−22.0分及び−28.0分であり、統計学的に有意な短縮を認めた(いずれもP<0.0001)。
本剤投与時の副作用は、プラセボ群で4.5%(3/66例)、1mg群で0%(0/65例)、4mg群で7.7%(5/65例)に発現し、主な副作用は、傾眠(プラセボ群3.0%(2/66例)、4mg群3.1%(2/65例))であった。
無作為化期の後の非盲検期に、本剤1mg/日を1日1回就寝前に1週間以上経口投与した後、効果不十分で安全性が許容できる場合は本剤1、2又は4mgで適宜増減することとされ(投与期間は42日間)、非盲検期の副作用は本剤群の5.2%(10/193例)に発現し、主な副作用は、傾眠3.1%(6/193例)及び頭痛1.0%(2/193例)であった21)。[8.2参照]
本剤投与時の副作用は、プラセボ群で4.5%(3/66例)、1mg群で0%(0/65例)、4mg群で7.7%(5/65例)に発現し、主な副作用は、傾眠(プラセボ群3.0%(2/66例)、4mg群3.1%(2/65例))であった。
無作為化期の後の非盲検期に、本剤1mg/日を1日1回就寝前に1週間以上経口投与した後、効果不十分で安全性が許容できる場合は本剤1、2又は4mgで適宜増減することとされ(投与期間は42日間)、非盲検期の副作用は本剤群の5.2%(10/193例)に発現し、主な副作用は、傾眠3.1%(6/193例)及び頭痛1.0%(2/193例)であった21)。[8.2参照]
17.1.2 国内第III相試験
18. 薬効薬理
18.1 作用機序
メラトニンは視交叉上核のMT1及びMT2受容体を活性化することで視交叉上核の神経活動を調節し、睡眠の誘導作用を示すと考えられる。
18.2 睡眠に対する作用
19. 有効成分に関する理化学的知見
19.1. メラトニン
20. 取扱い上の注意
<顆粒>
20.1 ボトル包装品を分包した場合は、遮光して保存すること。
<錠>
20.2 PTPシートから取り出した後は、遮光して保存すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<メラトベル顆粒小児用0.2%>
100g[瓶]
<メラトベル錠小児用1mg>
100錠[10錠(PTP)×10]
<メラトベル錠小児用2mg>
100錠[10錠(PTP)×10]
23. 主要文献
- 社内資料:ウサギを用いた経口投与による胚・胎児発生に関する試験(2020年3月25日承認、申請資料概要4.2.3.5.2-3)
- 社内資料:ラットを用いた経口投与による出生前及び出生後の発生並びに母体の機能に関する試験(2020年3月25日承認、申請資料概要4.2.3.5.3-1)
- Reppert SM,et al., Endocrinology., 102 (2), 582-8, (1978) »PubMed
- Hartter S,et al., Clin Pharmacol Ther., 67 (1), 1-6, (2000) »PubMed
- Hartter S,et al., Br J Clin Pharmacol., 56 (6), 679-82, (2003) »PubMed
- Ursing C,et al., Eur J Clin Pharmacol., 61 (3), 197-201, (2005) »PubMed
- Kostoglou-Athanassiou I,et al., Clin Endocrinol(Oxf)., 48 (1), 31-7, (1998) »PubMed
- Terzolo M,et al., Clin Endocrinol(Oxf)., 39 (2), 185-91, (1993) »PubMed
- 社内資料:第I相試験(2020年3月25日承認、申請資料概要5.3.3.1-1)
- 社内資料:臨床薬理試験(小児PK)(2020年3月25日承認、申請資料概要5.3.3.1-2)
- 社内資料:錠剤と顆粒剤の生物学的同等性試験(2025年3月14日承認、申請資料概要2.7.6.1)
- Fourtillan JB,et al., Biopharm Drug Dispos., 21 (1), 15-22, (2000) »PubMed
- Andersen LP,et al., BMC Pharmacol Toxicol., 17, 8, (2016) »PubMed
- DeMuro RL et al., J Clin Pharmacol., 40 (7), 781-4, (2000)
- Di WL,et al., N Engl J Med., 336 (14), 1028-9, (1997) »PubMed
- Morin D,et al., Pharmacology., 54 (5), 271-5, (1997) »PubMed
- Ma X,et al., Drug Metab Dispos., 33 (4), 489-94, (2005) »PubMed
- Koch BC,et al., Nephrol Dial Transplant., 25 (2), 513-9, (2010) »PubMed
- Chojnacki C,et al., Pol Arch Med Wewn., 122 (9), 392-6, (2012) »PubMed
- Iguchi H,et al., J Clin Endocrinol Metab., 54 (5), 1025-7, (1982) »PubMed
- 社内資料:第II/III相試験(2020年3月25日承認、申請資料概要5.3.5.1-1)
- 社内資料:第III相試験(2020年3月25日承認、申請資料概要5.3.5.2-1)
- Yukuhiro N,et al., Brain Res., 1027 (1-2), 59-66, (2004) »PubMed
- Zhdanova IV,et al., Physiol Behav., 75 (4), 523-9, (2002) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
ノーベルファーマ株式会社
カスタマーセンター
〒104-0033
東京都中央区新川1-17-24
電話:フリーダイヤル:0120-003-140
製品情報問い合わせ先
ノーベルファーマ株式会社
カスタマーセンター
〒104-0033
東京都中央区新川1-17-24
電話:フリーダイヤル:0120-003-140
26. 製造販売業者等
26.1 製造販売元
ノーベルファーマ株式会社
東京都中央区新川1-17-24