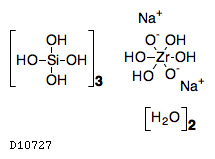医薬品情報
| 総称名 | ロケルマ |
|---|---|
| 一般名 | ジルコニウムシクロケイ酸ナトリウム水和物 |
| 欧文一般名 | Sodium Zirconium Cyclosilicate Hydrate |
| 製剤名 | ジルコニウムシクロケイ酸ナトリウム水和物 |
| 薬効分類名 | 高カリウム血症改善剤 |
| 薬効分類番号 | 2190 |
| ATCコード | V03AE10 |
| KEGG DRUG |
D10727
ジルコニウムシクロケイ酸ナトリウム水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ロケルマ懸濁用散分包5g | LOKELMA 5g powder for suspension(single-dose package) | アストラゼネカ | 2190040B1020 | 1024.3円/包 | 処方箋医薬品注) |
| ロケルマ懸濁用散分包10g | LOKELMA 10g powder for suspension(single-dose package) | アストラゼネカ | 2190040B2027 | 1504.6円/包 | 処方箋医薬品注) |
4. 効能または効果
高カリウム血症
5. 効能または効果に関連する注意
6. 用法及び用量
通常、成人には、開始用量として1回10gを水で懸濁して1日3回、2日間経口投与する。なお、血清カリウム値や患者の状態に応じて、最長3日間まで経口投与できる。以後は、1回5gを水で懸濁して1日1回経口投与する。なお、血清カリウム値や患者の状態に応じて適宜増減するが、最高用量は1日1回15gまでとする。
血液透析施行中の場合には、通常、1回5gを水で懸濁して非透析日に1日1回経口投与する。なお、最大透析間隔後の透析前の血清カリウム値や患者の状態に応じて適宜増減するが、最高用量は1日1回15gまでとする。
7. 用法及び用量に関連する注意
7.1 本剤投与開始3日目に1回10gを1日3回投与する場合には、3日目の投与前に血清カリウム値が治療目標値に達していないことを確認すること。また、本剤投与開始3日後にも血清カリウム値が治療目標値に達していない場合は、他の治療方法を検討すること(血液透析施行中を除く)。
7.3 増量を行う場合は5gずつとし、1週間以上の間隔を空けること。
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心不全のある患者
心不全の悪化の兆候について注意深く観察すること。本剤はナトリウムを含有することから、特にナトリウム摂取増加による体液量の増加や代償不全を引き起こす可能性のある患者では、心不全が増悪するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
相互作用序文
本剤は水素イオンを吸着して一時的に胃内pHを上昇させる可能性がある。[16.7.1参照]
10.2 併用注意
| 抗HIV薬 アタザナビル硫酸塩 ネルフィナビルメシル酸塩 リルピビリン塩酸塩 等 アゾール系抗真菌剤 イトラコナゾール フルコナゾール ボリコナゾール 等 チロシンキナーゼ阻害剤 エルロチニブ塩酸塩 ダサチニブ水和物 ニロチニブ塩酸塩水和物 等 | これらの薬剤の作用を減弱する可能性がある。 本剤との同時投与は避けること。 これらの薬剤の投与が必要な場合には、本剤投与の少なくとも2時間前又は2時間後に投与すること。 | 本剤の胃内pHに及ぼす影響により、これらの薬剤の溶解性が低下し、吸収が低下する可能性がある。 |
| タクロリムス(経口剤) [16.7.2参照] | タクロリムス(経口剤)の作用が減弱する可能性がある。 タクロリムスの投与が必要な場合には、本剤投与の少なくとも2時間前又は2時間後に投与すること。 | 本剤との併用によりタクロリムスの血漿中濃度が低下したとの報告がある。その機序は明らかではないが、本剤による胃内pHの上昇に起因すると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.2 うっ血性心不全(0.5%)
11.2 その他の副作用
| 10%未満 | |
| 一般・全身障害および投与部位の状態 | 浮腫(浮腫、体液貯留、全身性浮腫、末梢性浮腫及び末梢腫脹) |
| 消化器 | 便秘 |
12. 臨床検査結果に及ぼす影響
本剤服用患者の腹部X線撮影時には、本剤が存在する胃腸管に陰影を認める可能性がある。
13. 過量投与
14. 適用上の注意
14.1 薬剤交付時の注意
以下の点について患者に指導すること。
14.1.1 分包内の全ての薬剤を容器に空け、約45mLの水に懸濁すること。
14.1.2 本剤は溶解しないため、十分に懸濁し、沈殿する前に服用すること。沈殿した場合は、再び懸濁して服用すること。服用後に容器に本剤が残っていないことを確認すること。
14.1.3 懸濁後の薬剤は保管せず、廃棄すること。
16. 薬物動態
16.1 血中濃度
高カリウム血症患者29例に本剤を5〜15gの用量で1日1回反復経口投与したところ、血液中には本剤に由来すると考えられるジルコニウムは検出されなかった1)(外国人データ)。
16.2 吸収
本剤の粒子径は消化管粘膜の細胞間隙の大きさに比較し極めて大きく、分子構造は生理的温度で安定であることから、消化管から体内に吸収されないと考えられる。
16.5 排泄
高カリウム血症患者29例に本剤を5〜15gの用量で1日1回反復経口投与したところ、尿中には本剤に由来するジルコニウムは検出されなかった1)(外国人データ)。
16.7 薬物相互作用
16.7.1 抗HIV薬、アゾール系抗真菌剤、チロシンキナーゼ阻害剤等
16.7.2 その他の薬剤
本剤とクロピドグレル、ダビガトラン、グリピジド(国内未承認)、ロサルタン、フロセミド、アトルバスタチン、アムロジピン、ワルファリン又はレボチロキシンを併用投与し、併用薬の吸収に及ぼす本剤の影響を検討した結果は下表のとおりであった。クロピドグレル及びダビガトランの曝露量が低下し、アトルバスタチン、フロセミド及びワルファリンのCmaxが増加したが、これらの影響は臨床的に問題となるものではなく、用量調整を必要とするものではないと考えられた3)(外国人データ)。
本剤とタクロリムスの非徐放性製剤の併用投与により、タクロリムスのAUC及びCmaxはそれぞれ63%(90%信頼区間:56%〜71%)及び71%(90%信頼区間:65%〜77%)に低下した4)(外国人データ)。[10.2参照]
本剤とタクロリムスの非徐放性製剤の併用投与により、タクロリムスのAUC及びCmaxはそれぞれ63%(90%信頼区間:56%〜71%)及び71%(90%信頼区間:65%〜77%)に低下した4)(外国人データ)。[10.2参照]
| 併用薬(経口投与) | 併用薬の投与量 | 例数 | 測定対象 | Cmax | AUC0-t |
| アムロジピン | 5mg | 18 | アムロジピン | 1.11[1.02,1.20] | 1.05[1.00,1.11] |
| クロピドグレル | 75mg | 24 | クロピドグレルカルボン酸体a) | 0.68[0.57,0.82] | 0.88[0.82,0.94] |
| ダビガトラン | 75mg | 24 | ダビガトラン | 0.57[0.40,0.82] | 0.59[0.40,0.88] |
| アトルバスタチン | 10mg | 24 | アトルバスタチン | 1.69[1.44,1.97] | 1.04[0.95,1.14] |
| グリピジド | 5mg | 24 | グリピジド | 1.04[0.92,1.17] | 1.02[0.95,1.10] |
| フロセミド | 20mg | 24 | フロセミド | 1.66[1.10,1.71] | 1.06[0.98,1.15] |
| レボチロキシン | 50μg | 18 | レボチロキシン | 1.04[1.00,1.08] | 1.06[1.02,1.09] |
| ロサルタン | 25mg | 18 | ロサルタン | 0.98[0.74,1.30] | 1.03[0.93,1.15] |
| ワルファリン | 5mg | 18 | R-ワルファリン | 1.34[1.21,1.49] | 1.07[1.03,1.12] |
| S-ワルファリン | 1.38[1.18,1.62] | 1.12[1.07,1.17] |
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II/III相用量設定試験5)
高カリウム血症患者103例を対象に、本剤10g、本剤5g又はプラセボのいずれかを1日3回(TID)48時間投与した。主要評価項目である、初回投与48時間後までの血清カリウム値のexponential rate of change(単位時間あたりの血清カリウム値の変化を示す指標)は、以下の表のとおりであり、本剤10gTID群と5gTID群はプラセボ群と比較していずれも有意差が認められた(いずれもp<0.0001)。
| プラセボ群(33例) | 本剤5gTID群(34例) | 本剤10gTID群(36例) | |
| exponential rate of change(×10−3)[95%信頼区間] | −0.12[−0.69,0.45] | −2.73[−3.28,−2.19] | −5.08[−5.61,−4.55] |
| プラセボ群との群間差a)[95%信頼区間] | − | −2.61[−3.37,−1.85] | −4.96[−5.71,−4.20] |
| p値a) | − | <0.0001 | <0.0001 |
| ベースラインの血清カリウム値(mmol/L)b) | 5.65±0.42 | 5.57±0.39 | 5.46±0.37 |
| 投与48時間後の血清カリウム値(mmol/L)b) | 5.36±0.38 | 4.74±0.34 | 4.16±0.47 |
| 投与48時間後のベースラインからの平均変化量(mmol/L)b) | −0.24±0.34 | −0.83±0.31 | −1.30±0.48 |
また、血清カリウム値正常化割合(血清カリウム値が3.5mmol/L以上5.0mmol/L以下の患者割合)は以下の表のとおりであった。
| プラセボ群(33例) | 本剤5gTID群(34例) | 本剤10gTID群(36例) | |
| 投与24時間後の正常化割合 | 27.3(9) | 35.3(12) | 83.3(30) |
| プラセボ群に対するオッズ比[95%信頼区間] | − | 1.347[0.419,4.329] | 15.334[4.006,58.697] |
| 投与48時間後の正常化割合 | 15.2(5) | 85.3(29) | 91.7(33) |
| プラセボ群に対するオッズ比[95%信頼区間] | − | 46.495[10.142,213.152] | 71.835[13.497,382.337] |
浮腫関連の副作用の発現はなかった。副作用として報告された便秘は本剤5gTID群で1例(2.9%)に認められ、本剤10gTID群及びプラセボ群での報告はなかった。副作用として報告されたうっ血性心不全の発現はなかった。血清カリウム値が3.5mmol/Lを下回った患者は、本剤10gTID群で2例(5.6%)、本剤5gTID群及びプラセボ群で0例であった。
17.1.2 国際共同第III相試験(HARMONIZE Global試験)6)
高カリウム血症患者267例(うち日本人68例)を対象に本剤10gTIDを48時間投与し、正常カリウム値(3.5-5.0mmol/L)に達した患者に本剤10g(99例[うち日本人27例])、本剤5g(99例[うち日本人26例])又はプラセボ(50例[うち日本人13例])のいずれかを1日1回(QD)28日間投与した。
補正期において、投与24時間後及び48時間後に正常カリウム値に達した患者の割合は、それぞれ63.3%及び89.1%であった。投与開始48時間後の血清カリウム値の平均変化量は−1.28mmol/Lであった(図1)。[5.1、18.4参照]
補正期において、投与24時間後及び48時間後に正常カリウム値に達した患者の割合は、それぞれ63.3%及び89.1%であった。投与開始48時間後の血清カリウム値の平均変化量は−1.28mmol/Lであった(図1)。[5.1、18.4参照]
図1 平均血清カリウム値(95%信頼区間)の推移(最大の解析対象集団):補正期
主要評価項目である、22日間(Day8〜29)の血清カリウム値の最小二乗幾何平均は、本剤10gQD群、5gQD群及びプラセボ群それぞれ4.4、4.8、5.3mmol/Lであり、プラセボ群と比較していずれも有意に低値であった(いずれもp<0.001)(図2)。
図2 平均血清カリウム値(95%信頼区間)の推移(最大の解析対象集団):維持期(補正期からの推移を含む)
維持期の浮腫関連の副作用として、本剤10gQD群で浮腫2例(2.0%)、本剤5gQD群で末梢性浮腫1例(1.0%)が報告され、プラセボ群での報告はなかった。副作用として報告された便秘は、本剤10gQD群3例(3.0%)、本剤5gQD群1例(1.0%)に認められ、プラセボ群での報告はなかった。副作用として報告されたうっ血性心不全の発現はなかった。血清カリウム値が3.5mmol/Lを下回った患者は、本剤10gQD群で10例(10.1%)、5gQD群で6例(6.1%)、プラセボ群で1例(2.0%)であった。
17.1.3 国内第III相長期投与試験7)
高カリウム血症患者150例を対象に本剤10gTIDを正常カリウム値(3.5-5.0mmol/L)に達するまで、最長72時間投与し、正常化した時点で52週間の維持期に移行した。維持期では本剤を5gQDを開始用量として、カリウム値に応じ、最小5g隔日投与又は2.5gQDから最大15gQDまで増減した。
投与24、48及び72時間後に正常カリウム値に達した患者の割合は、それぞれ65.3%、81.3%及び82.0%であった。
維持期において、平均血清カリウム値が5.1mmol/L以下であった患者の割合は93.3%(140/150例)で、全例(150/150例)で平均血清カリウム値が5.5mmol/L以下であった。
維持期の浮腫関連の副作用として、末梢性浮腫6例(4.0%)、全身性浮腫2例(1.3%)、体液貯留2例(1.3%)が報告された。副作用として報告された便秘は10例(6.7%)に認められた。副作用として報告されたうっ血性心不全は2例(1.3%)に認められた。血清カリウム値が3.5mmol/Lを下回った患者は、29例(19.3%)であった。
投与24、48及び72時間後に正常カリウム値に達した患者の割合は、それぞれ65.3%、81.3%及び82.0%であった。
維持期において、平均血清カリウム値が5.1mmol/L以下であった患者の割合は93.3%(140/150例)で、全例(150/150例)で平均血清カリウム値が5.5mmol/L以下であった。
維持期の浮腫関連の副作用として、末梢性浮腫6例(4.0%)、全身性浮腫2例(1.3%)、体液貯留2例(1.3%)が報告された。副作用として報告された便秘は10例(6.7%)に認められた。副作用として報告されたうっ血性心不全は2例(1.3%)に認められた。血清カリウム値が3.5mmol/Lを下回った患者は、29例(19.3%)であった。
17.1.4 国際共同第III相試験(DIALIZE試験)8)
血液透析患者196例(本剤群97例[うち日本人28例]、プラセボ群99例[うち日本人28例])を対象に、最大透析間隔(血液透析日以外の2日間)後の血液透析前のカリウム値を4.0-5.0mmol/Lに維持するよう、本剤5gを開始用量として、非透析日に1日1回、最大15gまで増減し4週間投与し、その後本剤の用量を変更せず更に4週間投与した。
本剤群ではプラセボ群と比較して奏効例(後半の4週間における最大透析間隔後の4回中3回で透析前血清カリウム値が4.0-5.0mmol/Lで、レスキュー治療を受けなかった患者の割合)が有意に高かった(41.2% vs 1.0%;p<0.001)。
浮腫関連の副作用として、プラセボ群で末梢腫脹1例(1.0%)が報告され、本剤群での報告はなかった。水分貯留及びナトリウム貯留のサロゲートマーカーである透析間の体重増加に本剤群とプラセボ群で差は認められなかった。副作用として報告された便秘は、本剤群2例(2.1%)、プラセボ群1例(1.0%)に認められた。副作用として報告されたうっ血性心不全の発現はなかった。透析前の血清カリウム値が3.5mmol/Lを下回った患者は、本剤群で5例(5.2%)、プラセボ群で5例(5.1%)であった。
本剤群ではプラセボ群と比較して奏効例(後半の4週間における最大透析間隔後の4回中3回で透析前血清カリウム値が4.0-5.0mmol/Lで、レスキュー治療を受けなかった患者の割合)が有意に高かった(41.2% vs 1.0%;p<0.001)。
浮腫関連の副作用として、プラセボ群で末梢腫脹1例(1.0%)が報告され、本剤群での報告はなかった。水分貯留及びナトリウム貯留のサロゲートマーカーである透析間の体重増加に本剤群とプラセボ群で差は認められなかった。副作用として報告された便秘は、本剤群2例(2.1%)、プラセボ群1例(1.0%)に認められた。副作用として報告されたうっ血性心不全の発現はなかった。透析前の血清カリウム値が3.5mmol/Lを下回った患者は、本剤群で5例(5.2%)、プラセボ群で5例(5.1%)であった。
18. 薬効薬理
18.1 作用機序
本剤は、均一な微細孔構造を有する非ポリマーの無機結晶であり、カリウムイオンを選択的に捕捉して水素イオン及びナトリウムイオンと交換する。本剤は、カリウムを捕捉して糞中に排泄させ、消化管内腔における遊離カリウム濃度を低下させることにより、血清カリウム濃度を低下させ高カリウム血症の改善をもたらす。
18.2 陽イオン選択性
In vitroにおいて本剤は、カルシウムやマグネシウムのような他のイオンの存在下でも、カリウムイオンに対する高い選択性を示す9)。
18.3 pHによるカリウム交換容量への影響
本剤が低濃度(5mg/mL以下)の場合に、pH1.2ではpH4.5及び6.8と比較してカリウム交換容量が低かったが、いずれのpHにおいてもカリウム交換能が示された9)。そのため、本剤は消化管全体にわたってカリウムを捕捉すると考えられる。
18.4 ヒトにおける薬力学的作用
19. 有効成分に関する理化学的知見
19.1. ジルコニウムシクロケイ酸ナトリウム水和物
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<ロケルマ懸濁用散分包5g>
28包
<ロケルマ懸濁用散分包10g>
28包
23. 主要文献
- 社内資料:海外第III相試験(ZS-004試験)(2020年3月25日承認、CTD2.7.1.2.2)
- 社内資料:in vitro相互作用試験(2020年3月25日承認、CTD2.6.4.7.8)
- 社内資料:海外第I相試験(ZS-009試験)(2020年3月25日承認、CTD2.7.2.2.2.2)
- Nagard M,et al., Clin Kidney J., 16 (1), 151-158, (2023) »PubMed
- Kashihara N,et al., Clin Exp Nephrol., 24 (12), 1144-53, (2020), (2020 Dec) »PubMed
- Zannad F,et al., ESC Heart Fail., 7 (1), 55-65, (2020), (2020 Feb)
- Kashihara N,et al., Clin Exp Nephrol., 25 (2), 140-9, (2021), (2021 Feb) »PubMed
- Fishbane S,et al., J Am Soc Nephrol., 30 (9), 1723-33, (2019), (2019 Sep) »PubMed
- Stavros F,et al., PLoS One., 9 (12), e114686, (2014), (2014 Dec) »PubMed
- Koshiborod M,et al., JAMA., 312 (21), 2223-33, (2014), (2014 Dec) »PubMed
- 社内資料:海外第I相試験ZS-006試験(2020年3月25日承認、CTD2.7.2.2.2.1)
24. 文献請求先及び問い合わせ先
文献請求先
アストラゼネカ株式会社
メディカルインフォメーションセンター
〒530-0011
大阪市北区大深町3番1号
電話:0120-189-115
製品情報問い合わせ先
アストラゼネカ株式会社
メディカルインフォメーションセンター
〒530-0011
大阪市北区大深町3番1号
電話:0120-189-115
26. 製造販売業者等
26.1 製造販売元
アストラゼネカ株式会社
大阪市北区大深町3番1号